基于GEO 數據庫甲狀腺相關性眼病差異基因免疫浸潤機制研究
尹謝添 趙詩超 向 楠 陳繼東,5 曾明星 周廣文
1.湖北中醫藥大學第一臨床學院,湖北武漢 430061;2.湖北省中醫院風濕免疫科,湖北武漢 430061;3.向楠名醫工作室,湖北武漢 430061;4.湖北省中醫院老年病科,湖北武漢 430061;5.湖北省中醫院內分泌科,湖北武漢 430061;6.湖北中醫藥大學基礎醫學院,湖北武漢 430061;7.湖北中醫藥大學針灸骨傷學院,湖北武漢 430061
甲狀腺相關性眼病(thyroid-associated ophthal mopathy,TAO),又稱為格雷夫斯眼病(Graves’disease,GD)和甲狀腺眼病是一種以眼球后及眼眶周圍組織浸潤性病變為特征的自身免疫性疾病。TAO 以40~60 歲女性多發,男女患病比例為1∶5[1],總發病率約為0.0422‰[2]。20%~50%的格雷夫斯病患者有眼部受累表現[3],其中5.0%~8.6%的患者會發展成嚴重階段[4],如導致甲狀腺功能障礙性視神經病變(dysthyroid optic neuropathy,DON)和暴露性角膜潰瘍等[5]。TAO 臨床癥狀輕者以眼睛充血、畏光、流淚、異物感、疼痛為主要表現;臨床癥狀重者以眼瞼閉合不全、復視、眼球運動障礙、失明為主要表現[6]。其治療包括基本治療(戒煙、眼睛局部治療),維持甲狀腺功能穩定治療,針對突眼治療(糖皮質激素、免疫抑制劑、硒劑、利妥昔單抗、妥珠單抗、放射治療、手術治療)和中草藥治療等[7]。本病對患者生活質量、精神狀況常造成重大影響。TAO 發病機制復雜,目前認為其病因病機主要與環境因素、遺傳因素和免疫因素有關,尤其是免疫因素常被認為是TAO 發生和進展的核心因素[8]。為了明確其相關免疫機制設計本研究,以期通過數據挖掘的方式得出相關結論,以便未來能夠更好地為臨床服務。
1 資料與方法
1.1 TAO 差異表達基因獲取與熱圖、火山圖繪制
使用GEO 數據庫進行檢索,搜索“Graves disease”,物種限制為人,對基因芯片數據進行篩選。選定TAO 前眼眶表達基因作為試驗組,正常人前眼眶表達基因作為對照組。使用R 軟件,設定P <0.05,log FC>0.5,進行差異基因分析,正數代表上調,負數代表下調,獲取上調和下調最顯著的前20 個基因繪制熱圖,同時繪制火山圖,并將所得的差異基因導入表格中。
1.2 核心的差異基因獲取
將得到的兩組差異基因導入STRING 數據庫中,選定物種為人,設定作用閾值“highest confidence=0.900”,隱藏網絡中離散的點,默認其余參數,得出差異基因的蛋白質-蛋白質相互作用(protein-protein interaction,PPI)網絡。同時,對該PPI 網絡進行分析,計算degree 值,其值越高提示該節點在網絡中的地位越核心,并以圖形展示結果。
1.3 差異基因的GO 和KEGG 富集分析
通過R 軟件,將上述差異基因進行GO 富集分析和KEGG 富集分析。設置篩選條件為P value Cutoff<0.05 顯示排名靠前的10 條GO 生物過程和20 條KEGG通路,繪制柱狀圖及氣泡圖。
1.4 獲取免疫浸潤矩陣
CIBERSORT 反卷積算法是基于線性支持向量回歸的機器學習方法,是一種用于評估組織中22 種免疫細胞占比的計算方法。實驗基于R 軟件,鏈接CIBERSORT 反卷積法進行B 細胞、漿細胞、T 細胞、自然殺傷細胞、單核細胞、巨噬細胞、樹突狀細胞、肥大細胞、嗜酸性粒細胞、中性粒細胞等22 種免疫細胞的轉錄特征矩陣模擬計算,計算次數設置在100 次,對P <0.05 的數據進行分析。
1.5 免疫細胞間的相關性分析和組間差異分析
將上述在CIBERSORT 反卷積法中得到的P <0.05的可信樣本數據通過R 軟件進行不同免疫細胞間的相關系數計算,以分析試驗組和對照組組間的差異性及各免疫細胞間的相關性。
2 結果
2.1 TAO 差異表達基因獲取結果
從GEO 數據庫中下載GSE58331 芯片數據與GPL570 平臺數據,共175 個樣本。經過篩選,獲得試驗組TAO 前眼眶表達基因22 個樣本,對照組正常人前眼眶表達基因20 個樣本。通過R 軟件進行相關分析,獲取兩者間差異基因315 個,其中下調基因220 個,上調基因95 個,并選取差異最明顯的前20 個基因繪制熱圖(圖1),同時繪制火山圖(圖2)。
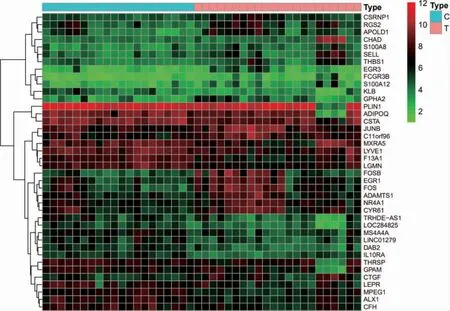
圖1 正常組與試驗組差異基因熱圖(見內文第34 頁)
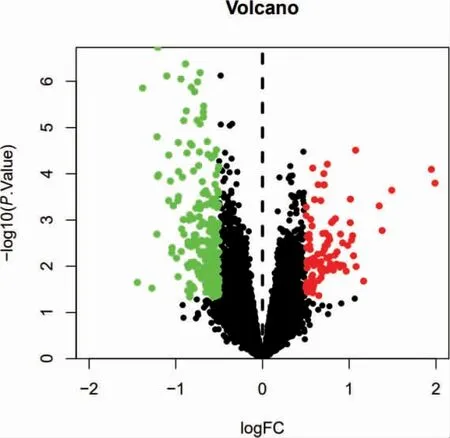
圖2 正常組與試驗組差異基因火山圖(見內文第34 頁)
2.2 核心差異基因獲取結果
使用STRING 數據庫對差異基因進行PPI 分析。在PPI 網絡中,有節點289 個,邊197 條,平均節點degree 值為1.36。該網絡中大于2 倍平均節點degree值的核心基因有56 個,其中degree 值最高的核心差異基因前5 位分別是FOS、JUN、CXCL8、ITGAM 和CXCL12。見圖3~4。
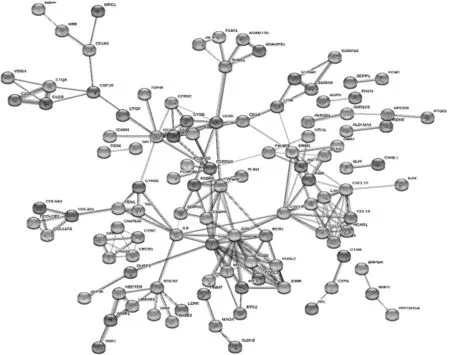
圖3 核心差異基因的PPI 網絡
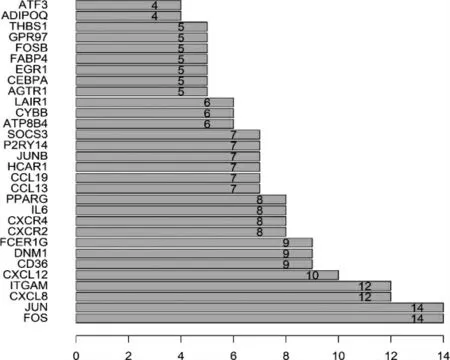
圖4 PPI 網絡中核心差異基因degree 值排序
2.3 差異基因的GO 和KEGG 富集分析結果
使用R 軟件,根據TAO 差異表達基因,進行生物學功能和通路富集分析。其中生物過程有460 條,細胞成分有6 條,分子功能有36 條,KEGG 通路有20 條。根據基因富集數目與顯著程度,選取排名靠前的前10 條BP、CC、MF 和20 條KEGG 通路分別繪制柱狀圖和氣泡圖,見圖5~6。其中涉及的生物過程和KEGG 信號通路均與免疫炎癥關系密切,如圖中所示,主要包括細胞趨化性、白細胞趨化性、白細胞遷移、粒細胞趨化性、單核細胞遷移等GO 生物過程和破骨細胞分化、細胞因子-細胞因子受體相互作用、PI3K-Akt 信號通路、白細胞介素(interleukin-IL)-17信號通路、NF-κB 信號通路、Toll 樣受體信號通路等KEGG 通路。
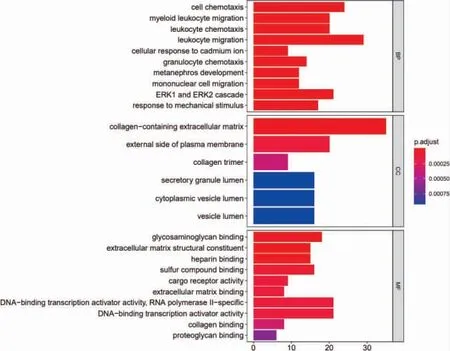
圖5 甲狀腺相關性眼病差異基因GO 富集分析(見內文第35 頁)
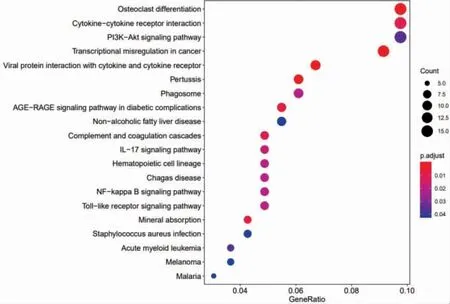
圖6 甲狀腺相關性眼病差異基因KEGG 富集分析(見內文第35 頁)
2.4 免疫浸潤矩陣獲取結果
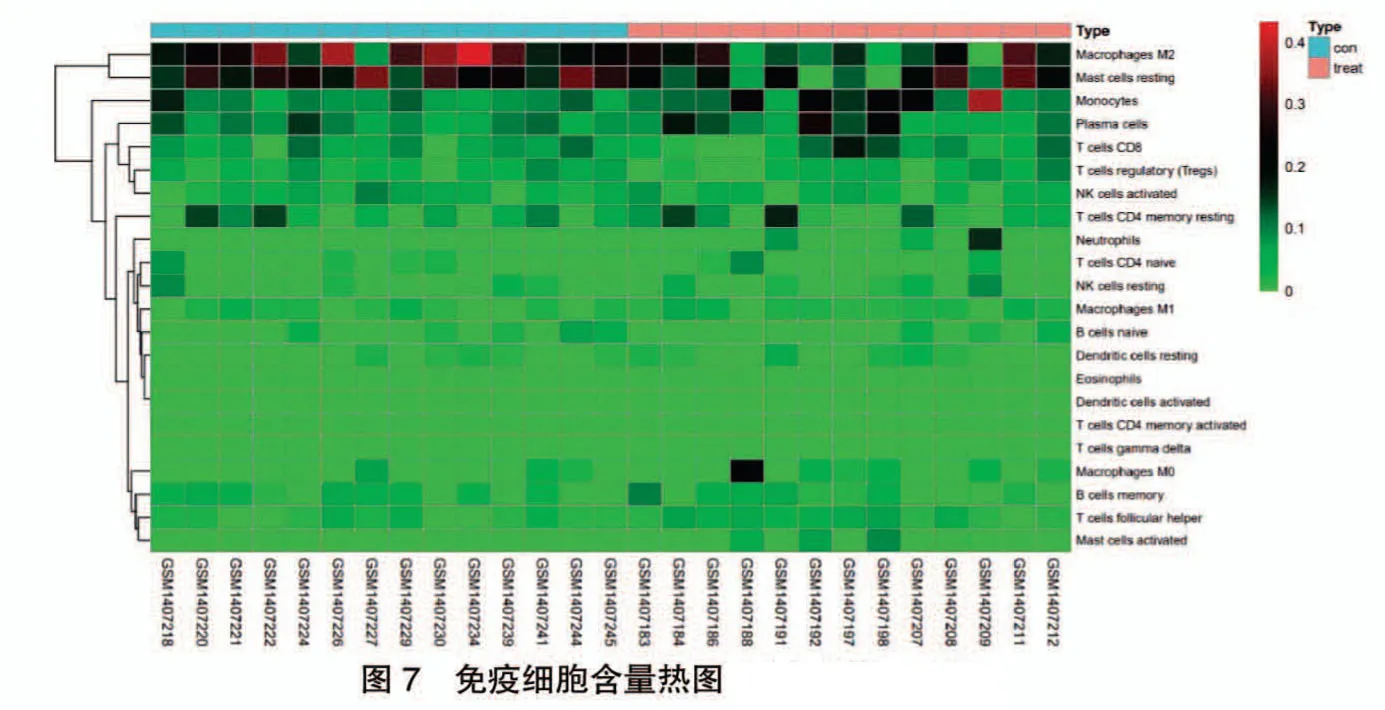
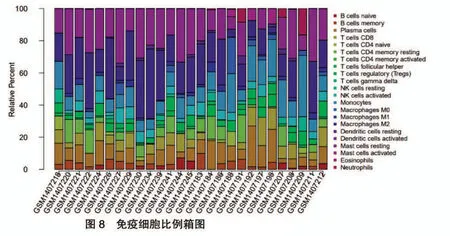
在CIBERSORT 反卷積法中以P <0.05 對TAO與正常人群的前眼眶基因樣本進行篩選,最終獲得27 個可信樣本,其中試驗組13 個,對照組14 個,試驗組用橙色表示,對照組用藍色表示。結果顯示,M2巨噬細胞、未活化的靜息肥大細胞在TAO 試驗組中顯著減少,而單核細胞、漿細胞、中性粒細胞等在TAO試驗組中顯著增加,見圖7。同時予以免疫細胞比例箱圖進一步顯示22 種免疫細胞在各樣本中的浸潤比例,見圖8。
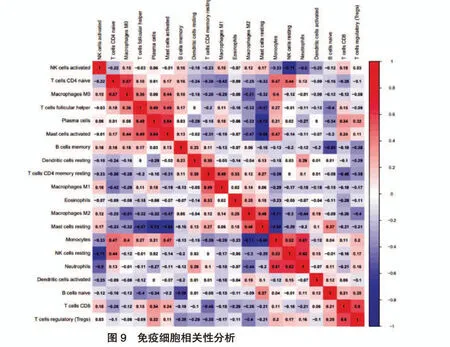
2.5 免疫細胞相關性分析
如圖9 所示,漿細胞和活化的肥大細胞呈顯著正相關(r=0.64),單核細胞和中性粒細胞呈顯著正相關(r=0.61),未活化的自然殺傷細胞和中性粒細胞呈顯著正相關(r=0.62),調節性T 細胞和CD8+T細胞呈顯著正相關(r=0.60)。并且,未活化的靜息肥大細胞和漿細胞呈顯著負相關(r=-0.72),未活化的靜息肥大細胞和活化的肥大細胞呈顯著負相關(r=-0.68),單核細胞和M2 巨噬細胞呈顯著負相關(r=-0.71),單核細胞和未活化的靜息肥大細胞呈顯著負相關(r=-0.66),未活化的自然殺傷細胞和活化的自然殺傷細胞呈顯著負相關(r=-0.71)。見圖9。
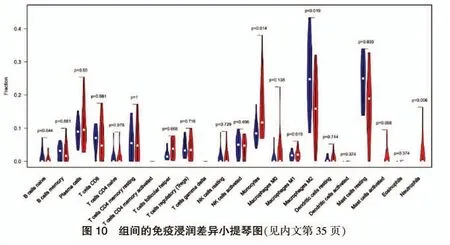
2.6 TAO 試驗組與對照組免疫浸潤差異分析
通過小提琴圖對試驗組與對照組組間的免疫浸潤細胞行差異分析,以P <0.05 為差異有顯著性,試驗組用紅色表示,對照組用藍色表示,得出在試驗組中單核細胞(P=0.014)和中性粒細胞(P=0.006)顯著增高,而M2 巨噬細胞(P=0.019)和未活化的靜息肥大細胞(P=0.039)顯著減少的結論,見圖10。
3 討論
TAO 是一種病因病機復雜且治療效果欠佳的自身免疫性疾病。隨著目前對其越來越深入的研究,其遺傳及免疫因素和抗免疫治療越來越受到臨床重視。本研究通過將TAO 和正常人的前眼眶表達基因進行差異分析,并將得到的差異基因導入STRING 數據庫中進行PPI 分析,共篩選得到與TAO 相關的以FOS、JUN、CXCL8、ITGAM 和CXCL12 為首的56 個核心基因。FOS 與JUN 可能都與細胞凋亡有關。FOS 家族由c-FOS、FOSB、Fra-1、Fra-2 等成員組成,這些基因編碼亮氨酸拉鏈蛋白,JUN 家族由c-Jun、JunB、JunD 等成員組成,c-Jun 是Fas 的轉錄激活因子,FOS 家族與JUN 家族的蛋白質二聚,從而形成轉錄因子復合物激活蛋白-1[9]。FOS 蛋白常被認為是細胞增殖、分化和轉化的調節因子。某些情況下,FOS 基因的表達與凋亡細胞死亡有關。有研究證實,甲狀腺癌增殖轉化過程與c-FOS 及Fra-1 激活密不可分[10-13]。JUN 家族在細胞凋亡調節方面具有雙向作用[14]。有研究證實硼替佐米可磷酸化并激活c-Jun,同時激活Fas 凋亡途徑,促進甲狀腺癌細胞凋亡[15]。趨化因子是一類由細胞分泌的具有化學趨化作用的信號蛋白或小細胞因子,其具有誘導附近反應細胞定向趨化的能力[16]。CXCL8 屬于促炎趨化因子,主要是中性粒細胞的趨化劑,其在病理條件下形成,并積極參與炎癥反應,吸引免疫細胞到炎癥部位,同時也有證據表明CXCL8 具有抑制肥大細胞的作用[17-18]。有研究證實CXCL8 的表達水平檢測,可作為TAO 活動性、病情嚴重程度和眼表功能評估的輔助診斷依據[19]。ITGAM 編碼白細胞黏附分子β2,是白細胞黏附分子整合素β2 亞家族成員,主要介導細胞向炎癥部位的黏附與遷移,和腫瘤的侵襲及轉移密切相關[20]。有研究證實ITGAM 與系統性紅斑狼瘡的發生發展相關,與其免疫過程亦相關[21-22]。CXCL12屬于體內平衡趨化因子,在某些組織中產生,負責基礎白細胞遷移,同時骨髓中生成的CXCL12 能促進骨髓微環境中B 祖細胞增殖。而CXCL12 可能在甲狀腺乳頭癌侵襲、轉移過程中起重要作用[23-24]。本研究所篩選的PPI 主要核心基因均與TAO 免疫細胞炎性浸潤和遷移黏附有關,并與細胞凋亡相關,這和TAO 的發生發展過程相符,進一步說明預測的可靠性。
本研究利用GEO 基因芯片對TAO 和正常人的前眼眶組織進行差異基因的GO 和KEGG 富集分析,提示本病的生物學過程與免疫調節密切相關。其中BP 富集主要涉及細胞趨化性、白細胞趨化性、白細胞遷移、粒細胞趨化性、單核細胞遷移等,進一步顯示TAO 是由多種炎癥細胞因子共同參與的免疫過程。炎癥細胞因子是指由免疫細胞(T 淋巴細胞、B 淋巴細胞、自然殺傷細胞、單核巨噬細胞等)和非免疫細胞(纖維母細胞、表皮細胞、內皮細胞等)經刺激而合成分泌的一類具有生物學活性的小分子物質,其可通過結合相應受體來調控免疫應答與調節細胞生長分化[25]。近年來一系列研究證實[26-28]炎癥細胞和細胞因子與TAO 有一定的關系。KEGG 分析顯示,差異基因的相關通路與破骨細胞分化、細胞因子-細胞因子受體相互作用、PI3K-Akt 信號通路、IL-17 信號通路、NF-κB信號通路、Toll 樣受體信號通路等密切相關。破骨細胞分化與甲狀腺疾病導致的骨質疏松有關[29-31],可能與TAO 的發生發展相關。細胞因子-細胞因子受體相互作用與TAO 的免疫調節有關[32-33],貫穿在TAO 發生發展之中。PI3K-Akt 信號通路在調節細胞代謝、生長、增殖、存活、轉錄及蛋白質合成等方面發揮重要作用,該通路活性不僅能導致細胞惡性轉化,而且與細胞的遷移、黏附、血管增生以及細胞外基質的降解等密切相關[34-35],這均與TAO 的發生發展有關。IL-17 信號通路與TAO 的病情嚴重性相關,有研究證實IL-17有望作為TAO 病情活動性的評價新指標[36-39]。NF-κB信號通路在調節對感染的免疫應答中起關鍵作用,其不正確調節與癌癥、自身免疫病和炎癥有關,有研究[40]證實NF-κB1 基因啟動子區域的多態性可能與TAO的發病具有相關性。Toll 樣受體屬于固有免疫病原模式識別受體,可以識別入侵人體的多種物質,最終導致機體產生促炎性細胞因子、抗炎癥細胞因子和趨化因子,在炎癥、免疫細胞調控、存活和增殖等方面發揮著重要作用,有研究[41]證實TLR9 激活后,可誘導活動期TAO 眼眶成纖維細胞合成和分泌炎癥因子,表明TLR9 可能參與了TAO 活動期眼眶炎癥反應過程。以上多種通路提示TAO 病情的發生發展均與炎癥和免疫相關。
為進一步探討免疫細胞在TAO 中的作用,利用CIBERSORT 反卷積法對兩組前眼眶表達基因樣本進行篩選,結果顯示,在TAO 組中單核細胞和中性粒細胞顯著增高,而M2 巨噬細胞和未活化的靜息肥大細胞顯著減少。在免疫細胞相關性分析中,將22 種免疫細胞兩兩比較,結果顯示,單核細胞和中性粒細胞呈顯著正相關,單核細胞和M2 巨噬細胞呈顯著負相關,單核細胞和未活化的靜息肥大細胞呈顯著負相關,未活化的靜息肥大細胞和活化的肥大細胞呈顯著負相關,以上關系從側面反應了不同的免疫細胞之間在TAO 病程進展過程中存在協同或拮抗作用。本研究預測的結果得到了相關研究的證實,Van 等[42]認為眼眶浸潤的肥大細胞、單核細胞在TAO 中參與了眼眶成纖維細胞的活化,張靈麗等[43]認為TAO 患者外周血中性粒細胞/淋巴細胞較對照組升高,且升高程度與病情活動性有關,駱立夫等[44]認為TAO 眼眶脂肪結締組織中存在大量炎癥細胞和免疫細胞浸潤(以淋巴細胞為主)與成纖維細胞增生。
綜上所述,TAO 是一種甲狀腺器官特異的自身免疫性疾病,免疫學發病機制在其發生發展過程中占據最重要地位,同時炎癥反應也是其重要的發病機制,目前其藥物治療的主要方向即抗免疫和抗炎治療,故對免疫學發病機制深入研究有助于指導TAO 患者的診斷、治療和預后評價。本研究利用生物信息學對TAO前眼眶表達基因芯片進行生物學過程和免疫浸潤分析,對后續相關科研工作具有一定參考意義。

