超聲波聯合乳酸對金黃色葡萄球菌的殺菌效果
張嬌嬌, 吳海虹, 孫晉躍, 孫遠成, 孫芝蘭, 劉 芳,, 徐為民
(1.江蘇大學食品與生物工程學院,江蘇鎮江212013;2.江蘇省農業科學院農產品加工研究所,江蘇南京210014;3.徐州榮炷食品有限公司,江蘇徐州221000)
羊肉營養物質豐富,與豬肉相比脂肪含量和膽固醇含量都偏低,肉質軟嫩可口,深受消費者的青睞[1-2]。但在羊肉加工、儲藏、運輸過程中,由于羊肉中維生素、礦物質以及蛋白質含量比較高,因此很容易受到一些食源性致病菌的污染[3-4]。金黃色葡萄球菌可以引起人類和動物的下呼吸道和手術部位感染,引發敗血癥和肺炎[5-6]。此外,金黃色葡萄球菌還具有較強的生物膜形成能力[7-8]。一旦生物膜形成,由于蛋白質、多糖和磷脂等大分子的存在,增加了不同抑菌手段對其進行有效抑制的難度[9]。因此,研究對金黃色葡萄球菌生物膜的高效抑菌方法以控制羊肉中金黃色葡萄球菌的生長就顯得尤其重要。
有機酸被認定為一類安全、有效的抗菌劑[10]。乳酸作為三大有機酸中的一種,在抑制食品中微生物生長方面具有明顯的作用。Anang等[11]報道了乳酸在延長雞胸肉貨架期方面具有明顯的作用,它可以有效控制雞胸肉中假單胞菌的菌群數量。Youssef等[12]報道了5%的乳酸可以使牛肉中大腸桿菌菌落數量減少4lg(CFU/g)以上。Li等[13]報道了2%的乳酸可以有效地減少雞蛋殼上面腸炎沙門氏菌的數量。作為一種環保的非熱殺菌方法,超聲波得到了廣泛的應用。但有研究結果表明,雖然超聲波可很大限度地保留食品性質,但單獨使用時抑菌效果不是特別明顯[14]。因此,通常需要跟其他抑菌方法一起協同作用。畢秀芳等[15]報道了超聲波聯合乳酸鏈球菌素處理可以有效控制胡蘿卜汁中菌群數量。蓋作啟[16]報道了超聲波聯合熱處理可以有效控制牛奶中的微生物數量,且不會對牛奶品質產生任何不利的影響。Cichoski等[17]的研究結果表明,超聲波聯合酸性電解水處理雞胸肉,可有效地減少雞胸肉中嗜冷細菌、乳桿菌和中溫菌的數量,且不會損壞雞胸肉的感官品質。Yu等[18]報道了超聲波聯合二氧化氯處理可以協同有效地控制金黃色葡萄球菌生物膜的生長。然而,關于超聲波聯合乳酸處理的協同抗菌和抗生物膜機制以及超聲波聯合乳酸處理對羊肉中金黃色葡萄球菌菌落數控制的研究還未見報道。
因此,本研究以金黃色葡萄球菌為指示菌,分別研究超聲波、乳酸以及超聲波+乳酸對金黃色葡萄球菌游離和生物膜細胞菌落數的殺菌效果,并且對超聲波+乳酸聯合處理的協同抗菌和抗生物膜機制進行研究,以期降低乳酸的使用濃度。
1 材料與方法
1.1 材料與儀器
指示菌金黃色葡萄球菌(Staphylococcusaureus),為本實驗室保存的菌種。腦心浸液肉湯(BHI)液體、BHI固體培養基,產自青島海博生物科技有限公司。氯化鈉,產自國藥集團化學試劑有限公司。乳酸,產自南京壽德實驗器材有限公司。NuncTMLab-TekTM8孔腔室蓋玻片系統,產自賽默飛世爾科技公司。24孔聚氯乙烯培養板,產自美國康寧公司。羊肉,購自南京盒馬網絡科技有限公司。
BHC-1300IIA/B3型生物潔凈安全柜,產自蘇州凈化設備有限公司。PE(Ultra View VOX)轉盤式激光共聚焦顯微鏡,產自美國珀金埃爾默股份有限公司。EVO-LS10掃描電子顯微鏡,產自德國卡爾蔡司股份公司。KQ-800KD超聲波清洗機,產自中國昆山超聲波儀器有限公司。酶標儀,產自美國BioTek Instruments有限公司。Centrifuge 5810 R 離心機,產自德國Eppendorf公司。THZ-C臺式恒溫振蕩器,產自太倉市華美生化儀器廠。
1.2 試驗方法
1.2.1 菌株的培養 將金黃色葡萄球菌菌液從-80 ℃保存條件中取出,在BHI培養基中37 ℃培養至對數期,然后重復此步驟,繼續按照1%的接種量接種于BHI培養基中培養12 h,所得菌液用于后續操作[19]。
1.2.2 超聲波、乳酸、超聲波聯合乳酸處理對金黃色葡萄球菌游離和生物膜細胞的殺菌作用 將對數期的金黃色葡萄球菌菌液離心(5 000g,10 min,4 ℃)后,去除上層培養基,將沉淀用0.85%生理鹽水洗滌3次[20]。超聲波(400 W,50 kHz)單獨處理(US)時,向沉淀中加入等體積的0.85%生理鹽水并充分混勻,置于超聲波清洗機中。乳酸(LA)單獨處理(質量分數為0.5%、1.0%)時,向沉淀中分別加入等體積的濃度為0.5%或1.0%的乳酸并充分混勻,在室溫條件下進行殺菌處理。二者聯合處理(US+0.5% LA、US+1% LA)時,向菌泥中加入等體積的0.85%生理鹽水并充分混勻,然后置于超聲波清洗機(400 W,50 kHz)中。此外,在室溫條件下分別放置菌懸液作為對照組。所有處理均在5 min、10 min、20 min、30 min、60 min時取樣、計數。迅速吸取1 ml的菌液與9 ml 0.1 mol/L的磷酸緩沖鹽溶液(PBS)調節pH。將菌液稀釋進行平板計數,培養條件為37 ℃靜置24 h[21]。
根據Liu等[21]的方法,將菌液進行培養并活化,之后定量加到NuncTM24孔聚氯乙烯培養板中,隨后將孔板在37 ℃靜置培養3 d。培養過程中每隔完整的1 d更換BHI肉湯培養基,操作時先沿每個孔壁慢慢提取培養基,然后緩慢加入新鮮的培養基以保持細菌活性。培養3 d后,緩慢吸除上清液,用1 ml 0.01 mol/L PBS沖洗生物膜3次以備用。金黃色葡萄球菌生物膜的殺菌方法和菌落計數的方法參考金黃色葡萄球菌游離細胞的殺菌方法[21]。
1.2.3 生物膜胞外多糖含量的測定 參照文獻[21]、[23]的方法測定生物膜胞外多糖含量。不同處理后,收集各孔中的生物膜細胞以測定其多糖含量。將對應于一個樣品的3個孔的生物膜內容物混合并離心,取沉淀用于下一步操作,上清液用于測定可溶性多糖含量。將所得沉淀加入到含有0.85% NaCl及0.22%甲醛的溶液中,水浴30 min,溫度為80 ℃,在4 ℃條件下離心30 min,轉速12 000 r/min。
1.2.4 掃描電子顯微鏡和激光共聚焦顯微鏡分析 參考方法1.2.3,將經過US、1% CA和US+1% CA 處理30 min后的金黃色葡萄球菌菌懸液迅速與0.1 mol/L PBS混合,離心(6 000g,5 min,4 ℃),在4 ℃用2.5%戊二醛固定至少12 h,用于掃描電子顯微鏡分析。此外,將離心后所獲得的沉淀用LIVE/DEAD BacLightTM試劑在室內黑暗條件下進行染色處理30 min,然后再次離心(6 000g,5 min,4 ℃),用0.85%生理鹽水反復洗滌3次,用于激光共聚焦顯微鏡分析[22]。
生物膜的培養方法參考方法1.2.3,將活化后的菌液定量添加到8 孔腔室蓋玻片中。培養結束后, 將生物膜分別用US、1% LA和US+1% LA處理30 min,然后移除上層溶液,將生物膜在超凈工作臺中自然風干。將風干后的生物膜按照網格線裁開,然后將樣品在4 ℃下放置12 h,使其自然干燥,之后用1%四氧化鋨固定2 h,再用2.5%戊二醛固定至少12 h,用掃描電子顯微鏡拍攝金黃色葡萄球菌生物膜細胞。將風干后的生物膜用LIVE/DEAD BacLightTM試劑在室溫以及黑暗條件下進行染色處理30 min,然后用0.01mol/L PBS洗滌3次,將生物膜再次風干,并去除隔板[21-22],用激光共聚焦顯微鏡拍攝金黃色葡萄球菌生物膜細胞。
1.2.5 核酸物質泄露的測定 參考方法1.2.3培養金黃色葡萄球菌游離和生物膜細胞。將經US、0.5% LA、1.0% LA、US+0.5% LA和US+1.0% LA不同處理30 min 后的菌體離心(4 ℃,3 000g,10 min),取上清液測定其OD260值[24]。
1.2.6 超聲波聯合乳酸處理對羊肉中金黃色葡萄球菌的滅活作用及對羊肉pH的影響
1.2.6.1 羊肉的處理 將從超市買來的羊肉用無菌刀切成正方體形狀,每份10 g。首先測定羊肉中原有的菌群數量,約為4lg(CFU/g)。然后將羊肉浸泡在含量為7lg(CFU/g)的金黃色葡萄球菌菌液中2 h, 最終測得羊肉上的金黃色葡萄球菌菌群數量約為6.11lg(CFU/g)。將羊肉用US+0.5% LA分別處理5 min、10 min、20 min、30 min、60 min。
1.2.6.2 微生物計數 按照國家標準進行菌落總數[25]以及金黃色葡萄球菌菌數[26]的測定。將10 g 肉放入均質袋中,在無菌條件下加入 90 ml 0.01 mol/L PBS,并放入4 ℃搖床振蕩1 h。用0.85%生理鹽水進行10倍連續稀釋[27-28],然后參照方法1.2.3進行微生物計數。
1.2.7 數據統計與分析 所有試驗數據均為3次獨立試驗的平均值,表示為“平均值±標準差”。使用SPSS軟件通過方差分析(ANOVA)進行統計分析。使用Origin 9.5軟件進行圖形繪制。
2 結果與分析
2.1 超聲波、乳酸以及二者聯合處理對金黃色葡萄球菌游離和生物膜細胞的殺菌效果
圖1顯示了超聲波、乳酸以及二者聯合處理對金黃色葡萄球菌不同菌體狀態的殺菌效果。對照組中菌落數約為9lg(CFU/g),US單獨處理30 min時,分別僅使金黃色葡萄球菌游離和生物膜細胞菌落數降低了0.31lg(CFU/g)和0.22lg(CFU/g),這與Li等[29]的研究結果一致。400 W的US 處理15 min,僅僅使得金黃色葡萄球菌游離細胞的菌落數降低了0.31lg(CFU/g)。0.5% LA和1.0% LA的乳酸處理30 min, 金黃色葡萄球菌游離細胞的菌落數分別降低了1.82lg(CFU/g)和2.64lg(CFU/g),金黃色葡萄球菌生物膜細胞的菌落數分別降低了1.02lg(CFU/g)和2.01lg(CFU/g)。Wang等[30]報道了0.5% LA可以完全有效地抑制腸沙門氏菌、大腸桿菌和單核增生性李斯特菌的生長。Omori等[31]報道了0.5% LA和1.0% LA可以有效地降低單核增生性李斯特菌的菌落數量。
超聲波與乳酸聯合處理(US+ LA)對菌體的抑菌作用明顯增強。US+ 0.5% LA和US+1.0% LA處理30 min時, 金黃色葡萄球菌游離細胞的菌落數分別降低了2.73lg(CFU/g)和3.51lg(CFU/g),金黃色葡萄球菌生物膜細胞的菌落數分別降低了1.96lg(CFU/g)和3.39lg(CFU/g)。當用US+LA處理時,US 通過自身的空化作用使菌體的細胞膜通透性增加,LA可以通過破損的細胞膜進入菌體細胞發揮抑菌作用,造成菌體細胞內的物質泄露,從而導致菌體細胞死亡。因此,二者聯合處理具有明顯的協同殺菌效果[14,18]。綜上,US+0.5% LA 的殺菌效果和1.0% LA單獨處理的殺菌效果相似。許愈等[32]的研究結果表明,超聲波與酸性電解水聯合處理可以有效地減少副溶血性弧菌的菌落數量。He等[33]報道了超聲波與百里香精油納米乳液聯合處理可以提高對金黃色葡萄球菌的殺菌效果。

圖1 超聲波(US)、乳酸(LA)和US+LA處理對金黃色葡萄球菌游離(A)和生物膜(B)細胞的殺菌效果Fig.1 Bactericidal effect of ultrasound (US),lactic acid (LA) and US +LA treatments on planktonic cells (A) and biofilm cells (B) of Staphylococcus aureus
2.2 生物膜胞外多糖含量的測定結果
由圖2可見,與對照組相比,US、0.5% LA、US+0.5% LA處理使金黃色葡萄球菌生物膜中可溶性多糖含量分別降低16.20%、25.99%和34.43%,使不可溶性多糖含量分別降低16.30%、25.91%和40.33%,這表明與單獨處理相比,超聲波與乳酸聯合處理可以使生物膜中所含的可溶性多糖與不可溶性多糖含量呈現顯著下降的變化趨勢。胞外多糖含量在生物膜胞外基質中占比最高,可使生物膜中的細胞黏附在一起,從而增強生物膜細胞對外界不良因素的干擾[34]。由于US破壞了生物膜的結構,導致黏附在一起的生物膜細胞出現孔隙,因此LA可以更好地通過生物膜的外層基質,進而提高對致病菌的殺滅作用[22]。US+0.5% LA處理后金黃色葡萄球菌生物膜中多糖含量與1.0% LA處理后的多糖含量無顯著性差異,這進一步表明聯合處理可以降低LA的使用濃度。
2.3 掃描電子顯微鏡和激光共聚焦顯微鏡分析結果
空白對照組的金黃色葡萄球菌游離細胞呈飽滿的球狀且表面光滑,激光聚焦電鏡圖片中未見有被染成紅色的細胞,這表明所有細菌的細胞膜保持完整的狀態,且通透性未發生改變(圖3A1、圖3B1)。US處理30 min 后,菌體表面出現褶皺,少部分細胞被染成紅色(圖3A2、圖3B2)。1.0% LA處理30 min 后, 菌體表面開始出現凹陷,但大部分菌體依然保持完整的形態,被染成紅色的細胞數量與US單獨處理相比顯著增加,這與微生物計數的結果相一致,LA單獨處理的殺菌效果要比US單獨處理好(圖3A3、圖3B3)。圖3A4、圖3B4結果表明,US+1.0% LA 可以對金黃色葡萄球菌游離細胞產生嚴重的損傷,大量細胞變得干癟,被染成紅色的細胞的比例與單獨處理相比顯著增加。
對照組的金黃色葡萄球菌生物膜細胞排列較緊密,生物膜厚度較大,且菌體結構完整,未受到破壞(圖4A1、圖4B1)。US處理30 min 后,有少數細胞呈現紅色熒光,表明此時有少數細胞受到傷害(圖4A2、圖4B2)。與US單獨處理相比,LA處理下呈現紅色熒光的細胞數量明顯增加,密集的生物膜逐漸被瓦解,菌體狀態明顯變化,褶皺增加(圖4A3、圖4B3)。圖4A4、圖4B4結果表明US+1.0% LA處理的生物膜細胞外部基質損害嚴重,生物膜開始變得疏散,大量菌體細胞表面變得凹陷。這與遲媛等[14]的研究結果一致,超聲波協同次氯酸鈉處理會加速菌體的死亡速度。許愈等[32]報道,超聲波可損傷菌體的細胞壁,因此酸性電解水會更好地滲入細胞,從而使得菌體細胞遭到嚴重的破壞。

不同處理對應柱上標有不同小寫字母表示差異顯著(P<0.05)。圖2 超聲波(US)、乳酸(LA)和US+LA處理后金黃色葡萄球菌生物膜的可溶性多糖(A)與不可溶性多糖(B)含量Fig.2 Soluble (A) and insoluble (B) polysaccharide contents in Staphylococcus aureus biofilm cells after treated by ultrasound (US),lactic acid (LA) and US +LA

圖3 超聲波(US)、乳酸(LA)和US+LA處理后金黃色葡萄球菌游離細胞的掃描電子顯微鏡與激光共聚焦電鏡結果Fig.3 Scanning electron microscopy and laser confocal electron microscopy images of Staphylococcus aureus planktonic cells after treated by ultrasound (US),lactic acid (LA) and US +LA

圖4 超聲波(US)、乳酸(LA)和US+LA處理后金黃色葡萄球菌生物膜掃描電子顯微鏡與激光共聚焦電鏡圖Fig.4 Scanning electron microscopy and laser confocal electron microscopy images of Staphylococcus aureus biofilm cells after treated by ultrasound (US), lactic acid (LA) and US +LA
2.4 核酸物質泄露的測定結果
核酸物質的泄露量可以進一步反映菌體細胞膜的完整性和流動性變化。由圖5可見,US單獨處理后核酸的泄漏并不明顯,而LA單獨處理使得核酸的泄漏量明顯增加,這與掃描電子顯微鏡(SEM)與激光共聚焦電子顯微鏡(CLSM)的結果相一致,LA可以對菌體的細胞膜造成嚴重損傷,進而增加細胞的損害程度。此外,US+LA處理后,核酸泄漏量急劇增加,原因為US+LA處理破壞了菌體細胞膜的完整性和通透性,造成內部物質大量泄露。許愈等[32]研究發現,超聲波聯合酸性電解水處理對細胞結構產生顯著影響,與本研究結果一致。

不同處理對應柱上標有不同小寫字母表示差異顯著(P<0.05)。圖5 超聲波(US)、乳酸(LA)和US+LA處理后金黃色葡萄球菌游離和生物膜細胞的核酸泄露Fig.5 Release of nucleic acids in Staphylococcus aureus planktonic and biofilm cells after treated by ultrasound (US),lactic acid (LA) and US +LA
2.5 超聲波聯合乳酸處理對羊肉中金黃色葡萄球菌的殺菌效果
由圖6可見,US+0.5% LA處理可以顯著降低羊肉上金黃色葡萄球菌的菌落數量(P<0.05)。隨著處理時間的增加,羊肉上金黃色葡萄球菌的菌落數量逐漸降低。US+0.5% LA處理60 min,可使羊肉上金黃色葡萄球菌的菌落數量較處理前降低1.97lg(CFU/g)。因此US+LA處理是一種良好的殺菌方式,它可以顯著控制羊肉上金黃色葡萄球菌的菌落數量。畢秀芳等[15]報道了超聲波聯合乳酸鏈球菌素可有效控制胡蘿卜汁中的微生物數量,且不影響胡蘿卜汁的品質。Ramezani等[35]報道了乳酸聯合殼聚糖以及氣調包裝可以顯著延長鵪鶉肉的貨架期。González-Fandos等[36]報道了乳酸和山梨酸鉀可以有效地減少雞肉上單細胞增生性李斯特菌的數量。
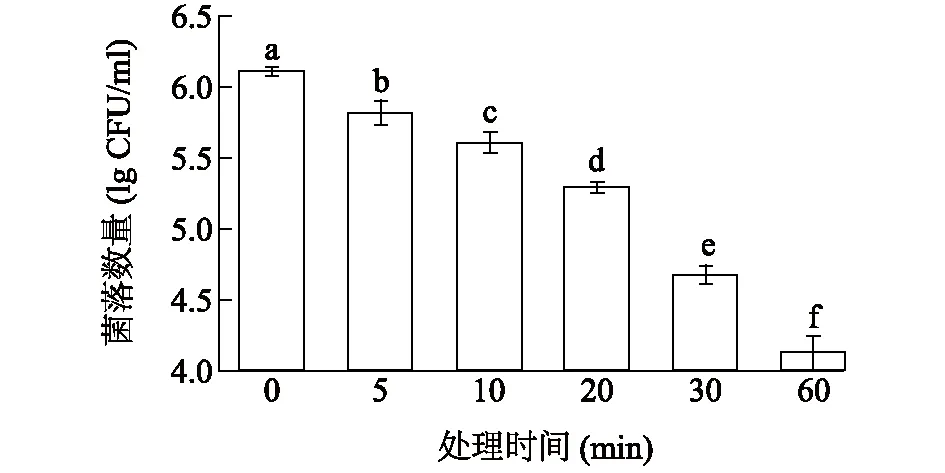
不同處理對應柱上標有不同小寫字母表示差異顯著(P<0.05)。圖6 US+0.5% LA處理對羊肉上金黃色葡萄球菌的殺菌效果Fig.6 Bactericidal effect of US+0.5% LA treatment on Staphylococcus aureus of mutton
3 結論
US+LA協同處理的殺菌作用顯著,二者聯合處理時對致病菌的殺菌效果顯著強于單獨處理時的殺菌效果。經US+LA處理后,金黃色葡萄球菌生物膜細胞多糖含量顯著降低,菌體細胞產生嚴重凹陷,細胞膜通透性增加,核酸泄露量顯著增加(P<0.05)。此外,US+0.5%LA能顯著降低羊肉上金黃色葡萄球菌的菌群數量。因此,US+LA是一種良好的殺菌方式,它可以降低LA的使用濃度。

