細胞因子對滲出性胸腔積液的鑒別診斷價值
馮小紅 張璐璐 王雪 薛慶亮
胸腔積液(pleural effusion,PE)是與多種良性和惡性疾病相關的臨床常見并發癥。根據Light標準[1],胸腔積液可分為滲出性和漏出性,由充血性心力衰竭、肝硬化、腎病綜合征等病因引起的積液常為漏出性,而滲出性積液常見于惡性腫瘤以及感染如結核導致的胸膜炎癥。胸腔積液的病因學診斷是臨床實踐的常見問題,準確的早期診斷至關重要,以便于啟動有效的管理方案,施行盡早干預。近年來,隨著對機體免疫應答、炎癥反應及腫瘤的深入研究,對免疫細胞的功能及調節有了較多認識。作為免疫細胞分泌的重要介質,細胞因子已顯示出有望成為胸腔積液鑒別診斷的可靠生物標記物。本文總結了胸腔積液中多種細胞因子診斷性能的當前數據,其中包括多個系統回顧及薈萃分析結果,以評估其在良惡性滲出性胸腔積液的鑒別診斷價值。
細胞因子的診斷作用基礎
結核性胸腔積液(tuberculous pleural effusion,TPE)和惡性胸腔積液(malignant pleural effusion,MPE)都是以淋巴細胞為主的滲出性積液,具有輔助/誘導表型的T淋巴細胞形成胸膜液中的主要淋巴細胞群,但在兩種疾病中觀察到不同的亞群,激活狀態和隨后的免疫反應[2]。研究發現胸膜病變的關鍵就在于激活的免疫細胞聚集在病變部位并釋放細胞因子,發揮細胞免疫作用。TPE的淋巴細胞群主要是T輔助細胞,而細胞因子環境更傾向于Th1型免疫應答[3],其激活及反饋機制涉及多種細胞因子。TPE被認為是針對結核分枝桿菌的遲發性超敏反應,是與包括白介素、干擾素和趨化因子在內的多種細胞因子增加相關的病理性免疫反應的結果[4]。MPE是由胸膜腔中的腫瘤細胞、內皮細胞、髓樣細胞和淋巴樣細胞相互作用誘導產生[5],來自宿主或腫瘤細胞的多種效應分子參與MPE的發病機制中,這些效應分子可分為包括白介素、腫瘤壞死因子、干擾素在內的免疫調節效應分子,以及以VEGF為代表的誘導血管通透能力的調節介質[6]。導致淋巴細胞滲出性積液,液體積聚的分子機制復雜,可以預期的是,對在發病機制中起關鍵作用的細胞因子以及生物標志物組合的分析,可提高對于PE的鑒別診斷能力,并可能開發出一種具有良好臨床實用性的高性能診斷方法。
細胞因子的診斷性能評估
一、γ-干擾素(interferon(IFN)-γ)
IFN-γ是一種重要的免疫調節因子,在T細胞分化和巨噬細胞活化中發揮關鍵作用,能夠反映機體的細胞免疫狀況。作為活化的淋巴細胞分泌的重要效應分子,IFN-γ介導并促進了針對肉芽腫形成和遏制結核分枝桿菌感染的Th1免疫應答。IFN-γ作為TPE診斷生物標志物已進行了大量的研究,早期的一項薈萃分析[7]顯示IFN-γ診斷TPE合并的敏感性和特異性為0.96,另一項綜合了22項研究的薈萃分析[8]結果顯示IFN-γ診斷的敏感性和特異性分別為0.89和0.97,提示胸膜液IFN-γ水平可能是診斷TPE靈敏且特異的指標。最近,Aggarwal等人[9]匯總了67項研究數據的薈萃分析顯示直接定量胸腔積液IFN-γ對TPE診斷的敏感性、特異性分別為0.93、0.96。我國的學者進行了一項胸膜液 T-SPOT和IFN-γ對TPE診斷的前瞻性研究[10],兩種檢測方法均觀察到了較高的準確性,而基于兩者組合所建立的診斷模型則顯示出更好的性能,其敏感性和特異性均超過95%。總結該領域IFN-γ的相關研究發現,其提供的信息可用于支持對臨床實踐中高度懷疑TPE的患者啟動試驗性抗結核治療,尤其是在沒有任何惡性腫瘤證據的情況下。
二、白介素-27 (interleukin(IL)-27)
IL-27是白介素12家族的新成員,它是由EB病毒誘導基因3和p28亞基組成的異源二聚體細胞因子。IL-27主要由抗原呈遞細胞分泌,可通過對免疫應答的雙重促炎和抗炎作用調節多種免疫疾病[11]。研究發現 TPE患者胸腔積液中IL-27的含量高于非TPE患者[12],此后一系列的研究探索了IL-27作為新型診斷標志物的潛力。到目前為止,已經進行了四項薈萃分析[13-16],匯總的敏感性及特異性均超過0.9,AUC大于0.95,顯示出IL-27對TPE優異的診斷性能,但這些分析所納入的研究大多是在我國這一全球結核高患病率背景下進行的,并且采用診斷標準也略有不同,可能對結果有所影響。其中,Wang等人[15]設計的包含兩項前瞻性隊列研究的薈萃分析,IL-27在北京隊列的表現出的高診斷性能在武漢隊列中得到驗證,并在薈萃分析中進一步證實。作者總結得出IL-27可用于在結核高患病率環境中對TPE的診斷及所有患病率環境中一項排除指標。Roofchayee等人[17]研究發現IL-27與ADA的乘積對TPE診斷的特異性為98.28%,而敏感性可達到100%,且陰性預測值為0,可以這么解釋,如果患者獲得其數值的陰性結果,那么他患有結核性胸膜炎的幾率可能為零,但該研究納入的病例數較少,仍需進一步驗證。IL-27聯合其他指標可用于未經微生物確診的TPE診斷,并有望在臨床環境中實現高精度。
三、腫瘤壞死因子-α(tumor necrosis factor(TNF)-α)
TNF-α是一種對細胞的活化、募集、分化和凋亡具有多效作用的細胞因子,在結核分枝桿菌感染的免疫防御中也發揮重要作用,能增強巨噬細胞對病原菌的殺傷作用并有助于肉芽腫的形成,從而控制疾病進展[18]。研究發現結核引起的胸腔積液中可觀察到該細胞因子水平的升高,2015年發表了TNF-α對TPE診斷的第一項薈萃分析[19],其敏感性為0.89,特異性為0.82,2016年另一項薈萃分析[20]顯示胸膜液TNF-α測定的總體敏感性和特異性分別為0.85、0.80,兩項研究結果提示TNF-α可能是TPE的潛在診斷指標,雖然并未得到令人滿意的總體準確性數據。Aggarwal等人[21]發表的最新薈萃分析,匯總估計的敏感性和特異性分別為0.79、0.82,與先前的薈萃分析結果不一致,其研究表明胸腔積液TNF-α對TPE的診斷準確性較差,特別是與肺炎旁胸腔積液鑒別。TNF-α作為TPE診斷生物標志物能否表現出足夠的診斷性能,仍存在爭議,有待于進一步評估。
四、γ-干擾素誘導蛋白10(interferon-inducible protein(IP)-10)
IP-10是趨化因子CXC亞家族成員,研究發現IP-10參與將單核細胞和活化的T淋巴細胞募集至結核炎癥部位[22],增強IFN-γ基因表達及Th1反應,還可以通過抑制血管生成來促進結核性肉芽腫壞死[23]。IP-10在結核性胸膜炎的具體作用機制雖尚未完全闡明,但其作為TPE的生物標志物已被廣泛研究,并顯示出與ADA和IFN-γ相當的診斷效用[24]。此外,有學者認為,由于IP-10是IFN-γ的放大信號,IP-10的分析測定可能會發現基于IFN-γ檢測的假陰性病例,從而提高診斷的敏感性[25]。一項納入了14項研究的薈萃分析[23]顯示IP-10對TPE的診斷敏感性和特異性分別為0.84、0.90,AUC 為0.94。IP-10對TPE有重要的潛在診斷價值,需要更多證據來驗證的IP-10作為獨立生物標記物的診斷性能。
五、血管內皮生長因子(vascular endothelial growth factor,VEGF)
VEGF被認為是腫瘤血管生成中最重要的調節因子之一,其通過刺激腫瘤血管生成,激活宿主血管內皮細胞,并促進惡性增殖而參與腫瘤生長的過程[6]。VEGF還能誘導胸膜間皮和脈管系統的通透性,在MPE的發病機制中起重要作用[26]。先前的研究已經報道了惡性起源的胸腔積液VEGF水平較高,根據Fafliora等人[27]的薈萃分析結果,與良性PE患者相比,MPE患者VEGF水平升高了1.93 ng/mL(95%CI:1.32-2.54,P <0.05)。Shen等人[28]發表的納入10項研究的薈萃分析顯示VEGF對MPE診斷的總體敏感性和特異性為0.75,AUC為0.82,盡管其數據并不理想,仍提供了有價值的信息。VEGF水平可作為對PE患者進行診斷評估的有用輔助手段,對于細胞學檢查陰性的患者,高水平的VEGF可能有助于區分潛在的惡性腫瘤患者,而對于初始評估時低水平的患者則傾向選擇保守的方式解決。
(表1)總結了IFN-γ、IL-27、TNF-α、IP-10、VEGF診斷準確性的薈萃分析數據。需要指出的是,由于薈萃分析中納入的研究中存在截然不同的臨界值,因此關于其閾值的選擇需要更大范圍的研究,為臨床實踐建立廣泛接受的標準。值得注意的是,對這些細胞因子的診斷評估作用需進一步分析,研究的目的最終歸于對臨床決策的指導意義,使患者從中受益。
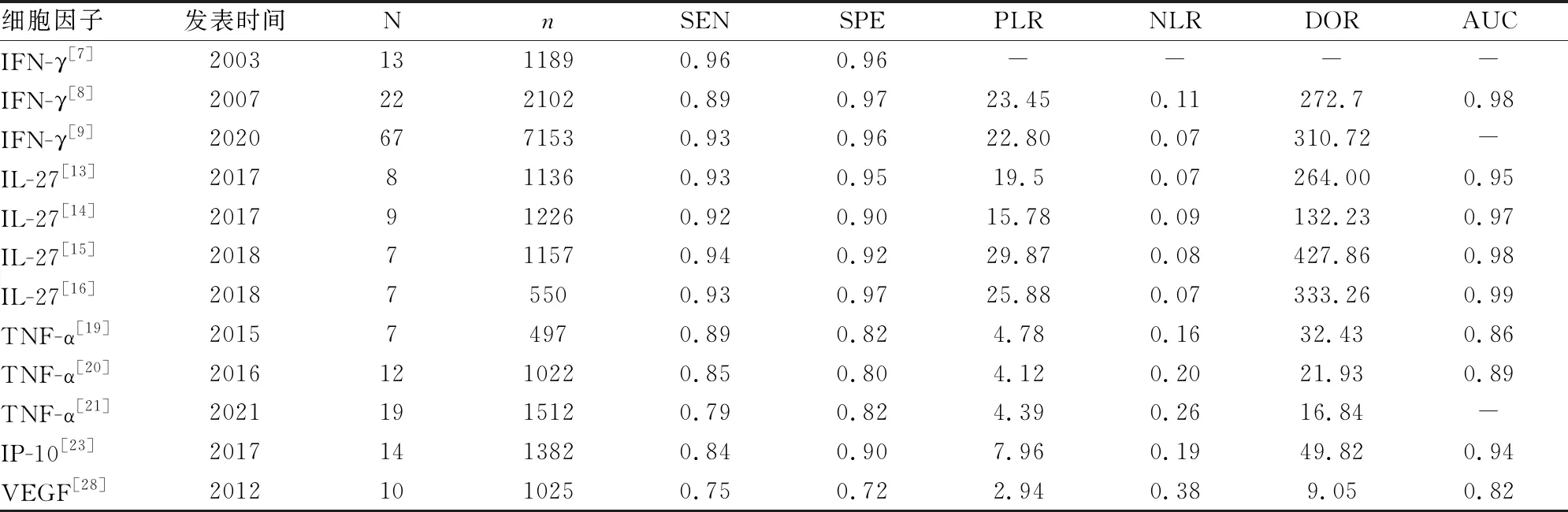
表1 細胞因子診斷性能的薈萃分析數據
總結與展望
盡管胸腔積液很常見,但關于其發展所涉及的炎癥和免疫機制的調控信息卻很少,特別是參與免疫過程的細胞及介質的確切作用機制尚不清楚。細胞因子作為關鍵效應分子,盡管單獨的研究報道了其作用,仍需進一步研究了解與全身免疫反應相比,其在調節局部炎癥中的累積作用以及在復雜的細胞因子免疫調節網絡中的相互作用。今后的研究應著重于探討細胞因子在胸膜疾病的免疫過程中的作用機制及調節通路,為良惡性滲出性胸腔積液的鑒別及治療提供新的靶點和途徑。

