泛免疫炎癥值及全身免疫炎性指數對胃癌預后的評估價值
房 鈺 費素娟 陳智良 郭雅慧 熊尚岷
胃癌是消化系統常見的惡性腫瘤之一,其發生率居全球惡性腫瘤發生率第5位,病死率居第3位[1]。目前對胃癌采用以手術為主的綜合治療,但總體5年生存率仍不足 50%[2]。因此簡單、準確地判斷胃癌患者疾病狀態,并及時調整治療方案,對提高整體生存率至關重要。19世紀末, Virchow提出慢性炎癥可能為惡性腫瘤的起源,后續更多研究發現炎性微環境在腫瘤的發生、發展及轉移中起到重要作用,而腫瘤組織通過不斷招募炎性細胞和因子,又造成了炎性微環境的惡性循環[3~5]。故評估癌癥患者術前機體的炎性狀態,有利于幫助判斷腫瘤的惡性程度及預后[6]。既往研究表明,全身免疫炎性指數(systemic immune-inflammation index,SII)能夠用于判斷胃癌、結直腸癌、肝癌、胰腺癌、宮頸癌等惡性腫瘤的預后[7~11]。近年來,一種新的炎性指標——泛免疫炎癥(pan-immune-inflammation value, PIV)被報道與結直腸癌的預后密切相關,而在胃癌中尚未進行充分探討[12]。本研究旨在評價PIV及SII對胃癌患者預后的評估價值。
資料與方法
1.一般資料:選取2016年3月~2019年12月于徐州醫科大學附屬醫院普外科行胃癌根治術的胃癌患者396例,其中男性291例,女性105例,患者平均年齡為59.94±11.55歲。納入標準:①病歷資料完整的初診胃癌患者;②均在該院行初次胃癌根治性切除術且術后病理診斷為胃腺癌;③術前未行任何放療、化療等抗腫瘤治療。排除標準:①合并其他惡性腫瘤;②術前合并其他感染性疾病、血液系統疾病、自身免疫性疾病等可能影響炎性指標的疾病;③近期或正在接受抗炎或免疫抑制治療;④術前接受輸血治療;⑤有嚴重肝腎功能不全疾病。本研究經筆者醫院醫學倫理學委員會審批(審批編號:XYFY2021-KL145-01)。
2.方法:收集研究對象相關的臨床資料,包括姓名、年齡、性別及術后病理資料,包括腫瘤部位、最大直徑、浸潤深度、分化程度、有無淋巴結轉移、有無遠處轉移等,并根據2017年美國癌癥聯合會(AJCC)指南(第8版)進行TNM分期[13]。所有患者均于入院次日清晨空腹采集外周靜脈血,使用Sysmex XE-2100全自動血液分析儀及儀器配套試劑測定血液中中性粒細胞、血小板、單核細胞及淋巴細胞計數。PIV=(中性粒細胞×血小板×單核細胞)/淋巴細胞。SII=(中性粒細胞×血小板)/淋巴細胞。對所有患者進行術后隨訪,隨訪方式為電話或門診隨訪。術后2年內每3個月隨訪1次,5年內每6個月隨訪1次,隨訪截止日期為2020年10月31日,總體生存時間(overall survival,OS)定義為從入院日期至死亡日期或隨訪截止日期。利用ROC曲線確定PIV及SII最佳截斷值,以最佳截斷值為界,分別分為高PIV、低PIV組及高SII、低SII組,分析各組與胃癌病理特征之間的相關性,評估PIV及SII對胃癌預后的預測價值。

結 果
1.確定胃癌患者PIV、SII的最佳截斷值:通過PIV和SII的值與患者OS繪制ROC曲線,詳見圖1。曲線下面積分別為0.631、0.621,PIV的最佳截斷值為249.57(敏感度為49.5%,特異性為77.4%),SII的最佳截斷值為638.24(敏感度為48.5%,特異性為75.7%)。以最佳截斷值為依據,將患者分為高PIV、低PIV組及高SII、低SII組。

圖1 PIV及SII的受試者工作特征(ROC)曲線
2. 胃癌患者PIV、SII值與臨床病理特征的相關性:PIV及SII值與腫瘤浸潤深度、淋巴結轉移、TNM分期、神經脈管侵犯及腫瘤最大直徑相關,差異有統計學意義(P<0.05),與患者的性別、年齡、腫瘤分化程度比較,差異無統計學意義(P>0.05),詳見表1。

表1 胃癌患者PIV、SII與臨床病理特征的相關性[n(%)]
3.PIV和SII對胃癌預后的影響:高PIV組5年生存率低于低PIV組,差異有統計學意義(57.8% vs 82.1%,P<0.001);高SII組5年生存率低于低SII組,差異有統計學意義(60.0% vs 81.5%,P<0.001),詳見圖2。
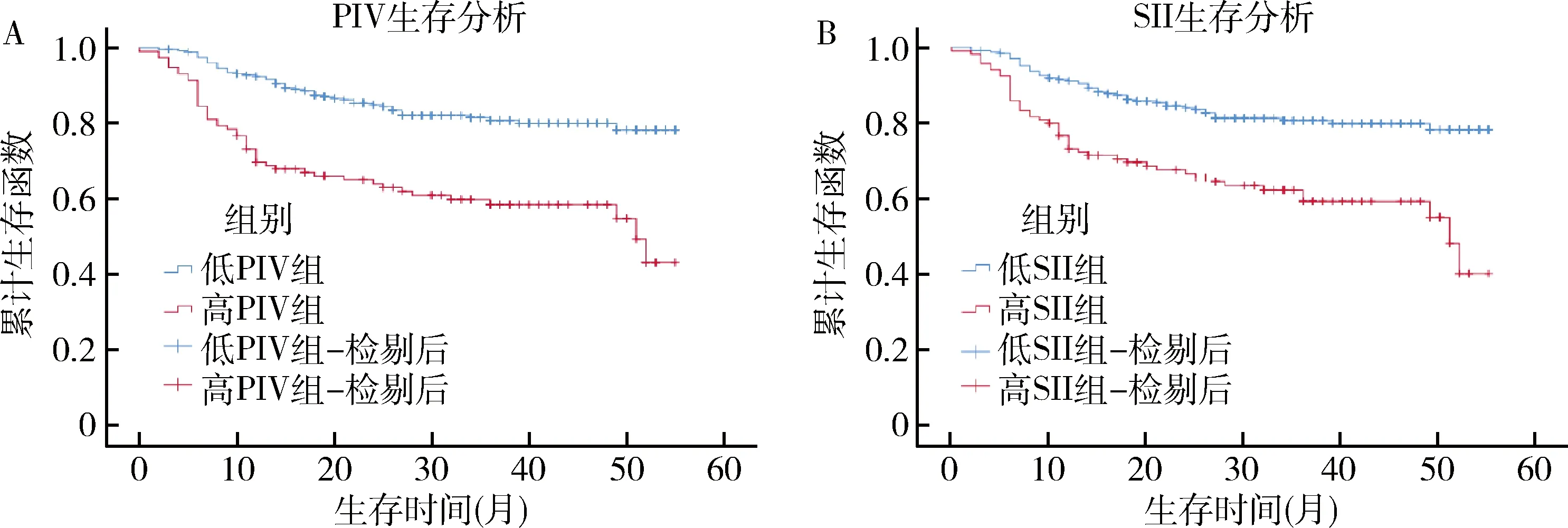
圖2 不同亞組患者的生存曲線A.高PIV和低PIV組;B.高SII和低SII組
討 論
炎性細胞和炎性介質是腫瘤微環境的重要組成部分,腫瘤相關炎癥在腫瘤的發生、發展中起著重要作用[11]。中性粒細胞是循環系統中最豐富的白細胞,能夠反映機體全身或局部的炎性狀態,其通過釋放細胞因子、趨化因子和生長因子來調節炎性微環境,從而促進腫瘤細胞的增殖及遷移[14]。血小板與各種炎癥過程密切相關,它通過 Toll樣受體與病原體結合活化后分泌和表達許多促炎及抗炎細胞分子,從而起到抗原遞呈作用[15]。有研究認為腫瘤細胞可通過與CLEC-2受體結合引起血小板聚集,這種相互作用增強了血小板 TGF-β的釋放,從而誘導腫瘤細胞的上皮間質轉化,使得腫瘤細胞產生免疫逃避且更具遷移性[16]。淋巴細胞則具有一定的抗腫瘤活性,其不僅能夠分泌細胞因子(如干擾素-γ 和 TNF-α)來阻止癌細胞的增殖和遷移,還能誘導細胞毒性細胞死亡,在腫瘤免疫監視中發揮重要作用[7]。
目前,諸多基于上述3種細胞的炎性反應標志物均被證實可以用于評估胃癌的預后,例如NLR(中性粒細胞/淋巴細胞)、PLR(血小板/淋巴細胞)、SII等,這與本研究結果相符,但相較于NLR及PLR,SII更為綜合地反映了宿主炎癥和免疫反應狀態,因此更加可靠[17]。
已有研究證明,外周血單核細胞計數(the peripheral absolute monocyte count,AMC)與結直腸癌、前列腺癌等性腫瘤預后相關[18]。單核-吞噬細胞能夠在腫瘤微環境中活化形成腫瘤相關巨噬細胞(tumor-associated macrophages, TAM),可分為M1型、M2型兩種亞型。M1型巨噬細胞被細胞因子激活后能夠分泌IL-12、IL-23、TNF-α等,具有積極的促炎、抗腫瘤活性;但在腫瘤細胞微粒 (microparticles,MPs)介導下,M1型巨噬細胞發生極化,轉化成M2型巨噬細胞;與M1型相反,M2型巨噬細胞可促進腫瘤細胞增殖、侵襲和轉移,刺激腫瘤血管生成,抑制T細胞介導的抗腫瘤免疫反應,進而促進腫瘤進展[19~21]。鑒于單核細胞在促瘤中的重要作用,一種新的炎性反應標志物——PIV被提出。一項來自法國的多中心隨機試驗表明,PIV在評估轉移性結直腸癌患者無進展生存時間及總體生存時間方面均優于SII[12]。Ligorio等[22]研究發現,PIV能夠成為判斷HER-2陽性的晚期乳腺癌患者OS的一種新的有效預測因子。PIV囊括了炎性促瘤成分(即中性粒細胞、血小板和單核細胞)和抗癌細胞(即淋巴細胞),高PIV值則反映出機體處于全身免疫抑制狀態,腫瘤進展及發生轉移的可能性更大,在本研究中,PIV高值組也表現出了更差的預后。
本研究發現,SII、PIV與胃癌患者的腫瘤浸潤程度、淋巴結轉移、TNM分期、神經或脈管侵犯、腫瘤直徑均有關,高SII及高PIV組的腫瘤浸潤程度深,淋巴結轉移風險大,分期晚,腫瘤直徑大。但在判斷預后方面,PIV較SII有更好的敏感度及特異性,因此PIV有潛力成為一種低成本、無創且易于獲得的可用于判斷胃癌患者預后的炎性指標。可根據術前PIV對患者進行分層,以確定更有利于患者的治療方案;高PIV組胃癌患者5年生存率顯著低于低PIV組,對于高PIV患者需考慮行輔助治療及更頻繁的術后隨訪。
本研究也存在一定的不足:①本研究為回顧性研究,且研究數據來自單一中心,可能會導致選擇偏倚;②本研究僅以術前PIV及SII為中心進行研究,沒有動態評估、監測術后及隨訪過程中相關指標的動態變化;③本研究樣本量相對較少,PIV及SII的最佳臨界值仍需大樣本量、多中心的研究予以進一步驗證。

