miR-35對胃癌細胞MNK-45凋亡的作用及機制探討
張鵬飛,劉新奇,石 菲
(1.榆林市第一醫院普外科,陜西 榆林 719000;2.空軍軍醫大學航空航天醫學院,陜西 西安 710032)
胃癌又稱胃腺癌,是世界上第四大癌癥類型,也是癌癥相關死亡的第二大原因[1]。研究[1]表明,胃癌發生與性別、年齡有關,男性發病率高于女性。50歲以上人群中胃癌的發病率明顯升高[2-3]。胃癌在亞洲、拉丁美洲、中歐和東歐的發病率較高。由于在早期階段,胃癌沒有臨床表現,許多患者在疾病的晚期才被診斷,因此胃癌的治療效果欠佳[2]。雖然病理診斷和手術治療是提高胃癌患者生存率的有效手段,但由于胃癌的復發和轉移,胃癌患者的5年生存率仍然很低[3]。微小RNA(microRNA,miRNA)在許多疾病和病理生理過程中起著至關重要的調節作用如腫瘤發生、白血病、心肌重塑、胚胎發育和造血干細胞分化等[4-6]。越來越多的證據表明,miRNA對胃癌發生發展的有著重要調節作用,miRNA代謝的紊亂可能是胃癌的潛在發病機制[4-6]。有研究[7-8]表明,miRNA-35(miR-35)在乳腺癌和黑色素瘤中發揮重要作用,而miR-35對胃癌的調控作用尚不明確。本研究擬探究miR-35對胃癌細胞凋亡的作用及機制。
1 材料和方法
1.1 實驗材料 澳洲胎牛血清(美國Gibco公司,貨號10100147),低糖DMEM細胞培養基(美國Gibco公司,貨號31330095),I型膠原(美國Gibco公司,貨號A1048301);Lipofectamine 2000(美國Invitrogen公司,貨號11668030);miRNA核苷酸序列(miR-35序列)(生工生物公司);RNA抽提試劑盒(日本Takara公司,貨號639505)、反轉錄試劑盒(日本Takara公司,貨號639549)、擴增試劑盒(日本Takara公司,貨號639503);q-PCR引物由生工生物公司合成;Hoechst33342(南京舟達生物科技公司,貨號BN12457)、PI(南京舟達生物科技公司,貨號BN12624)、轉移酶介導的缺口末端標記(TUNEL)分析試劑(美國Promega公司,貨號PNE0324);抗Caspase 3抗體(美國Abcam公司,貨號ab32147)、抗Bax抗體(美國Abcam公司,貨號ab128873)、抗Bcl-2抗體(美國Abcam公司,貨號ab135745)、抗RhoA抗體(美國Abcam公司,貨號ab3547)和抗β-actin抗體(美國Abcam公司,貨號ab78453);DNA內切酶及連接酶(北京百奧萊博科技有限公司,貨號BTN130639、BTN130653)。實時熒光定量PCR儀(美國Applied Biosystems公司,型號ABI7500fast);酶標儀(上海沛歐分析儀器有限公司,型號SPS5845);流式細胞儀(美國Beckman Coulter公司,型號BEC2058);顯微鏡(日本Olympus公司,型號CX21FS1);電泳儀及發光儀(中國天能公司,型號天能EPS600)。
1.2 實驗方法
1.2.1 細胞培養及轉染:人正常胃黏膜上皮細胞GES-1和胃癌細胞系MNK-45、MGC803、SCG-7901、AGS購買自蘇州思瑞坦細胞庫。根據轉染寡核苷酸序列不同分為轉染miR-35陰性對照序列(5’-AGC AGC CUU GUA CAG GGC UAU GA-3’)對照組、轉染miR-35模擬序列(5’-AAU ACU GCC UGG UAA UGA U-3’)的模擬物組和轉染miR-35互補配對序列(5’-UUA UGA CGG ACC AUU ACU A-3’)的抑制劑組[7-8]。轉染時將普通培養基去除,換為低血清、不含雙抗的培養基繼續培養6 h;在此期間,將Lipofectamine 2000和由生工生物公司合成的miRNA相關核苷酸序列混合均勻,室溫放置30 min,待脂質體將核苷酸序列充分包裹;在培養6 h后將適量上述脂質體混合液加入到上述低血清培養基中(miRNA相關核苷酸序列濃度為80 nmol/L)繼續常規培養6 h,隨后更換上述培養基為常規培養基,繼續培養細胞[9]。
1.2.2 轉染效率檢測:將合成的miRNA相關核苷酸序列(帶有綠色熒光的對照序列)轉染進細胞后,利用熒光顯微鏡檢測熒光物質的分布情況,以此來判斷核苷酸的轉染效率[10]。
1.2.3 q-PCR檢測miRNA表達量:按照說明書利用RNAiso進行細胞裂解,室溫裂解2 min后加入適量的三氯甲烷震蕩,待溶液完全乳化,室溫放置10 min后見萃取分層,高速離心后取無色上清加入等體積的異丙醇,充分混合后冰凍過夜。離心后棄去上清,加入無水乙醇充分洗滌沉淀,棄去上清,加入DEPC水溶解RNA。根據說明書配制反應液,根據說明書內容設置參數,并進行反轉錄:37 ℃預熱15 min,42 ℃加熱15 min,85 ℃加熱5 s,反應結束后得到的cDNA用于后續實驗。根據擴增試劑盒說明書配制反應液,經過預變性和擴增反應等步驟完成擴增步驟,利用相對定量法進行數據分析,具體擴增條件為:95 ℃預變性30 s;95 ℃維持5 s,60 ℃維持34 s,進行40個循環[9]。
1.2.4 流式細胞儀檢測細胞凋亡:利用緩沖液制備細胞懸液(細胞密度為1×106/ml),按照Annexin-V/PI凋亡試劑盒說明,制備反應用細胞懸液,然后利用流式細胞儀檢測細胞凋亡情況[10]。
1.2.5 形態學方法評估細胞凋亡:根據發生凋亡的細胞核形態不同,利用Hoechst33342和PI兩種細胞核染料對細胞進行染色,染料濃度為5 μg/ml。完成染色后利用熒光顯微鏡觀察細胞核形態和染色情況,根據以下分級對細胞進行評估:正常細胞核(藍色染色質有組織結構)、凋亡細胞核(發生濃縮或破碎的熒光染色質)和壞死細胞核(紅色熒光染色質)。每組隨機選取5~10個野(20~25個細胞/野),根據細胞凋亡的形態學特征,確定凋亡細胞占細胞總數的百分比。每個培養皿中至少有1000個細胞被計數和定量。凋亡指數計算為凋亡細胞數/總細胞數×100%[10]。TUNEL染色:利用95%乙醇在緩沖液中室溫固定細胞系20 min。再利用1% Tritonx-100室溫下固定細胞1 h,利用過氧化物酶在緩沖液中孵育5 min,DNA碎片末端脫氧核苷酸混合物標記TUNEL后在平衡緩沖液中混合90 min。穩定的顯色劑二氨基聯苯胺和蘇木精復染細胞[10]。
1.2.6 Western blot技術檢測蛋白表達量:利用蛋白酶裂解液制備蛋白樣本;在蛋白樣本中加入緩沖液,利用煮沸方法制備蛋白樣品。按照以下參數將上述蛋白進行電泳:95 V進行30 min完成濃縮膠的電泳,隨后調整為120 V電泳90 min完成分離膠的電泳;繼續調整參數進行轉膜,250 mA恒流轉膜2 h;按照Caspase 3(1∶3000稀釋)、Bax(1∶5000稀釋)、Bcl-2(1∶3000稀釋)、RhoA(1∶5000稀釋)和β-actin(1∶10000稀釋)抗體說明書配制一定濃度的一抗,室溫孵育一抗4 h,取出條帶后沖洗干凈,配制帶有辣根過氧化物酶的二抗孵育液,隨后室溫孵育1 h,進行發光[10]。
2 結 果
2.1 miR-35在多種胃癌細胞系中的表達 與正常胃黏膜上皮細胞GES-1相比,胃癌細胞系MNK-45、MGC803、SCG-7901和AGS中miR-35均低表達(均P<0.05),見圖1。
2.2 miR-35寡核苷酸作用效率驗證 熒光miRNA序列在MNK-45細胞中的轉染效率好(圖2A);miR-35模擬物能夠上調MNK-45細胞內miR-35的水平(P<0.05),miR-35抑制劑能夠降低MNK-45細胞內miR-35的水平(P<0.05)(圖2B)。
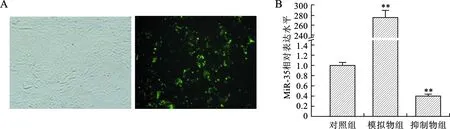
A:光鏡(Hoechst33342和PI細胞核染色,×200)和熒光顯微鏡(TUNEL染色,×200)下觀察寡核苷酸的轉染效率;B:胃癌細胞系MNK-45內miR-35相對含量(與對照組比較,**P<0.01)
2.3 miR-35促進胃癌細胞系MNK-45凋亡 和對照組相比,miR-35模擬物能夠促進MNK-45細胞凋亡(P<0.05),而miR-35抑制劑能夠抑制MNK-45細胞凋亡(P<0.05)(圖3A、B)。為了進一步確認miR-35對MNK-45細胞凋亡的影響,利用細胞核形態學方法評估細胞凋亡情況。正常細胞核形態為藍色染色質有組織結構,凋亡細胞核形態為發生濃縮或破碎的熒光染色質(箭頭所指),而壞死細胞核的形態為紅色熒光染色質(圖3C)。棕色深染的細胞為發生凋亡的細胞(箭頭所指)(圖3D);隨后根據染色結果對凋亡細胞進行計數發現,miR-35模擬物能夠促進MNK-45細胞凋亡(P<0.05),而miR-35抑制劑能夠抑制MNK-45細胞凋亡(P<0.05)。
2.4 miR-35對胃癌細胞MNK-45凋亡相關蛋白表達的影響 見圖4。與對照組相比,模擬物組MNK-45內Caspase 3和Bax表達增加(均P<0.05),而Bcl-2表達減少(P<0.05);抑制劑組MNK-45細胞內Caspase 3和Bax表達減少,而Bcl-2表達增加(均P<0.05)。
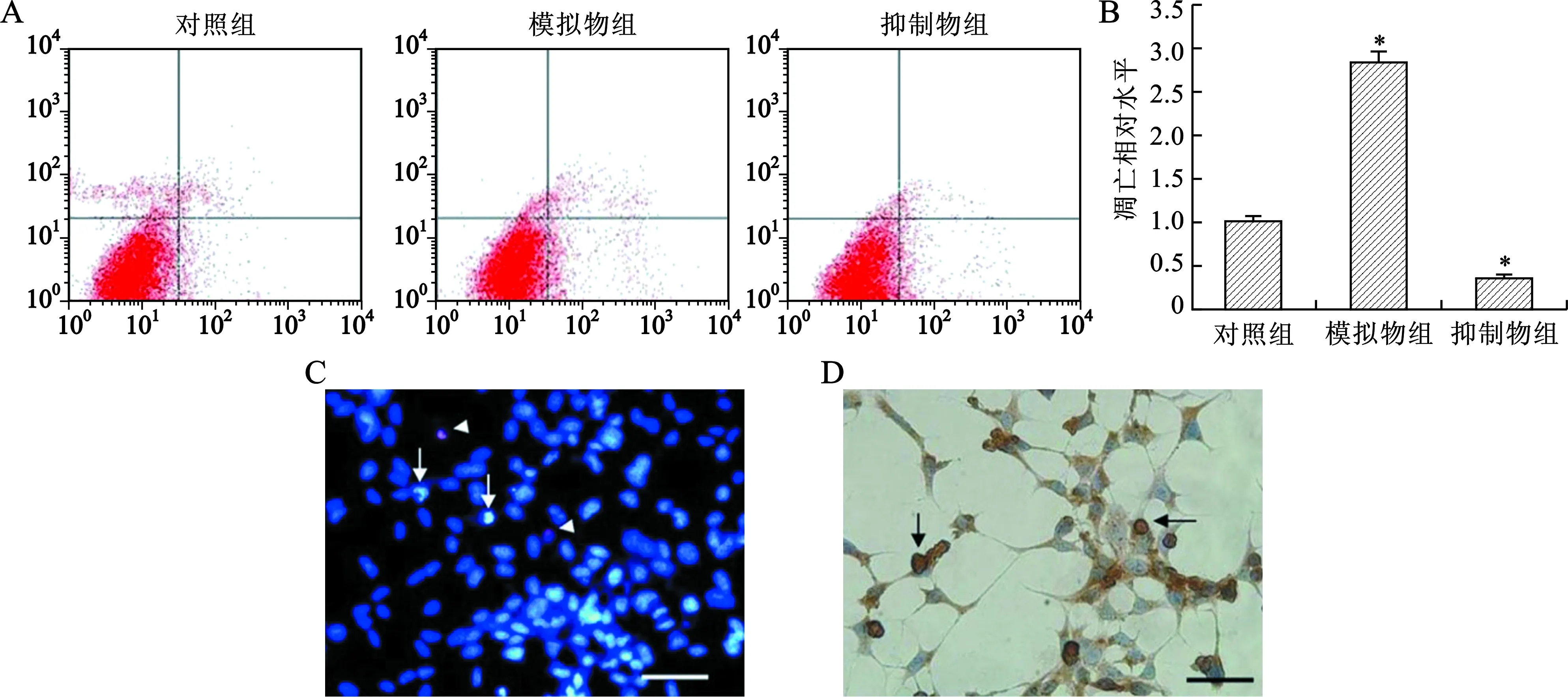
A:流式細胞儀檢測凋亡示意圖;B:MNK-45細胞凋亡統計圖(與對照組比較,*P<0.05);C:Hoechst33342和PI細胞核染色(×200);D:TUNEL染色(×200)
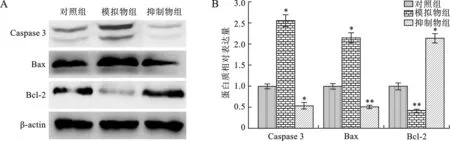
A:蛋白灰度圖;B:蛋白相對表達量統計圖(與對照組比較,*P<0.05,**P<0.01)
2.5 RhoA是miR-35的靶基因 利用Targetscan和MiRanda等靶基因預測軟件預測miR-35的潛在靶基因,發現RhoA基因的3’UTR上存在miR-35的潛在結合位點(圖5A)。繼而,利用熒光素酶報告基因技術發現miR-35能夠顯著抑制RhoA 3’UTR質粒的熒光素酶活性(P<0.05)(圖5B),說明RhoA是miR-35的直接作用靶基因。為了進一步驗證RhoA是miR-35的靶基因,我們分別將miR-35對照序列、模擬序列和互補配對序列分別轉染至MNK-45細胞內,隨后檢測細胞內RhoA蛋白的表達量,和對照組相比,miR-35模擬序列抑制RhoA蛋白的表達(P<0.05),而miR-35互補配對序列促進RhoA蛋白的表達(P<0.05)(圖5C、D)。
3 討 論
胃癌是世界范圍內最常見的胃腸道疾病之一,是導致癌癥相關死亡的第二大原因。由于胃癌在疾病的早期沒有明顯臨床表現,大多數患者在疾病的后期才被發現,不幸的是此時的康復機會較低[1-3]。故深入研究胃癌發病機制及尋求治療新靶點成為近年來的研究熱點。而miRNA研究較為深入,已有多種miRNA藥物已經進入臨床試驗[11]。文獻[7-8]回顧中發現miR-35在多種腫瘤發生發展調控中發揮重要作用,而為miR-35在胃腸道腫瘤方面的報道甚少。故為探究miR-35在胃腺癌中的作用,我們首先在正常胃黏膜細胞(GES-1)和4種胃癌細胞系(MNK-45、MGC803、SCG-7901和AGS)中檢測了miR-35的含量變化,結果發現,胃癌細胞系中miR-35含量明顯減低。上述結果暗示了,miR-35在胃癌發生發展中發揮重要調控作用。
細胞凋亡是受細胞自身調控的主動過程,該過程是一系列基因活動引起的級聯反應的結果。凋亡調控的紊亂會造成一系列的疾病,如感染、神經退行性疾病、血液系統疾病、自身免疫病和腫瘤等[12]。隨著對胃癌發病機制研究的不斷深入,細胞凋亡失衡成為胃癌發生發展的關鍵分子機制[13-14]。

A:miR-35和其潛在靶基因的互補序列示意圖;B:熒光素酶報告基因技術驗證miR-35和RhoA的靶向關系;C、D:Western blot檢測MNK-45細胞中RhoA含量(與對照組比較,*P<0.05)
為了驗證miR-35對胃癌細胞凋亡的調控作用,我們選取4種胃癌細胞系中應用廣泛且較為穩定的細胞系MNK-45作為研究對象[15]。我們首先利用細胞轉染技術在體外成功過表達或敲低胃癌細胞系MNK-45中miR-35含量。隨后我們應用包括流式細胞儀檢測技術、Hoechst33342和PI細胞核染色技術和TUNEL染色技術等多種技術檢測miR-35對胃癌細胞系MNK-45凋亡的作用,結果發現,miR-35可促進胃癌細胞系的凋亡,這與之前學者報道一致[16-17]。有研究[16]表明,miR-35通過拮抗核心細胞凋亡途徑來降低秀麗隱桿線蟲的凋亡閾值。也有學者報道,miR-35家族通過MPK-1/ERK-MAPK信號轉導調控秀麗隱桿線蟲DNA損傷誘導的凋亡[17]。凋亡失衡被認為是腫瘤發病機制中的關鍵途徑,而Caspase 3作為凋亡過程中最重要的執行者,在凋亡過程中發揮至關重要的作用,Bax和Bcl-2作為研究最為明確的促凋亡和抗凋亡蛋白,對Caspase 3有著決定性影響,這些靶蛋白被認為是腫瘤治療的重要靶點[18-19]。有研究[20-21]發現,胃癌組織或細胞中促凋亡基因Bax和凋亡執行基因Caspase 3低表達,而抑凋亡基因Bcl-2高表達,這使得胃癌組織或細胞凋亡減少。為進一步探究miR-35調控胃癌細胞凋亡的作用,我們驗證了miR-35對胃癌細胞系凋亡信號通路中關鍵分子表達的影響。在本實驗中,我們發現miR-35增加了胃癌細胞系促凋亡蛋白Bax和凋亡執行蛋白Caspase 3的表達,同時減少了抑凋亡蛋白Bcl-2的表達。
明確miR-35促進胃癌細胞凋亡的現象后,我們進一步探究其促凋亡的分子機制。miRNAs作為重要的轉錄后調控分子,對超過1/3的基因發揮調控作用,而miRNAs的5’端種子序列與靶基因3’端非編碼區的互補配對后對靶基因的沉默或降解是其對靶基因最主要的調控方式[7-9]。目前研究表明,在人類的多種腫瘤中RhoA基因被過度激活,進而促進腫瘤的生長及侵襲[22]。已經研究證實,抑制RhoA基因的活化可促進癌細胞凋亡,從而發揮抑癌作用[23-25]。為了探究miR-35促進胃癌細胞凋亡的機制,我們首先利用生物信息學分析技術預測了miR-35可能的靶基因,結果發現miR-35的5’端種子序列與RhoA基因的3’端非編碼區有著較高的匹配度。為了進一步驗證miR-35與RhoA基因的直接調控作用,我們通過熒光素酶報告基因技術驗證了miR-35可以直接靶向作用于癌基因RhoA,這可能是miR-35發揮抑癌作用的重要方式。隨后我們又在蛋白水平驗證了上述結論,即過表達miR-35后RhoA蛋白表達降低,而調低miR-35表達后RhoA蛋白表達升高。
綜上所述,多種胃癌細胞系內低表達miR-35,miR-35可通過靶向RhoA促進胃癌細胞MNK-45的凋亡。后續研究我們將進一步利用在體實驗驗證miR-35的抑癌作用及分子機制。

