基于網絡藥理學及全轉錄組測序對當歸四逆湯干預外泌體抑制多發性骨髓瘤血管新生的機制研究
付佳琪 蔡治國 于漫亞 郭志江 張云曉 崔興
〔摘要〕 目的 基于骨髓瘤細胞株外泌體測序及網絡藥理學研究當歸四逆湯抑制多發性骨髓瘤血管新生的機制,為后續研究提供有針對性的指導。方法 利用TCMSP在線平臺及SwissTargetPrediction網站獲取當歸四逆湯主要化學成分及對應靶點,借助GeneCards獲取多發性骨髓瘤血管新生相關靶點基因,經與當歸四逆湯作用靶點匹配后,獲得當歸四逆湯抑制多發性骨髓瘤血管新生的作用靶點,并篩選出相應作用成分。取正常人(n=5)和骨髓瘤患者(n=6)外周血清提取外泌體進行測序,獲得差異表達基因。對骨髓瘤細胞外泌體進行全轉錄組測序,取交集后獲得骨髓瘤來源外泌體差異表達基因。進而與當歸四逆湯抑制多發性骨髓瘤血管新生的作用靶點匹配,獲得當歸四逆湯干預外泌體抑制多發性骨髓瘤的作用靶點。借助STRING平臺與Cytoscape 3.8.2軟件對靶點間相互作用網絡進行分析,并利用Metascape網站進行GO功能和KEGG通路富集分析。運用R語言對結果進行可視化處理。最后對主要有效成分和作用靶點進行分子對接驗證。結果 當歸四逆湯作用于多發性骨髓瘤血管新生的有效成分有117種,干預外泌體發揮作用的相關靶點39個,包括CCND1、EGF等。GO分析結果顯示,當歸四逆湯作用于多發性骨髓瘤血管新生潛在靶點的生物功能涉及血管新生、血管系統發育、細胞周期調節等。KEGG通路富集顯示,當歸四逆湯作用于多發性骨髓瘤血管新生潛在靶點的通路主要涉及PI3K-AKT、HIF-1等與VEGF相關的信號通路等。分子對接結果表明主要有效成分槲皮素、樺木酸與關鍵作用靶點AKT1之間具有良好的對接活性。結論 本研究初步揭示了當歸四逆湯能夠通過PI3K-AKT、HIF-1通路干預外泌體抑制多發性骨髓瘤血管新生,為進一步的實驗研究提供基礎。
〔關鍵詞〕 外泌體;全轉錄組測序;當歸四逆湯;多發性骨髓瘤;血管新生;網絡藥理學
〔中圖分類號〕R285.5 ? ? ? 〔文獻標志碼〕A ? ? ? ?〔文章編號〕doi:10.3969/j.issn.1674-070X.2022.01.024
〔Abstract〕 Objective To explore the mechanism of Danggui Sini Decoction in inhibition of angiogenesis in multiple myeloma based on exosome sequencing of myeloma cells and network pharmacology, in order to provide targeted guidance for further studies. Methods The main chemical components and corresponding targets of Danggui Sini Decoction were obtained by TCMSP online platform and SwissTargetPrediction website. GeneCards was used to obtain the target genes related to angiogenesis of multiple myeloma. After matching with the targets of Danggui Sini Decoction, the targets of Danggui Sini Decoction inhibiting angiogenesis of multiple myeloma was obtained, and the corresponding action components were screened. Exosomes were extracted from peripheral blood serum of normal persons (n=5) and myeloma patients (n=6) and sequenced to obtain differentially expressed genes. Whole transcriptome sequencing of myeloma exosomes was performed, and the differentially expressed genes of myeloma-derived exosomes were obtained after intersection. Then, the targets of Danggui Sini Decoction in inhibiting angiogenesis of multiple myeloma were matched, and the targets of Danggui Sini Decoction intervening exosomes in inhibiting multiple myeloma were obtained. The interaction network between targets was analyzed by STRING platform and Cytoscape 3.8.2 software, and GO function and KEGG pathway enrichment analysis were performed by Metascape website. R language was used to visualize the results. Finally, molecular docking verification was performed on the main effective components and targets. Results There were 117 effective components of Danggui Sini Decoction on angiogenesis in multiple myeloma, and 39 related targets for intervention of exosomes, including CCND1, EGF, etc. GO analysis showed that the biological functions of potential targets of Danggui Sini Decoction on angiogenesis in multiple myeloma were related to angiogenesis, vascular system development and cell cycle regulation. KEGG pathway enrichment showed that the pathways of Danggui Sini Decoction acting on potential targets of multiple myeloma angiogenesis mainly involved PI3K-AKT, HIF-1 and other VEGF-related signaling pathways. Molecular docking results showed that quercetin and betulinic acid had good docking activity with key target AKT1. Conclusion This study preliminarily revealed Danggui Sini Decoction can intervene exosomes to inhibit multiple myeloma angiogenesis through PI3K-Akt and HIF-1 pathways, providing a basis for further research.
〔Keywords〕 exosome; whole transcriptome sequencing; Danggui Sini Decoction; multiple myeloma; angiogenesis; network pharmacology
多發性骨髓瘤(multiple myeloma, MM)屬于中醫學“骨蝕”“骨痹”的范疇。中醫理論認為,腫瘤發生發展的重要病因病機是寒凝瘀血內阻。寒凝血瘀證表明腫瘤組織處于缺血缺氧的微環境中[1],這種微環境能促進腫瘤分泌攜帶有血管生成因子的外泌體[2],促使腫瘤血管的新生。《素問·調經論》中載有“血氣者,喜溫而惡寒,寒則泣不能流,溫則消而去之”的治則,因而可以采用溫陽化瘀的中藥治療本病。溫陽化瘀中藥能夠改善機體高凝狀態和腫瘤周圍組織微循環,不僅可以直接抑制腫瘤血管新生,還能夠通過改善腫瘤周圍組織微環境,從腫瘤的生物學特征與血管生成相關因子等方面,阻斷腫瘤的血管新生[3]。當歸四逆湯源于《傷寒雜病論》,為醫圣張仲景所作的經典名方。本方溫陽活血通脈并舉,恰符合抑制外泌體所介導腫瘤血管新生的機制。
腫瘤細胞誘導的血管新生是大多數惡性腫瘤生長和轉移的前提[4],越來越多的研究表明,血管新生是MM瘤生長、浸潤、轉移過程中的重要環節[5]。沙利度胺、來那度胺可以通過抑制血管內皮生長因子(vascular endothelial growth factor, VEGF)、堿性成纖維細胞生成因子(basic fibroblast growth factor, BFGF)等的表達進而抑制血管新生[6],目前在MM的治療中已取得較好臨床效果[4]。外泌體對細胞通訊有著重要作用,能夠參與多種生物過程,如細胞凋亡、血管形成、炎癥等[7]。在對MM瘤的研究中發現,外泌體中富含雙調蛋白(amphiregulin, AREG),而AREG可以通過激活表皮生長因子受體(epidermal growth factor receptor, EGFR)[8]促進血管新生;外泌體亦可通過靶向抑制缺氧誘導因子1(hypoxia inducible factor 1, HIF-1)增強血管生成[9],從而參與骨髓微環境的血管新生,這些特點為抑制MM血管新生的治療提供了新的靶點。
網絡藥理學能夠系統地研究藥物對疾病網絡的干預和影響[10],其整體觀和系統理論與中醫學的整體觀念及中藥方劑多靶點、多成分的原理相一致,是研究中藥復方配伍與藥理作用的有效技術方法。分子對接技術通過理論模擬受體與配體之間的相互作用,預測其結合模式和親和力,從而能夠完善藥理學實驗的設計。
本研究通過提取外泌體并進行分析,結合網絡藥理學和分子對接技術,旨在闡釋當歸四逆湯抑制MM血管新生的有效活性成分及可能的分子機制,為后續的實驗研究提供一定的基礎。
1 材料與方法
1.1 ?外泌體提取與分析
1.1.1 ?試劑與儀器 ?RPMI-1640培養液(產品編號:CF0001-500ML)、RIPA裂解緩沖液均購自濟南Spark jade生物技術有限公司;胎牛血清(fetal bovine serum, FBS)(上海Beyotime生物技術有限公司,產品編號:C0256);anti-Calnexin(產品編號:sc-46669)、anti-TSG101(產品編號:sc-101254)、anti-CD63(產品編號:sc-5257)均購自美國Santa Cruz公司;外泌體快速沉淀試劑盒(美國System Bioscience公司);透射電鏡(日本Hitachi公司,型號:TEM-HT7700);BCA蛋白質測定試劑盒(上海Beyotime生物技術有限公司)。
1.1.2 ?臨床血清標本 ?本研究納入2019年8月在山東中醫藥大學附屬醫院(中國濟南)血液科住院的6例MM患者。招募5名健康志愿者作為對照組。該研究獲得山東中醫藥大學附屬醫院倫理委員會批準,所有參與者在試驗前簽署了知情同意書。將外周血樣品收集在真空促凝管中,并在離心(離心半徑16 cm,2500 r/min)5 min后獲得血清樣品。
1.1.3 ?U266細胞株培養收集上清液 ?MM細胞系U266來自美國模式培養物保藏所(American Type Culture Collection, ATCC),置于含有10% FBS、1%雙抗的培養液中,并放在37 ℃、5% CO2的培養箱中進行培養。培養骨髓瘤細胞到密度80%左右,棄上清,應用PBS洗滌細胞沉淀2次。將培養基更換為含有10%去除外泌體的FBS的RPMI-1640培養基,繼續培養36 h后收集細胞上清液。
1.1.4 ?外泌體提取 ?通過Exo Quick外泌體快速沉淀試劑盒分離正常人外周血血清及U266細胞上清液的外泌體。將250 μL血清樣品與63 μL Exo Quick外泌體沉淀溶液混合,在冰上孵育30 min并離心,然后吸取上清液,離心5 min,最后分離沉淀中的外泌體。
1.1.5 ?透射電鏡分析 ?用4%多聚甲醛固定外泌體,用PBS洗滌。將樣品在室溫下放置在碳涂覆的200目銅網格上20 min,并在1%戊二醛中固定5 min,然后用去離子水洗滌3次。用草酸鈾酰對樣品進行染色5 min,并以1∶9的比例加入一滴4%乙酸鈾酰和2%甲基纖維素在冰上包埋,再用透射電子顯微鏡對干燥的網格成像。
1.1.6 ?蛋白印跡分析 ?對MM患者和健康志愿者血清中提取的外泌體分別進行蛋白印跡分析。用RIPA裂解緩沖液(Spark jade)裂解細胞,用BCA蛋白質測定試劑盒測定(Beyotime)蛋白質濃度。等量的樣品蛋白用10% SDS-PAGE進行電泳分離,然后轉移到PVDF膜上。在5%脫脂奶溶液中浸泡2 h后,將膜在40 ℃下與一級抗體anti-Calnexin, anti-TSG101, anti-CD63(Santa Cruz Biotechnology, Santa Cruz, CA, USA)一起孵育過夜。然后,將膜與第二抗體(Beyotime)一起孵育1 h。最后,使用Alpha Innotech
Fluor Chem Q成像分析系統進行可視化。
1.1.7 ?高通量測序 ?利用Illumina Hiseq儀器上述兩種來源的外泌體進行150 bp雙端測序,相關基因表達分析由上海云序生物科技有限公司進行。
1.2 ?網絡藥理學研究
1.2.1 ?當歸四逆湯有效成分及靶點的篩選 ?通過TCMSP在線平臺[11]尋找當歸四逆湯中當歸、桂枝、白芍、細辛、通草、甘草、大棗的化學組成成分,根據口服生物利用度(oral bioavailability, OB)≥30%和類藥性(drug likeness, DL)≥0.18的2個ADME屬性值篩選出符合條件的化學成分及其對應靶點,借助UniProt蛋白質數據庫,物種設定為“human”,將靶點轉換為對應的基因,并利用SwissTargetPrediction網站[12](http://www.swisstargetprediction.ch/)補充藥物有效成分的作用靶點信息。
1.2.2 ?MM靶點的收集與篩選 ?以“multiple myeloma and angiogenesis”為檢索詞,通過GeneCards數據庫、OMIM數據庫檢索相應的靶點。合并2個疾病數據庫靶點后,刪除重復值得到MM靶點。
1.2.3 ?當歸四逆湯成分-作用靶點網絡構建 ?將當歸四逆湯成分靶點與MM血管新生靶點取交集,獲得當歸四逆湯抑制MM血管新生的作用靶點。根據交集靶點反向篩選當歸四逆湯有效成分,構建當歸四逆湯成分-作用靶點網絡,將其導入Cytoscape 3.8.2軟件[13],使用Network Analyzer功能進一步分析當歸四逆湯成分-作用靶點網絡,根據成分與靶點連接情況篩選出當歸四逆湯作用于MM的關鍵成分。
1.3 ?當歸四逆湯干預外泌體抑制MM血管新生的機制研究
1.3.1 ?當歸四逆湯-外泌體靶點基因網絡圖構建 ?將當歸四逆湯抑制MM血管新生靶點基因與外泌體差異表達基因取交集,即獲得當歸四逆湯干預外泌體抑制MM血管新生的作用靶點。利用STRING平臺[14]與Cytoscape軟件,對交集靶點進行網絡拓撲分析,并構建當歸四逆湯-外泌體靶點基因網絡圖。
1.3.2 ?KEGG與GO分析 ?應用Metascape數據平臺對當歸四逆湯干預外泌體抑制MM血管新生的相關靶點進行富集分析,以P<0.01為篩選標準,進行GO和KEGG通路富集分析,并借助R語言對富集結果進行可視化處理。
1.3.3 ?分子對接 ?篩選出當歸四逆湯干預外泌體抑制MM血管新生的主要有效成分與靶點,利用RCSB PDB數據庫(https://www.rcsb.org/)獲得核心靶點蛋白晶體結構的PDB格式文件,通過TCMSP數據庫獲得有效成分的Mol2格式文件,利用AutoDock Tools對核心靶點和有效成分進行處理,獲得相應的pdbqt格式文件,利用Vina進行分子對接,并統計各模型的結合能,最后用PyMol對活性較高的對接模型進行可視化。
2 結果
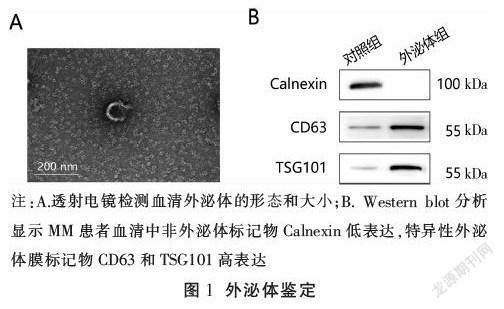
2.1 ?外泌體的鑒定
透射電鏡顯示直徑<100 nm的圓形外泌體(圖1A)。Western blot分析證實MM患者血清中非外體標記Calnexin的低表達和特異性外體膜標記CD63和TSG101(圖1B)的高水平。
2.2 ?外泌體測序結果
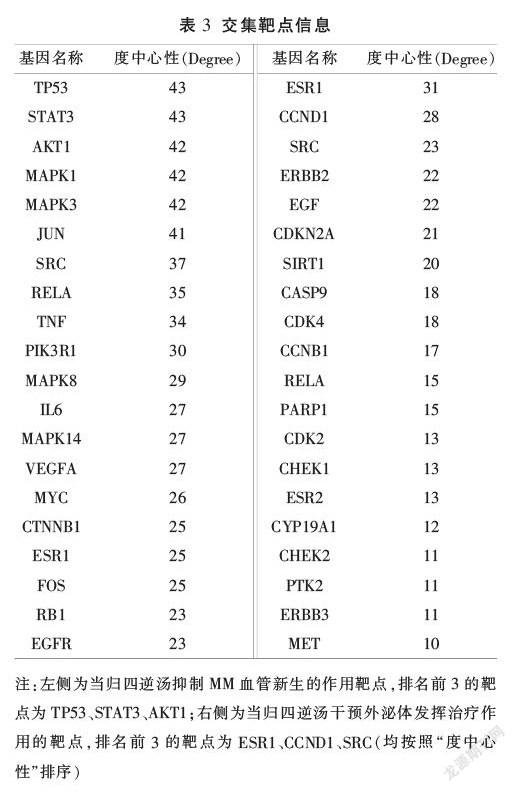
與健康志愿者相比,骨髓瘤患者外周血外泌體高通量測序共發現了20 309個差異表達的mRNA。為篩選表達差異顯著的外泌體mRNA,以FC值和P值(FC≥2.0和P<0.05)作為統計學顯著性標準,總共有6782個mRNA在MM患者和健康對照組中有顯著不同的表達,其中,5982個為上調mRNA,800個為下調mRNA。U266全轉錄組測序共獲得13 629個mRNA。
2.3 ?當歸四逆湯有效成分及靶點
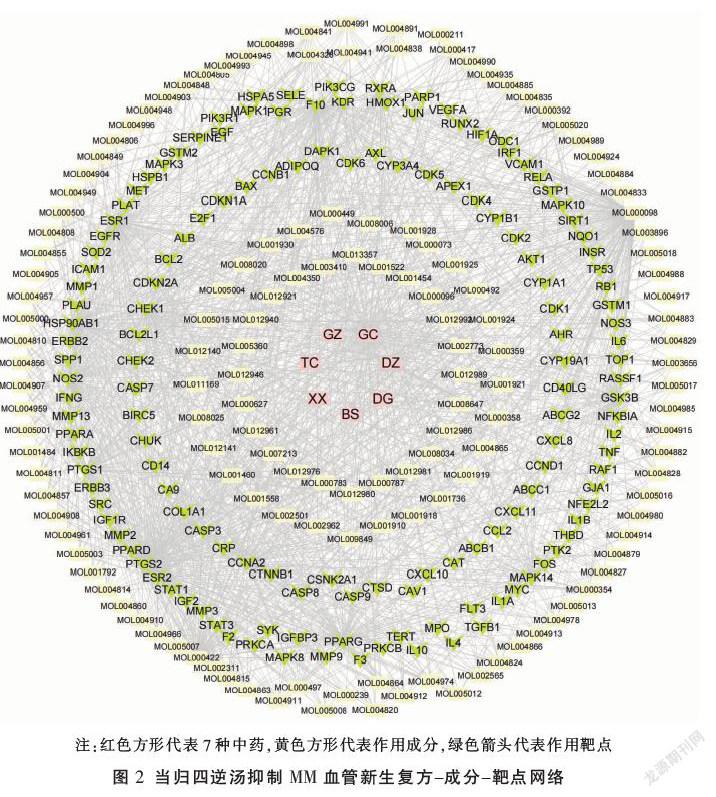
在TCMSP數據庫中,初步檢索到7味中藥化學成分共1069種,經ADME篩選后,得到有效成分155種,刪除25種無作用靶點的成分,即130種有效成分(見表1)。將130個有效成分與中藥構建復方-成分網絡(見圖2),并對網絡進行拓撲分析,根據“中介中心性”降序排列,前4位的有效成分分別是樺木酸、山柰酚、槲皮素、谷甾醇。
通過TCMSP數據庫篩選有效成分靶點信息,結合SwissTargetPrediction在線靶標垂釣,并統一在UniProt蛋白質數據庫將化合物作用的蛋白質靶點進行規范。共收集到相關作用靶點共346個(已刪除重復值)。
2.4 ?MM血管新生靶點的獲取
從GeneCards數據庫獲得MM瘤血管新生靶點1770個。設定Score大于中位數的靶點為MM血管新生的潛在靶點,連續進行2次篩選后,結合OMIM數據庫補充相關靶點,合并后刪除重復值,得到MM相關靶點885個。
2.5 ?當歸四逆湯成分-作用靶點網絡構建
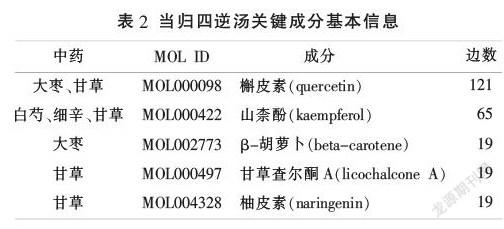
將篩選的當歸四逆湯活性成分靶點與MM血管新生靶點通過R語言取交集,并將交集靶點通過STRING平臺與Cytoscape軟件構建靶點相互作用網絡,最終獲得143個交集靶點(見表3)。根據交集靶點反向篩選當歸四逆湯有效成分,得到作用于MM血管新生的相關活性成分117個,通過Cytoscape軟件的Network Analyzer功能構建當歸四逆湯成分-靶點網絡,根據“度中心性”排序發現,前5位化合物為槲皮素、山柰酚、β-胡蘿卜素、甘草查爾酮A、柚皮素(見表2),推測可能為當歸四逆湯抑制MM血管新生的關鍵成分。
2.6 ?當歸四逆湯-外泌體靶點基因網絡構建
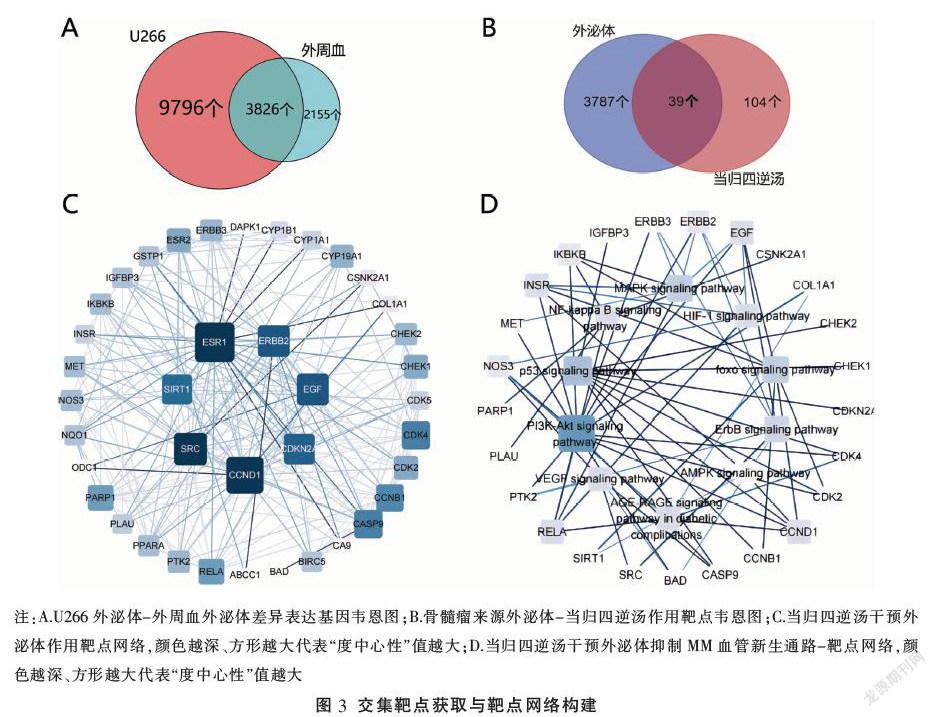
將人外周血外泌體差異上調基因與U266測序基因取交集,獲得3862個骨髓瘤細胞來源的差異基因(見圖3A),將其與當歸四逆湯作用靶點匹配,獲得當歸四逆湯干預外泌體抑制MM血管新生的可能作用靶點39個(見表3,圖3B)。借助STRING平臺與Cytoscape軟件制作當歸四逆湯干預外泌體作用靶點網絡圖(圖3C)。
2.7 ?KEGG與GO分析
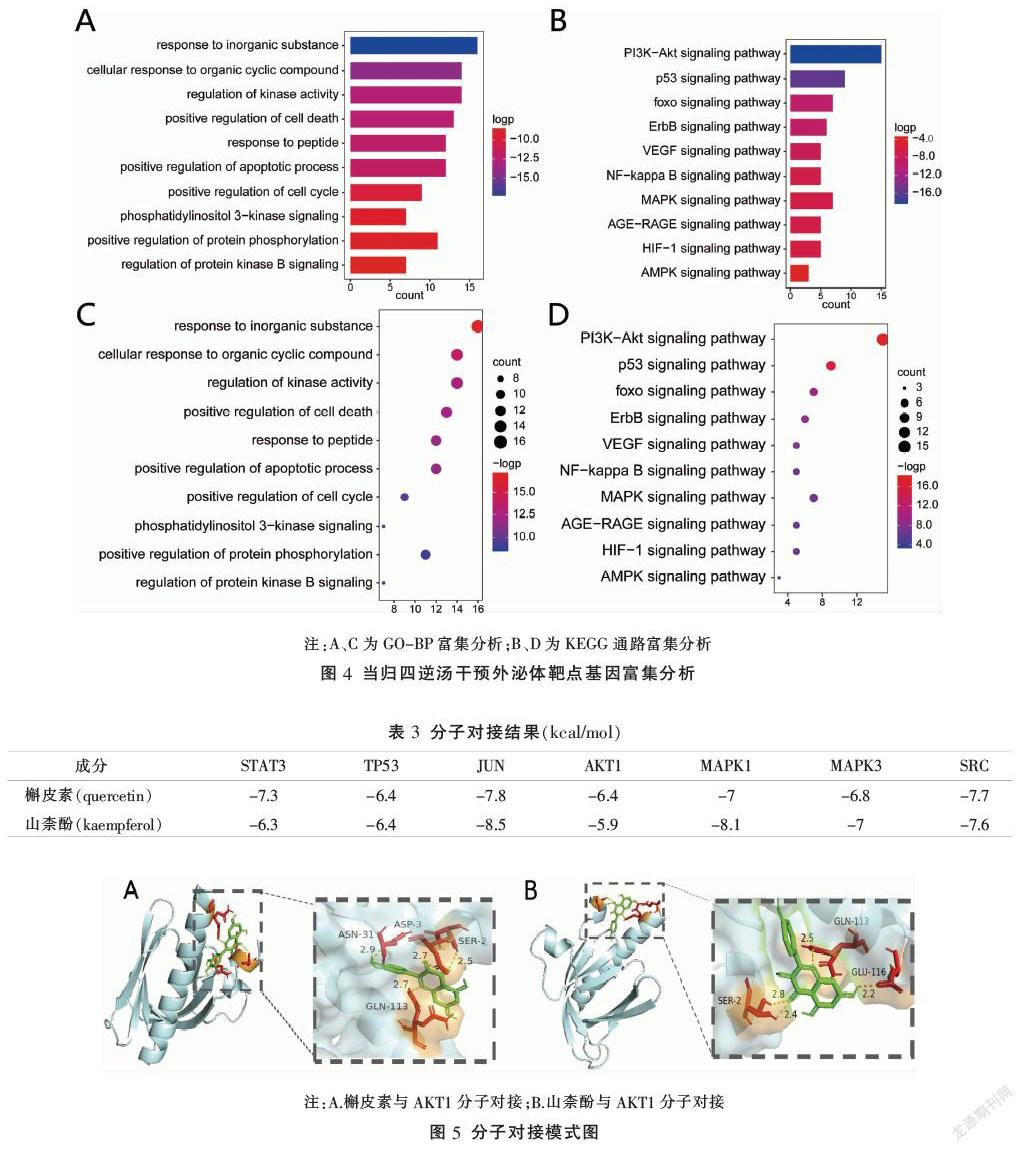
應用Metascape數據平臺對當歸四逆湯干預外泌體抑制MM血管新生相關的39個靶點進行富集分析,以P<0.01為篩選標準,獲得GO生物學過程條目587條、KEGG通路27條,運用R語言對富集顯著的相關通路進行可視化處理(圖4)。
GO生物學過程分析結果顯示,相關靶點基因富集在血管發育(blood vessel development)、血管形態發育(blood vessel morphogenesis)、激酶活性的調控(regulation of kinase activity)、細胞周期的調節(regulation of cell cycle)等生物學過程。
KEGG通路包括PI3K-AKT信號通路、p53信號通路、VEGF信號通路、NF-kappa B信號、MAPK信號通路、AGE-RAGE信號通路、HIF-1信號通路等。選取P值在前10位的通路建立靶點-通路網絡(見圖3D)進行分析,發現多個靶點顯著富集在PI3K-AKT信號通路,同時多條信號通路與血管新生有關,如VEGF信號通路、HIF-1信號通路等。這提示當歸四逆湯可以通過多條通路干預外泌體從而抑制MM血管新生。
2.8 ?分子對接
通過KEGG分析并進一步查閱文獻,發現當歸四逆湯抑制MM血管新生中的多條通路均有PI3K-AKT信號通路的參與,而AKT1是該通路上的關鍵靶點,而AKT1同時為當歸四逆湯發揮作用的關鍵靶點,因此,選取2種主要有效成分(槲皮素、山柰酚)與AKT1結合模式進行展示(見圖5)。由圖5可見槲皮素和山柰酚與JUN、MAPK1、AKT1靶點蛋白均形成氫鍵,表明具有良好的結合性。
3 討論
腫瘤細胞分泌的外泌體對血管新生具有重要影響,腫瘤細胞來源的外泌體能夠通過Hh-GLI信號通路促進VEGF的表達[15],也可通過分泌EGFR誘導血管新生[16]。本研究團隊通過對U266細胞外泌體進行測序,并將高表達基因與當歸四逆湯抑制MM血管新生的靶點進行匹配,進一步分析發現,U266細胞外泌體差異表達的mRNA中存在VEGF等血管新生相關的mRNA高表達。KEGG通路富集分析顯示,主要富集于PI3K-AKT、AGE-RAGE、VEGF、HIF-1等信號通路,揭示了當歸四逆湯干預U266外泌體抑制血管新生的主要機制。
網絡藥理學分析發現,樺木酸、山柰酚、槲皮素、谷甾醇可能是本方發揮作用的重要成分。樺木酸可抑制HIF-1α的轉錄,進而抑制HIF-1α和STAT3與VEGF基因啟動子的結合來減少新生血管形成[17];山柰酚能夠通過調節VEGF/VEGF-2及其下游信號級聯,從而起到抑制血管新生的作用[18];槲皮素為黃酮類化合物,有研究表明槲皮素能夠下調VEGF-A的表達,能夠很好的抑制血管新生[19-20]。以上3種成分在當歸四逆湯成分中“中介中心性”排序為前3位,提示樺木酸、山柰酚、槲皮素可能是當歸四逆湯發揮抗血管新生的重要成分,而通過分子對接技術,驗證了槲皮素、山柰酚與相關靶點具有良好的結合性。從而推測當歸四逆湯主要通過以下機制干預外泌體抑制骨髓瘤血管新生:(1)槲皮素通過抑制VEGF的表達水平抑制腫瘤血管新生[21];(2)槲皮素可以抑制HIF-1α的轉錄活性從而抑制腫瘤血管新生[22];(3)槲皮素與山柰酚一同抑制AKT的表達[22],從而抑制MM血管新生。
通路富集結果顯示,當歸四逆湯干預外泌體抑制血管新生相關的通路主要集中在以下幾條:(1)PI3K/AKT信號通路:PI3K為兩個亞基構成的異二聚體,包括催化亞基和調節亞基[23],其活化后能夠將3,4-二磷酸磷脂酰肌醇(PIP2)轉化為3,4,5-三磷酸磷脂酰肌醇(PIP3)[24]。AKT是PI3K的下游信號分子,能夠與PIP3相結合,從而激活Ser473位點,進而調控腫瘤細胞的凋亡。VEGF啟動子包含多種轉錄調節因子,如SP1/SP3的結合位點[25],在受到刺激時,PI3K的調節亞基會磷酸化,AKT上Ser473也磷酸化,從而使PI3K/AKT激活,SP1上的Thr453與Thr739被磷酸化,啟動VEGF的轉錄[26]。AKT活化可啟動下游信號分子mTOR,mTOR能夠促進VEGF的上調,促進血管新生[27]。此外,mTOR還可調節STAT3的活化,而STAT3在腫瘤缺氧環境下,能夠和HIF-1α與VEGF啟動子結合,從而促進血管新生[28];同時能夠促進其下游目標如BFGF、HGF的表達,從而導致新生血管形成。(2)VEGF相關通路:VEGF是血管新生過程中最重要的調節因子之一[29],其介導的各信號級聯幾乎參與血管新生的各個過程[30]。VEGF的表達水平與骨髓瘤血管新生關系密切,已經有學者將其作為其評價療效及危險度指標之一[31]。(3)HIF-1α相關通路:HIF-1α為缺氧情況下誘導產生的特異結合蛋白,其與HIF-1β構成活性HIF-1異二聚體,參與缺氧反應基因調節,從而使細胞適應低氧環境,促進血管新生,有研究顯示[32-33],HIF-1α可能通過上調Ang-2表達,進一步上調多種促血管生成因子的表達從而導致腫瘤血管新生。而且在HIF-1α調節其下游基因VEGF的過程中,PI3K/AKT通路也會起重要調節作用[34]。因此,HIF-1α在腫瘤血管新生中具有重要的意義。
綜上所述,本研究通過對U266及外周血清外泌體進行高通量測序并結合網絡藥理學,系統分析了當歸四逆湯干預外泌體抑制MM血管新生的作用機制,并通過分子對接技術驗證了有效成分與核心靶點之間具有良好的結合活性,從而證實了本研究團隊的假說:溫陽化瘀中藥可以通過干預腫瘤細胞分泌外泌體介導血管新生抑制腫瘤發展,腫瘤所處寒凝血瘀狀態與血管新生存在一定的聯系。當歸四逆湯抑制MM血管新生具有多靶點、多通路的特點,為當歸四逆湯的進一步研究提供理論基礎。
參考文獻
[1] 周華妙,郭 ?勇.寒凝血瘀對結腸癌肺轉移模型小鼠肺組織VEGF、MMP-2表達的影響[J].浙江中西醫結合雜志,2012,22(6):429-432.
[2] 周 ?輝,沈偉鋒,邵平揚.缺氧外泌體傳遞miR-199a-5p對胃癌細胞SGC-7901遷移和侵襲的影響[J].醫學信息,2021,34(1):78-82,86.
[3] 熊文杰,劉煥勛,史敦云,等.骨髓瘤細胞來源外泌體對NK細胞表面活化受體的影響[J].中國實驗血液學雜志,2017,25(6):1713-1717.
[4] 師 ?亮,陳 ?浩,崔慧林,等.青蒿琥酯對人骨髓瘤細胞抗血管生成的作用[J].解剖學雜志,2018,41(2):152-155.
[5] 伏 ?杰,王松坡,李 ?琦,等.活血化瘀中藥抗腫瘤血管新生的實驗研究進展[J].中華中醫藥學刊,2020,38(4):153-157.
[6] 楊學文,馬利敏,趙小強,等.雷利度胺聯合化療治療急性白血病的臨床效果及對血管生成因子的影響[J].中國實驗血液學雜志,2016,24(3):702-706.
[7] 王含必,鄧成艷.外泌體的生物功能及臨床治療應用潛能[J].生殖醫學雜志,2021,30(7):966-970.
[8] RAIMONDO S, SAIEVA L, VICARIO E, et al. Multiple myeloma-
derived exosomes are enriched of amphiregulin (AREG) and activate the epidermal growth factor pathway in the bone microenvironment leading to osteoclastogenesis[J]. Journal of Hematology & Oncology, 2019, 12(1): 2.
[9] UMEZU T, TADOKORO H, AZUMA K, et al. Exosomal miR-135b shed from hypoxic multiple myeloma cells enhances angiogenesis by targeting factor-inhibiting HIF-1[J]. Blood, 2014, 124(25): 3748-3757.
[10] 張彥瓊,李 ?梢.網絡藥理學與中醫藥現代研究的若干進展[J].中國藥理學與毒理學雜志,2015,29(6):883-892.
[11] RU J L, LI P, WANG J N, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J]. Journal of Cheminformatics, 2014, 6: 13.
[12] GFELLER D, MICHIELIN O, ZOETE V. Shaping the interaction landscape of bioactive molecules[J]. Bioinformatics, 2013, 29(23): 3073-3079.
[13] SHANNON P, MARKIEL A, OZIER O, et al. Cytoscape: a software environment for integrated models of biomolecular interaction networks[J]. Genome Research, 2003, 13(11): 2498-2504.
[14] SZKLARCZYK D, MORRIS J H, COOK H, et al. The STRING database in 2017: Quality-controlled protein–protein association networks, made broadly accessible[J]. Nucleic Acids Research, 2017, 45(D1): D362-D368.
[15] BHAT A, YADAV J, THAKUR K, et al. Exosomes from cervical cancer cells facilitate pro-angiogenic endothelial reconditioning through transfer of Hedgehog-GLI signaling components[J]. Cancer Cell International, 2021, 21(1): 319.
[16] 劉軒宇,陳 ?磊.外泌體在胃癌腹膜轉移中機制的研究進展[J].外科理論與實踐,2021,26(1):76-78.
[17] 高 ?倩,吳 ?佩,何 ?疆,等.青蒿素和樺木酸阻斷脂多糖誘導小鼠血管新生及組織增殖[J].中國藥學雜志,2015,50(4): 330-338.
[18] CHIN H K, HORNG C T, LIU Y S, et al. Kaempferol inhibits angiogenic ability by targeting VEGF receptor-2 and downregulating the PI3K/AKT, MEK and ERK pathways in VEGF-stimulated human umbilical vein endothelial cells[J]. Oncology Reports, 2018, 39(5): 2351-2357.
[19] 李彩麗,廖應英,成 ?丹,等.槲皮素對食管癌Eca109細胞遷移侵襲及血管生成的影響[J].國際消化病雜志,2017,37(2):104-108.
[20] TANG S M, DENG X T, ZHOU J, et al. Pharmacological basis and new insights of quercetin action in respect to its anti-cancer effects[J]. Biomedicine & Pharmacotherapy, 2020, 121: 109604.
[21] HAO Y L, ZHANG C P, SUN Y Y, et al. Licochalcone A inhibits cell proliferation, migration, and invasion through regulating the PI3K/AKT signaling pathway in oral squamous cell carcinoma[J]. OncoTargets and Therapy, 2019, 12: 4427-4435.
[22] 史新萌,劉玉萍,瞿 ?鼎,等.抑制HIF-1α表達的中藥抗腫瘤活性成分研究進展[J].藥學學報,2021,56(10):2689-2719.
[23] 耿軍輝,張麗軍,王亞麗,等.PI3K/Akt信號通路與腫瘤血管新生的研究進展[J].現代腫瘤醫學,2018,26(9):1462-1466.
[24] 劉澤宇,萬宇翔,黃金昶.當歸四逆湯治療肝細胞癌作用機制的網絡藥理學分析[J].中國實驗方劑學雜志,2020,26(6):185-192.
[25] S?覫LVSTEN C A E, PAOLI F, CHRISTENSEN J H, et al. Voluntary physical exercise induces expression and epigenetic remodeling of VEGF A in the rat Hippocampus[J]. Molecular Neurobiology, 2018, 55(1): 567-582.
[26] SHARMA S, GURU S K, MANDA S, et al. A marine sponge alkaloid derivative 4-chloro fascaplysin inhibits tumor growth and VEGF mediated angiogenesis by disrupting PI3K/Akt/mTOR signaling cascade[J]. Chemico-Biological Interactions, 2017, 275: 47-60.
[27] XU T W, LV Z, CHEN Q H, et al. Vascular endothelial growth factor over-expressed mesenchymal stem cells-conditioned media ameliorate palmitate-induced diabetic endothelial dysfunction through PI-3K/AKT/m-TOR/eNOS and p38/MAPK signaling pathway[J]. Biomedicine & Pharmacotherapy, 2018, 106: 491-498.
[28] LEE H, JEONG A J, YE S K. Highlighted STAT3 as a potential drug target for cancer therapy[J]. BMB Reports, 2019, 52(7): 415-423.
[29] 鄭 ?碩,黃奕紅.肝癌組織中血管內皮生長因子、胰島素樣生長因子-Ⅱ的表達情況及影響因素分析[J].吉林醫學,2021,42(5):1064-1067.
[30] 向本旭,劉婷婷,孫芳玲,等.VEGF相關信號通路在血管新生中的研究進展[J].中國比較醫學雜志,2015,25(12):81-86.
[31] PALTA A, KAUR M, TAHLAN A, et al. Evaluation of angiogenesis in multiple myeloma by VEGF immunoexpression and microvessel density[J]. Journal of Laboratory Physicians, 2020, 12(1): 38-43.
[32] 王寶財,金壽德,張 ?新.缺氧誘導因子-1α對非小細胞肺癌血管生成及其對預后的影響[J].臨床肺科雜志,2021,26(5):747-751.
[33] BAHRAMI A, ATKIN S L, MAJEED M, et al. Effects of curcumin on hypoxia-inducible factor as a new therapeutic target[J]. Pharmacological Research, 2018, 137: 159-169.
[34] WANG D F, ZHAO W, LIU J R, et al. Effects of HIF-1α on spermatogenesis of varicocele rats by regulating VEGF/PI3K/Akt signaling pathway[J]. Reproductive Sciences, 2021, 28(4): 1161-1174.

