參附注射液有效成分治療急性心肌梗死作用機制的網(wǎng)絡(luò)藥理學(xué)研究*
藍 洲 陀 鵬 梁鐙月 朱冬玲 韋宜賓 鄧海霞 趙 旋(廣西中醫(yī)藥大學(xué)第一附屬醫(yī)院,廣西 南寧 530021)
急性心肌梗死(AMI)的病理生理機制主要是因冠脈嚴(yán)重狹窄或易損斑塊的破裂而導(dǎo)致的急性血栓形成,或伴有血管收縮劑微血管栓塞,引起心肌缺血壞死。因其住院率及死亡率呈同比上升趨勢,且預(yù)后差,已嚴(yán)重威脅我國民眾健康[1]。因此,早期發(fā)現(xiàn)易損斑塊并進行藥物或器械等預(yù)防性治療是預(yù)防AMI的關(guān)鍵措施[2]。目前,進行緊急經(jīng)皮冠狀動脈介入治療(PCI)及溶栓是治療AMI的主要有效手段,最大限度地提高再灌注療效,但治療費用頗高,且存在較多的并發(fā)癥,如急性心力衰竭、交感風(fēng)暴等,尤其在出院后長期的預(yù)防用藥及心臟康復(fù)治療更給社會及家庭帶來沉重的經(jīng)濟負擔(dān)。故目前尋求有效的藥物防治AMI仍是難以攻克的問題。AMI屬于中醫(yī)學(xué)心系病證中“真心痛”范疇,其發(fā)病基礎(chǔ)是本虛,標(biāo)實是發(fā)病條件,臨床上以寒凝心脈證、正虛陽脫證為常見,故通常選用溫補心陽、回陽救逆、益氣固脫之方藥進行干預(yù),研究證實能取得較好的臨床療效[3-4]。目前,由紅參、附子提取制作而成的參附注射液(SFI)具有很好的臨床應(yīng)用價值,且安全性能好,其主要生物活性源于人參皂苷及多類生物堿成分,兩者相輔相成,共同發(fā)揮藥物療效。多項研究表明,SFI可發(fā)揮抑制細胞凋亡、調(diào)節(jié)免疫等作用,對心肌細胞起保護作用,可明顯減輕心臟血管的再灌注損傷[5-6]。在AMI中,使用SFI得以補益陽氣、溫振心陽,從而達到治療目的[7]。本研究采用網(wǎng)絡(luò)藥理學(xué)方法探討SFI主要生物成分治療AMI的作用機制,旨在為進一步的實驗研究和臨床應(yīng)用提供思路。
1 資料與方法
1.1 SFI有效成分獲取 通過中藥系統(tǒng)藥理學(xué)數(shù)據(jù)庫與分析平臺(TCMSP)數(shù)據(jù)庫(https://old.tcmsp-e.com/tcmsp.php)對SFI中所含中藥(紅參、附子)進行檢索,以生物利用度(OB)>30%、類藥性(DL)>0.18為標(biāo)準(zhǔn)進行篩選,其中OB是指中藥被吸收入人體循環(huán)的速度與程度,OB>30%表示有效;DL指化合物與已知藥物的相似性,從而確定藥物的某種化合物是作用于人體的[8]。得到符合標(biāo)準(zhǔn)的成分(Ingredients)和相關(guān)靶點(Related Targets),進而得到藥物有效成分及靶點的信息表格圖。
1.2 AMI與SFI對應(yīng)分子靶標(biāo)的獲取 通過Gene-Cards數(shù)據(jù)庫(https//www.genecards.org)及在線人類孟德爾遺傳數(shù)據(jù)庫(OMIM)(https://www.omim.org),以“AMI”為關(guān)鍵詞,采用Cytoscape 3.6.1軟件,檢索得到疾病的靶點,采用ActivePerl軟件、venny.R、Java插件、R軟件、UltraEdit等軟件分析,得到藥物靶點和疾病靶點交集部分,找出藥物對應(yīng)疾病的關(guān)鍵靶點,構(gòu)建疾病與藥物文恩圖,此處文恩圖指SFI有效成分中所對應(yīng)的靶點與AMI靶點相互交集的關(guān)系圖,并將其可視化。
1.3 AMI與SFI的蛋白互作網(wǎng)絡(luò)圖及核心基因構(gòu)建 利用SRTING數(shù)據(jù)庫(https://string-db.org),復(fù)制并輸入疾病與藥物相交集的靶基因,以“Homo sapiens”作為檢索條件,隱藏?zé)o關(guān)系的游離點,繪制出疾病與藥物間蛋白互作網(wǎng)絡(luò)圖,并高清輸出,統(tǒng)計并分析疾病與藥物基因蛋白之間的連線關(guān)系(基因蛋白間連線越多,則說明該基因蛋白在疾病與藥物關(guān)系中所起的作用越關(guān)鍵)。
1.4 基因本體生物學(xué)過程(GO-BP)富集分析及基因組百科全書(KEGG)通路分析 將疾病與藥物相交集的33個基因名字轉(zhuǎn)化為基因的ID,在R軟件中安裝citation(“DOSE”)、citation(“clusterProfiler”)、citation(“pathview”)等相應(yīng)的軟件包,修改相應(yīng)的公眾目錄,運行并構(gòu)成的網(wǎng)絡(luò)圖進行GO功能富集分析及KEGG的通路富集分析,以統(tǒng)計學(xué)P<0.05為條件進行過濾,通過此步驟明確SFI是通過調(diào)節(jié)人體的何種功能或通路來達到治療AMI的目的。
2 結(jié) 果
2.1 SFI中有效成分 通過TCMSP數(shù)據(jù)庫進行檢索,以O(shè)B>30%、DL>0.18作為篩選標(biāo)準(zhǔn),得到SFI有效成分共24個。有效成分包括谷甾醇(sitosterol)、次烏頭堿(hypaconitine)、β-谷甾醇(beta-sitosterol)、人參皂苷rh2(ginsenoside rh2)等,見表1。

表1 SFI中有效成分
2.2“SFI有效成分-靶點-AMI”文恩圖 見圖1。利用GeneCards數(shù)據(jù)庫及OMIM數(shù)據(jù)庫,以“AMI”為檢索關(guān)鍵詞,得到疾病的靶點共3 341個,如白細胞介素-6(IL-6)、FMS樣的酪氨酸激酶3(FLT3)、腫瘤壞死因子(TNF)、腫瘤蛋白p53(TP53)、非受體型酪氨酸蛋白激酶2(JAK2)、白細胞介素-10(IL-10)等,兩者取交集后獲得藥物成分疾病共同核心靶點33個,以文恩圖形式展現(xiàn),其中藍色區(qū)域代表Disease(疾病-AMI),紅色區(qū)域代表Drug(藥物-SFI),暗紅色區(qū)域代表疾病與藥物相交集的核心靶點。
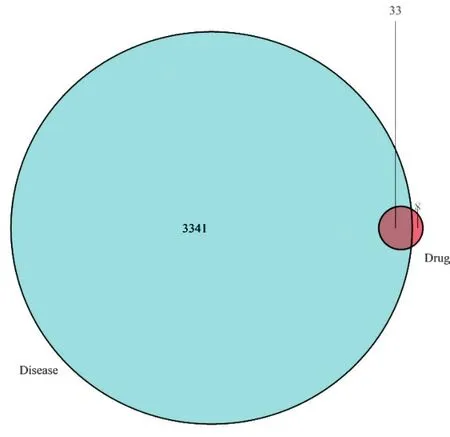
圖1 “SFI有效成分-靶點-AMI”文恩圖
2.3 SFI與AMI的蛋白互作網(wǎng)絡(luò)圖構(gòu)建 見圖2。利用SRTING數(shù)據(jù)(https://string-db.org),復(fù)制并輸入疾病與藥物相交集的靶點,即文恩圖中兩者相交集的33個靶點,以“Homo sapiens”作為檢索條件,去掉游離無作用的單個蛋白靶點,在線網(wǎng)絡(luò)生成SFI與AMI的蛋白互作網(wǎng)絡(luò)圖。由蛋白互作網(wǎng)絡(luò)圖可以得出,AMI與SFI關(guān)系較為緊密的蛋白分子有半胱氨酸-天冬氨酸蛋白酶 3(CASP3)、白細胞介素-1β(IL-1β)、半胱氨酸-天冬氨酸蛋白酶8(CASP8)、半胱氨酸-天冬氨酸蛋白酶1(CASP1)等。紫色連線表明PTGS2與CASP1、CASP3之間具有實驗論證的證據(jù)。JUN與CASP9既存在融合關(guān)系,也具有共表達關(guān)系。由此,筆者可以預(yù)測JUN、CASP3、IL-1β、CASP8、PTGS2等可能是SFI治療AMI的核心潛在靶點蛋白。
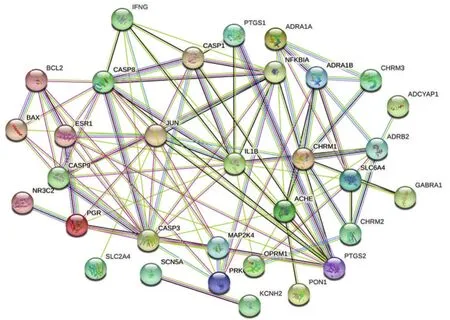
圖2 “AMI-SFI”蛋白互作網(wǎng)絡(luò)圖
2.4 SFI中有效成分及靶點蛋白治療AMI的GO功能富集分析 見圖3。根據(jù)GO富集分析柱狀圖可知,筆者得到功能富集數(shù)目較多的活性物質(zhì)共20個,顏色的不同表明不同的富集關(guān)系,其中功能富集受體活動較強的5個是:G protein-coupled amine receptor activity(G蛋白偶聯(lián)的胺受體活性)、G protein-coupled neurotransmitter receptor activity(G蛋白偶聯(lián)的神經(jīng)遞質(zhì)受體活性)、postsynaptic neurotransmitter receptor activity(突觸后神經(jīng)遞質(zhì)受體活性)、acetylcholine receptor activity(乙酰膽堿受體活性)以及steroid hormone receptor activity(類固醇激素受體活性)。由此,筆者可預(yù)測SFI可能通過以上富集活性較強的受體,起到對AMI的干預(yù)作用。
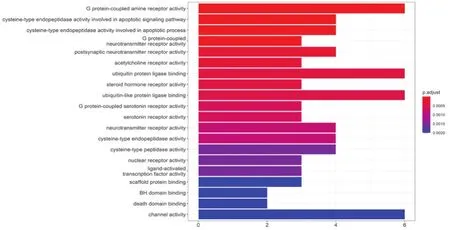
圖3 SFI-AMI的GO功能富集柱狀圖
2.5 SFI中有效成分及靶點蛋白治療AMI的KEGG的通路富集分析 見圖4~圖5。由圖4可以統(tǒng)計總共有20條相關(guān)通路,根據(jù)富集的程度,IL-17 signaling pathway(IL-17信號通路)、TNF signaling pathway(TNF信號通路)、C-type lectin receptor signaling pathway(C型凝集素受體信號通路)、p53 signaling pathway(p53信號通路)、Calcium signaling pathway(鈣信號通路)、Toll-like receptor signaling pathway(Toll樣受體信號通路)、NOD-like receptor signaling pathway(NOD樣受體信號通路)、cAMP signaling pathway(cAMP信號通路)等通路在SFI治療AMI過程中關(guān)聯(lián)密切,同時與Lipid and atherosclerosis(脂質(zhì)和動脈粥樣硬化)、Hepatitis B(乙型肝炎)、Influenza A(甲型流感)、Measles(麻疹)等疾病存在關(guān)系。此外,筆者根據(jù)圖4中IL-17信號通路預(yù)測,IL-17E生成因子可能通過上調(diào)或下調(diào)某些細胞分子,誘發(fā)細胞凋亡,在DNA中表達成th2相關(guān)細胞因子或趨化因子,從而誘導(dǎo)th2細胞反應(yīng)或抑制th17細胞反應(yīng),達到調(diào)控目的。
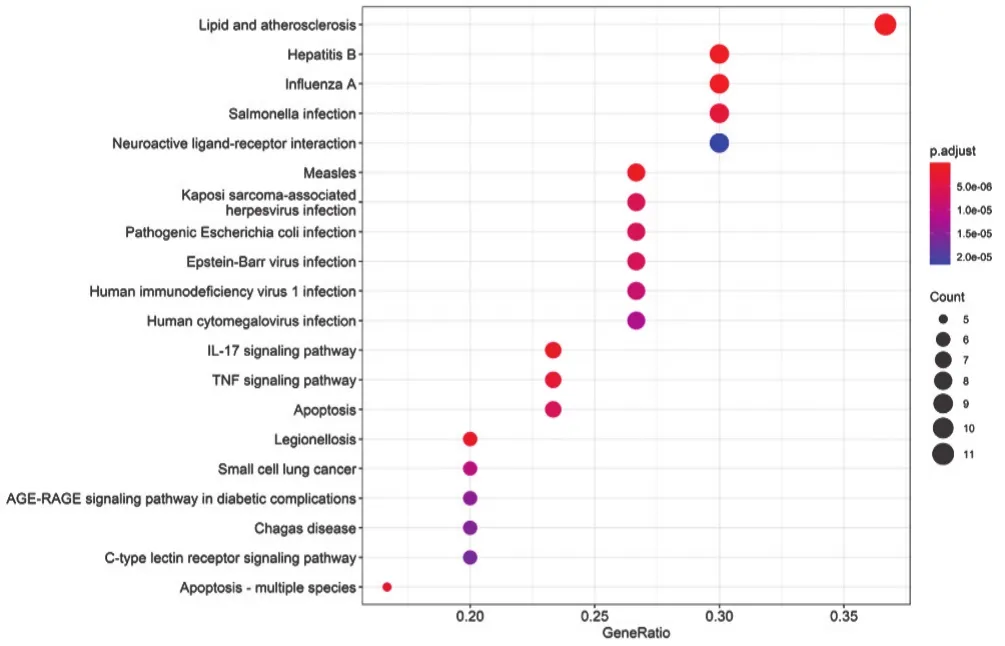
圖4 SFI-AMI的KEGG氣泡圖
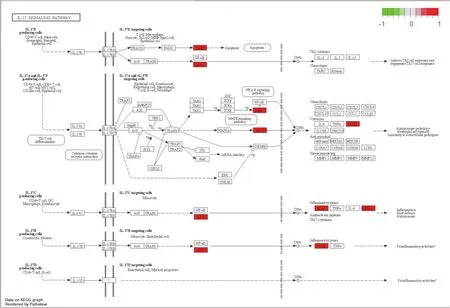
圖5 IL-17信號通路圖
3 討 論
對于AMI來說,粥樣硬化斑塊破裂或糜爛所致的急性血栓形成,是最常見的發(fā)病原因。易損斑塊主要以纖維帽較薄、脂核大、富含炎癥細胞和組織因子為形態(tài)學(xué)特點,斑塊破裂則與體內(nèi)的炎癥細胞、淋巴細胞分泌的蛋白酶相關(guān)。目前,多項研究表明,已知SFI中的有效成分對心肌細胞缺血缺氧具有保護機制[9-11]。本研究中筆者通過網(wǎng)絡(luò)藥理學(xué)的方法,檢索得到參附注射液的主要有效成分,如β-谷固醇、人參皂苷rh2、芥子堿、谷甾醇、羥乙炔等。其中,β-谷甾醇廣泛存在于天然植物中,通過對β-谷固醇酯化反應(yīng)獲得了4種新的衍生物,發(fā)現(xiàn)其衍生物可大大提高抗氧化酶的活性,降低了腫瘤壞死因子-α(TNF-α)、IL-1β和IL-6的水平,證實了其衍生物可對抗由TLR4和Nrf2途徑介導(dǎo)的LPS/GalN誘導(dǎo)的急性肝損傷,有抗干細胞損傷作用[12]。芥子堿不僅是一種非常有價值的天然抗氧化劑,還具有顯著的抗氧化、降血壓、抗炎等多種生物活性功能。筆者通過檢索相關(guān)中外文獻,發(fā)現(xiàn)人參皂苷rh2廣泛用于抗腫瘤、抗心肌缺血、調(diào)節(jié)免疫功能等方面。邵懇等通過對大鼠分組進行實驗,發(fā)現(xiàn)人參皂苷Rh2可改善高脂大鼠氧化應(yīng)激與炎癥水平,增加大鼠心肌缺血再灌注后外周血EPCs數(shù)量,從而保護受損心肌[13]。同時,筆者發(fā)現(xiàn)SFI可能通過關(guān)系較為緊密的JUN、CASP3、IL1B、CASP8、PTGS2等蛋白分子,達到治療AMI的療效。吳林慧等通過實驗表明,Casp3可促進Jun的表達,達到抑制腎癌細胞的增殖,加快癌細胞凋亡的作用[14]。Caspase-3是一種蛋白酶,一般認(rèn)為Caspase-3是細胞凋亡過程中最主要的終末剪切酶,也是CTL細胞殺傷機制的重要組成部分。Riedel等發(fā)現(xiàn)體內(nèi)尿酸對CASP3的不可逆轉(zhuǎn)抑制,可減少肝細胞凋亡[15]。CARD8和IL-1B多態(tài)應(yīng)激反應(yīng)可治療新生兒體溫過低的缺氧缺血性腦病[16]。此外,在GO功能富集分析上得出在SFI治療AMI中主要的蛋白活性受體,其中,G蛋白偶聯(lián)的胺受體活性具有自主神經(jīng)系統(tǒng)的調(diào)節(jié)的功能,在AMI發(fā)病過程中,心肌耗氧量的增加以及心肌氧釋放的減少,如心跳加速、疼痛、發(fā)熱、低血壓等,均會導(dǎo)致心絞痛惡化加重或心源性休克。Katie發(fā)現(xiàn)腎上腺G蛋白偶聯(lián)受體激酶2在心力衰竭中交感神經(jīng)系統(tǒng)中具有調(diào)節(jié)作用[17]。研究發(fā)現(xiàn),α7nACh受體激動劑可上調(diào)心肌細胞p-GSK-3βSer9蛋白表達,而p-NF-κB p65 Ser536蛋白表達下調(diào),具有降低GSK-3β活性抑制炎性反應(yīng),從而減輕大鼠心肌細胞缺氧復(fù)氧損傷[18]。
在KEGG的通路富集圖中筆者得到20條富集程度較高的通路。圖5顯示IL-17信號通路家族包含IL-17E、IL-17A、IL-17C等,此外,其受體家族包括IL-17RA、IL-17RB、IL-17RC等。2017年蘇靜麗等提出抑制IL-17可能是治療心肌缺血再灌注損傷的新型治療靶向通路[19]。而今,多項研究已證實,IL-17與多個器官缺血再灌注損傷的發(fā)病機制有關(guān),尤其在心肌再灌注損傷中具有很好的抗缺血作用。郭梅等采用IL-17A對小鼠冠脈進行實驗,發(fā)現(xiàn)不同濃度IL-17A能夠促進原代心肌細胞凋亡,誘導(dǎo)Caspase-3、Bax表達,抑制Bcl-2及PI3K/Akt通路蛋白表達,起到保護心肌細胞的作用[20]。另有研究發(fā)現(xiàn),心肌梗死后,IL-17A、IL-17F和IL-17受體的表達均升高,表明在心肌缺血再灌注損傷期間IL-17細胞因子及其受體的表達升高,IL-17可增強心肌梗死期間的心肌嗜中性粒細胞募集,促進梗死后的炎性反應(yīng)和凋亡反應(yīng)[21-22]。由此,筆者預(yù)測在治療AMI中,SFI可能靶向作用IL-17細胞因子或其家庭細胞因子,通過上調(diào)或下調(diào)作用誘發(fā)細胞凋亡,從而改善急性心肌梗死中心肌細胞的缺血缺氧。此外,筆者還發(fā)現(xiàn)TNF、C型凝集素受體及p53等信號通路與AMI、SFI同樣具有密切關(guān)聯(lián),值得深入探索。
綜上所述,SFI中的有效成分在治療AMI中起重要角色作用,可調(diào)節(jié)相關(guān)細胞因子,與抗缺血缺氧、抑制凋亡和炎癥反應(yīng)等多個靶向通路聯(lián)系密切。本研究為SFI治療AMI的進一步臨床試驗研究提供了網(wǎng)絡(luò)藥理學(xué)理論基礎(chǔ),但其具體靶向分子作用機制需進行深入研究。

