中介素通過激活AMPK信號通路對脂多糖誘導巨噬細胞極化的影響
王艷紅,田繼華,楊 佳,薛 媛,張婷婷,于培霞
(1.山西醫科大學微生物學與免疫學教研室,山西 晉中 030600;2.山西白求恩醫院檢驗科,山西醫學科學院,同濟山西醫院,山西醫科大學第三醫院,山西 太原 030032;3.華中科技大學同濟醫學院附屬同濟醫院,湖北 武漢 430030)
巨噬細胞是人體重要的固有免疫細胞之一,有高度異質性和可塑性,在不同微環境刺激下可極化為M1和M2型[1]。巨噬細胞極化對多種疾病的病理有重要影響。M1/M2型巨噬細胞比例失衡是許多炎癥性疾病的病理標志,如肥胖、動脈粥樣硬化等,并與腫瘤預測、轉移、預后有重要關系。因此,巨噬細胞M1/M2的動態平衡在維持內環境穩態中具有重要作用[1]。研究發現,巨噬細胞TLR2、TLR4活化后,M1型巨噬細胞占主導作用,其介導的炎癥反應在類風濕關節炎(rheumatiod arthritis,RA)等自身免疫病的發病過程中起決定性促進作用[2],而抑制M1型巨噬細胞的促炎效應則會恢復組織穩態,促進炎癥轉歸[3]。因此深入探索巨噬細胞極化所涉及的分子信號機制可能為臨床治療相關疾病提供新的治療靶點[3]。
腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是一種酶復合體,是重要的細胞代謝感受器,調節能量代謝,在炎癥反應中也起到調節作用[4],研究報道AMPK可促進抗炎性的M2巨噬細胞極化[5]。Wang等[6]用二甲雙胍治療癌癥時,激活AMPK途徑可以誘導巨噬細胞表型的轉化。中介素(intermedin,IMD)屬于降鈣素基因相關肽家族成員,是一種具有潛在器官保護作用的內源性多肽[7],大量研究表明IMD具有抗氧化、抑制炎癥、心臟保護,減輕急性腎損傷等作用。本研究組前期研究證實IMD能顯著減輕炎性反應,下調腫瘤壞死因子-α(tumor necrosis factor-alpha,TNF-α)、基質金屬蛋白酶(matrix metalloproteinase-9,MMP-9)等致炎因子的表達[8]。Chiang等[9]研究發現,IMD1-53通過激活AMPK途徑,增強血管生成并減輕心肌梗塞后的不良重塑;抑制內質網應激,從而防止心臟肥大;逆轉同型半胱氨酸血癥誘導的巨噬細胞M1/M2比例的失調,促進巨噬細胞由M1型向M2型轉化[10]。但其對巨噬細胞極化進程中涉及的具體分子機制鮮有報道。本研究通過采用脂多糖(lipopolysaccharide,LPS)刺激體外培養小鼠巨噬細胞系RAW 264.7,研究IMD對其炎癥分子的表達及極化表型的影響,以探討IMD調節巨噬細胞極化的機制。
1 材料與方法
1.1 材料小鼠巨噬細胞系RAW 264.7(上海細胞庫),IMD1-53(美國phoenix公司),LPS、Compound C(美國Sigma公司),兔抗TNF-α(ab183218)、IL-6(ab214429)和IL-10(ab189392)(美國Abcam公司),兔抗p-AMPK(2537)和AMPK(2532)(美國CST公司)。TNF-α、IL-6 ELISA試劑盒(美國Cusabio公司),APC-anti CD86(105011,美國Biolegend公司)。
1.2 細胞分組取傳代 3~4代的 RAW264.7細胞接種于6孔板,細胞隨機分為正常對照組、LPS處理組(1 mg·L-1LPS處理4 h),IMD+LPS處理組(預先用20 μg·L-1IMD處理巨噬細胞2 h,再加入1 mg·L-1LPS處理4 h),AMPK抑制劑Compound C組(LPS+IMD+CC):預先用AMPK抑制劑Compound C 1 μmol·L-1處理1 h,余同IMD+LPS組。
1.3 實驗方法
1.3.1Real time PCR檢測相關基因mRNA表達 TRIzol法提取總RNA,取1 μg反轉錄成cDNA,引物由上海生工生物工程有限公司合成,序列見Tab 1,按照SYBR Green PCR matter mix說明書進行realtime PCR檢測,反應條件為95 ℃,30 s預變性;5 ℃ 5 s,55 ℃ 30 s,72 ℃ 30 s 40個循環,數據按2-ΔΔCt的方法分析相對濃度。

Tab 1 Primer sequences
1.3.2Western blot檢測相關蛋白表達 裂解細胞提取胞質蛋白,采用BCA法檢測蛋白濃度,SDS-PAGE進行電泳分離,轉膜,封閉(5%脫脂奶粉)1 h。分別加入一抗TNF-α(1 ∶1 000)、IL-6(1 ∶2 000)、IL-10(1 ∶1 000)、p-AMPK(1 ∶1 000)和AMPK(1 ∶1 000)于4 ℃孵育過夜,TBST洗膜3次后加入羊抗兔抗體(1 ∶5 000)37 ℃孵育1 h,TBST洗膜后ECL化學發光法顯色,應用Quantity One分析蛋白的相對表達量。
1.3.3流式細胞術檢測巨噬細胞極化特征性分子 收集細胞,用4 ℃預冷的PBS清洗,4 ℃ 1 000 r·min-1離心 5 min,棄上清;加入100 μL染色緩沖液(1% BSA-PBS)中重懸,加入流式抗體APC-anti CD86,4 ℃避光孵育1 h,緩沖液洗滌3次,離心,500 μL染色緩沖液重懸細胞,上流式細胞儀檢測,實驗重復3次。
1.3.4ELISA 法測定IL-6、TNF-α濃度 收集細胞懸液,4 ℃ 2 000 r·min-1離心10 min,收集上清-20 ℃保存,IL-6、TNF-α按照試劑盒說明書測定。
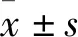
2 結果
2.1 IMD對AMPK信號通路的影響采用Western blot法檢測了p-AMPK及AMPK蛋白表達,結果如Fig 1所示。與對照組及LPS組比較,IMD處理組可見p-AMPK表達水平上調(P<0.01),且p-AMPK/AMPK比值也上調,提示IMD對AMPK通路有激活作用。

Fig 1 The protein levels of p-AMPK and AMPK in different groups determined by Western blot n=3)**P<0.01 vs control,##P<0.01 vs LPS,△△P<0.01 vs LPS+IMD
2.2 IMD對巨噬細胞M1/M2型標志因子mRNA表達的影響由Fig 2可見,LPS刺激RAW264.7細胞導致M1型標志分子CD86、TNF-α、iNOS mRNA表達升高,M2型標志分子CD206、Arg-1 mRNA表達降低,與對照組比較差異有統計學意義(P<0.05,P<0.01),結果表示LPS可誘導其向M1型極化;與LPS組比較,IMD處理可降低CD86、TNF-α、iNOS mRNA的表達,增加CD206、Arg-1 mRNA表達(P<0.05,P<0.01);而AMPK抑制劑Compound C處理可在一定程度上拮抗這一作用(P<0.05,P<0.01)。

Fig 2 The mRNA levels of M1/M2 in different groups determined by Real time PCR n=3)*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs LPS;△P<0.05,△△P<0.01 vs LPS+IMD
2.3 IMD對巨噬細胞M1/M2型標志因子蛋白表達的影響Western blot結果可見,LPS組促炎因子TNF-α、IL-6蛋白表達升高,而抗炎因子IL-10蛋白表達降低,與對照組比較差異有統計學意義(P<0.01);與LPS組比較,IMD處理可降低TNF-α、IL-6的表達,增加IL-10表達;而AMPK抑制劑Compound C處理可在一定程度上拮抗這一作用(P<0.01)。
2.4 IMD對M1型巨噬細胞比例的影響Fig 4的流式細胞術檢測結果顯示,與對照組相比,LPS組M1型細胞比例增加,差異有統計學意義(P<0.01);與LPS組相比,IMD處理組M1型細胞減少(P<0.01);與LPS+IMD組比較,AMPK抑制劑Compound C處理組M1型細胞增加(P<0.05),提示AMPK信號通路在IMD抑制LPS誘導的巨噬細胞M1極化過程中發揮一定作用。
2.5 巨噬細胞培養上清細胞因子的改變由Fig 5可見,ELISA法檢測巨噬細胞培養上清TNF-α、IL-6分泌情況,結果顯示,與對照組相比,LPS處理可導致TNF-α、IL-6分泌增加(P<0.01),經IMD處理后,細胞因子的分泌明顯減少(P<0.01),與IMD組相比,AMPK抑制劑Compound C處理組細胞上清液中TNF-α和IL-6的分泌量增加(P<0.05)。

Fig 3 The protein levels of TNF-α,IL-6 and IL-10 in different groups determined by Western blot n=3)**P<0.01 vs control;##P<0.01 vs LPS;△△P<0.01 vs LPS+IMD
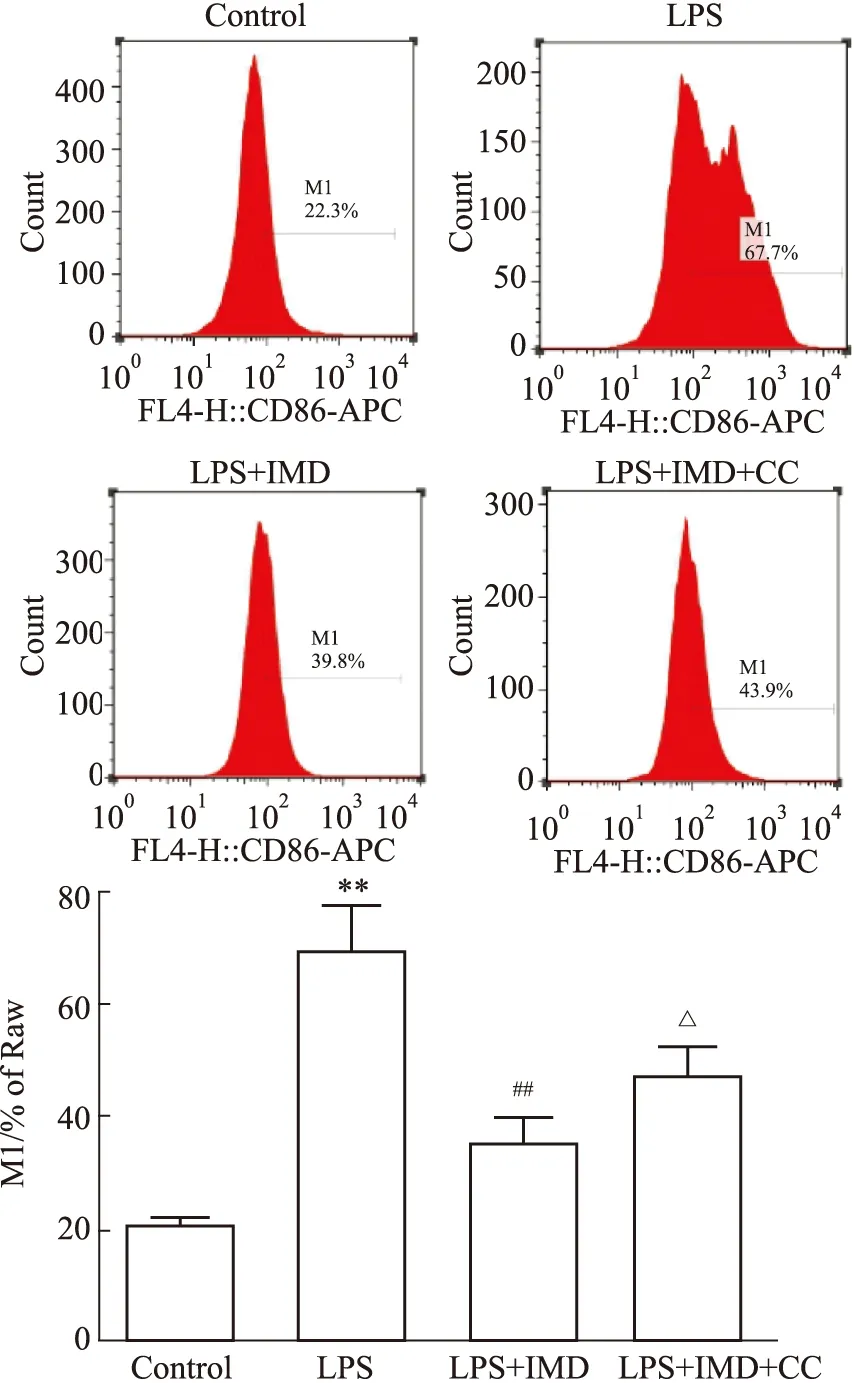
Fig 4 Proportion of M1 in RAW264.7 detected by flow cytometry n=3)**P<0.01 vs control;##P<0.01 vs LPS;△P<0.05 vs LPS+IMD

Fig 5 Secretion of TNF-α and IL-6 in different groups detected by ELISA n=3)**P<0.01 vs control;##P<0.01 vs LPS;△P<0.05 vs LPS+IMD
3 討論
大量的研究表明,單核細胞/巨噬細胞參與了炎癥性疾病如自身免疫病、超敏反應的發生和發展。巨噬細胞不僅能吞噬和殺滅病原微生物,還能生產多種促炎性細胞因子和趨化因子參與過敏性哮喘、RA、急性呼吸窘迫綜合征等炎癥性疾病的致病過程[1]。巨噬細胞極具異質性和可塑性,可因微環境不同而轉換為多種亞型。在LPS或干擾素(interferon,IFN-γ)等刺激下分化為M1型巨噬細胞,釋放白介素-1(interleukin-1,IL-1)、IL-6、TNF-α等促炎因子,誘導型一氧化氮合酶(induced nitric oxide synthase,iNOS)高表達,促進炎癥的發展;在IL-4、IL-13等信號刺激下可活化為M2型巨噬細胞,高表達精氨酸酶-1(arginase-1,Arg-1)、CD206、YM-1,分泌IL-10等抗炎因子,具有抗炎、促組織修復的作用[10-12]。RA患者的滑膜巨噬細胞呈M1促炎性極化表型,滑液巨噬細胞M1/M2比例顯著升高,以M1型巨噬細胞占優勢[13]。活化的M1巨噬細胞表現出促炎活性,并導致多種炎癥性疾病,如微生物感染、敗血癥、自身免疫性疾病和心臟代謝疾病[14],巨噬細胞 M1/M2極化在多種疾病如腫瘤、炎癥、腦卒中、心血管疾病等的發病及進展中都至關重要,通過調節M1/M2型巨噬細胞極化可有效控制相關疾病發生發展,改善其預后[1]。
IMD是重要的心、腎、神經、內分泌調節肽,參與多種器官生理、病理過程[6-7],Pang等[10]研究發現,IMD可逆轉同型半胱氨酸血癥(Hcy)誘導的巨噬細胞M1/M2比例的失調,促進巨噬細胞由M1型向M2型轉化。本研究采用體外培養小鼠RAW264.7巨噬細胞,通過LPS誘導模擬巨噬細胞受到的炎性刺激,結果顯示,LPS可誘導RAW264.7細胞朝M1型分化,上調細胞因子TNF-α,IL-6的表達,增加M1型巨噬細胞數量;而IMD處理可減少細胞上清液中炎癥因子TNF-α和IL-6的分泌,下調M1型巨噬細胞標志分子CD86、TNF-α、iNOS的表達,使M2型巨噬細胞標志分子CD206、Arg-1、IL-10表達上調,同時減少M1型巨噬細胞比例,進一步證實了IMD可以抑制LPS誘導的RAW264.7細胞M1型極化,調控巨噬細胞極化進程。
AMPK是參與細胞能量代謝調節的關鍵激酶,AMPK激活后通過抑制糖酵解、促進氧化磷酸化,改變炎癥細胞抗炎表型,對炎癥發揮抑制作用。AMPK激活抑制LPS刺激的巨噬細胞,脂肪細胞和系膜細胞促炎細胞因子表達[15-16],近年來研究顯示,在LPS誘導的急性肺損傷小鼠模型中AMPK通路參與了M2型巨噬細胞的活性,并減輕了LPS 誘導的炎癥反應和肺損傷,而AMPK-/-巨噬細胞不能被誘導活化為M2型巨噬細胞[17]。在造血干細胞中抑制AMPK信號通路可促進M1型巨噬細胞活化,抑制M2型巨噬細胞活化[18]。本實驗研究結果也證實,LPS作用巨噬細胞RAW264.7后,p-AMPK蛋白水平下降,而IMD處理后可增加p-AMPK蛋白水平。我們采用Compound C阻斷AMPK活性,抑制AMPK信號通路會導致RAW264.7細胞炎癥因子TNF-α和IL-6表達量升高并增強了LPS的作用。結果提示IMD可以上調p-AMPK表達,激活AMPK信號通路,減少LPS導致的RAW264.7細胞M1型極化。IMD通過與降鈣素受體樣受體/受體活化修飾蛋白復合物共同受體(calcitonin receptor-like receptor/receptor activity modifying protein receptor complexes,CRLR/RAMPs)結合增加細胞內cAMP產生,進而激活AMPK信號通路[10],但其具體調控機制需要進一步深入研究。
綜上所述,本研究證實IMD可能通過激活AMPK信號通路,抑制LPS誘導的RAW264.7細胞的M1型極化及炎癥因子TNF-α和IL-6的表達,以上研究為IMD通過調節巨噬細胞極化,參與巨噬細胞極化失衡導致的相關免疫炎癥性疾病的診斷和治療提供了新的思路。

