新型磷酸二酯酶4抑制劑ZL-n-91對骨肉瘤U2OS細胞增殖的抑制作用
許麗君,王學鵬,林偉杰,梁龍銘,赫玉杰,趙正剛,李芳紅,周素瑾,趙子建
(廣東工業大學生物醫藥學院,廣東 廣州 510006)
骨肉瘤(osteosarcoma,OS)是兒童和青少年最常見的原發性惡性骨腫瘤,目前轉移性骨肉瘤患者5年生存率僅為20%[1-2]。骨肉瘤的治療模式是術前新輔助化療+手術切除+術后輔助化療,化療藥物包括順鉑、阿霉素、甲氨蝶呤、異環磷酰胺等,但這些化療藥物副作用明顯,且易產生耐藥性。因此,開發新的藥物治療骨肉瘤迫在眉睫。
磷酸二酯酶4(phosphodiesterase 4,PDE4)能夠特異性水解環磷酸腺苷(cyclic adenosine monophosphate,cAMP)[3]。研究發現骨肉瘤細胞MG-63含有較高的PDE4活性[4],并且用PDE4抑制劑咯利普蘭處理可導致骨肉瘤細胞Saos-2內cAMP積累[5]。全基因組關聯研究(Genome-Wide Association Studies,GWAS)研究提示cAMP水平降低與骨肉瘤的發生發展密切相關[6]。因此,PDE4有可能成為治療骨肉瘤的一個潛在靶點。多年來的研究證實PDE4抑制劑具有很好的抗腫瘤作用[7],但其劑量依賴性的胃腸道不良反應如惡心、嘔吐等嚴重阻礙了此類藥物的開發應用,這也成為當前開發新型PDE4抑制劑的難點。ZL-n-91,又稱羅氟普蘭,作為一種新型的高選擇性PDE4抑制劑,其抑制PDE4D4和PDE4D5的IC50分別是11.8 nmol·L-1和19.2 nmol·L-1,相對于其他PDE家族有至少5 000倍的選擇性,并且通過比格犬灌胃給藥的方式驗證了ZL-n-91相對于咯利普蘭具有極低甚至可能不具有致嘔吐的潛能[8],因此,ZL-n-91可能成為具有臨床應用價值的新一代PDE4抑制劑。本課題前期研究發現,ZL-n-91能夠抑制前列腺癌細胞PC-3的增殖[9],但ZL-n-91對于骨肉瘤的療效尚鮮見報道。本研究旨在研究ZL-n-91對骨肉瘤細胞增殖、凋亡及細胞周期的影響,以期為骨肉瘤的靶向治療找到新的突破口。
1 材料與方法
1.1 材料
1.1.1細胞株 人骨肉瘤細胞系U2OS,購自中國科學院典型培養物保藏委員會細胞庫。
1.1.2藥物與試劑 ZL-n-91由藥明康德公司合成,以無水乙醇(EtOH)溶解至相應濃度;胰蛋白酶和胎牛血清(FBS)購自美國Gibco公司;McCOY′s 5A培養基購自美國Sigma公司;CCK-8試劑盒(Cell Counting Kit-8,批號:G909FA003)購自上海生工生物工程公司;碘化丙啶(PI,批號:90395858)和PE Annexin V/7AAD試劑盒(批號:9074586)購自美國BD Bioscience公司。BCA蛋白定量試劑盒、ECL發光液購自Thermo Fisher公司;Bcl-2抗體購自英國Abcam公司;CDK2、CDK4、CyclinD1、CyclinE1抗體購自美國CST公司,β-actin、GADPH購自美國Sigma公司;辣根過氧化物酶標記山羊抗兔IgG、HPR標記的山羊抗兔二抗購自上海碧云天生物公司。
1.2 儀器AC2-4S1型二級生物安全柜(ESCO,新加坡);CLM-170B-8-NF型二氧化碳培養箱(ESCO,新加坡);TDZ5-WS型多管架自動平衡離心機(上海盧湘儀離心機儀器有限公司);流式細胞儀(DXP AthenaTM,美國);ChemiDoc+XRS化學發光凝膠成像系統(Bio-Rad,美國);Leica倒置顯微鏡(Leic,德國);CMAXPLUS+酶標儀(美國)。
1.3 方法
1.3.1細胞培養 人骨肉瘤細胞系U2OS細胞采用含10%胎牛血清的McCOY′s 5A培養基,均置于37 ℃、5% CO2細胞培養箱中常規培養,每隔2~3 d傳代1次。所有實驗均采用處于對數生長期的細胞進行。
1.3.2CCK8法檢測細胞增殖抑制 將U2OS細胞以2×103個/孔接種于96孔板,待細胞貼壁后加入不同濃度(0、20、40、80、160、240、320、400、480 μmol·L-1)的ZL-n-91分別處理并培養48 h。每孔加入CCK-8 溶液10 μL,孵育1~2 h,酶標儀檢測450 nm處的吸光度(OD)值。計算ZL-n-91在U2OS細胞中的半數抑制濃度和細胞增殖抑制率/%=(對照孔OD值-實驗孔OD值)/(對照孔OD值-空白孔OD值)×100%。之后細胞設空白對照組(Control組)、溶劑對照組(EtOH組)和ZL-n-91處理組(200 μmol·L-1),每組均設3個復孔。梯度培養0、24、48、72、96 h后檢測各組細胞450 nm處OD值。
1.3.3平板克隆形成實驗檢測U2OS細胞生長情況 取對數生長期細胞以每孔1 000個接種于6孔板中,待細胞貼壁后加入藥物處理。實驗共設計3組(EtOH組、50、100 μmol·L-1ZL-n-91處理組)。12 d后出現肉眼可見的細胞克隆即終止培養,以多聚甲醛溶液固定細胞,進行結晶紫染色,經PBS洗滌后,將≥50個細胞克隆團記為1個細胞克隆,觀察計數各組細胞克隆形成數目,結果以細胞克隆形成數目表示。
1.3.4流式細胞術檢測細胞凋亡 取對數生長期細胞以1.5×105個/孔接種于6孔板,饑餓處理24 h后加入藥物處理。實驗共設計4組(EtOH組,100、200、300 μmol·L-1ZL-n-91處理組)。藥物處理48 h后,收集細胞,PBS洗滌2次后用0.25%胰蛋白酶消化,離心收集細胞。按照凋亡檢測試劑盒說明書進行Annexin V-PE、7AAD染色,隨后上機檢測細胞凋亡情況。
1.3.5流式細胞術檢測細胞周期 取對數生長期U2OS細胞以1.5×105個/孔接種于6孔板,饑餓處理24 h后加入藥物處理。實驗共設計2組(EtOH組、200 μmol·L-1ZL-n-91處理組)。藥物處理48 h后,PBS洗滌2次后用0.25%胰蛋白酶消化,離心收集細胞,PBS洗滌離心后,加入1 mL 70%的預冷乙醇,置于-20 ℃固定24 h以上。按照試劑盒說明書進行PI染色,隨后上機檢測細胞周期分布。
1.3.6蛋白免疫印跡實驗檢測凋亡及周期蛋白表達 實驗共設計4組(EtOH組,100、200、300 μmol·L-1ZL-n-91處理組),藥物處理48 h后,胰酶消化收集細胞,RIPA裂解細胞,超聲破碎后12 000 r·min-1離心20 min。取上清,采用BCA法進行測定蛋白濃度。定量后用12%SDS-PAGE凝膠對蛋白進行電泳分離,濕法轉印至PVDF膜,5%牛奶封閉1 h,加入稀釋后的一抗于4 ℃孵育過夜,次日TBST洗膜3次,加入辣根過氧化物酶標記的二抗(1 ∶5 000),搖床室溫孵育1 h,TBST洗膜3次后ECL化學發光顯色,并應用ImageJ軟件分析目標蛋白和內參蛋白灰度值,相對表達量=目的蛋白灰度值/內參灰度值。
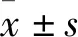
2 結果
2.1 ZL-n-91抑制U2OS細胞增殖如Fig 1所示,CCK-8結果顯示ZL-n-91顯著抑制U2OS細胞的增殖,且隨著濃度增高,ZL-n-91抑制能力增強,其IC50為174.1 μmol·L-1(Fig 1A)。與Control組和EtOH組相比,ZL-n-91(200 μmol·L-1)處理24 h開始,細胞增殖受到明顯抑制(P<0.05)(Fig 1B)。與對照組相比,ZL-n-91對U2OS細胞增殖具有明顯的抑制作用,且呈現劑量和時間依賴性。
2.2 ZL-n-91對U2OS細胞克隆形成能力的影響如Fig 2所示,當不同濃度ZL-n-91分別作用于U2OS細胞后,與EtOH組相比,50、100 μmol·L-1ZL-n-91處理組的細胞克隆形成數目明顯降低(P<0.01)。結果表明ZL-n-91可抑制U2OS細胞的克隆形成能力。
2.3 ZL-n-91處理后U2OS細胞周期變化如Fig 3所示,流式細胞術結果表明,與EtOH組相比,ZL-n-91(200 μmol·L-1)處理48 h后,U2OS細胞的細胞周期G2/M期比例降低(P<0.01),G0/G1期細胞比例明顯升高(P<0.01)。結果表明ZL-n-91可將U2OS細胞阻滯在G0/G1期。

Fig 1 Effect of ZL-n-91 on proliferation of U2OS cells n=3)*P<0.05 vs Control,#P<0.05 vs EtOH

Fig 2 Effect of ZL-n-91 on colony formation of U2OS cells n=3)**P<0.01 vs EtOH
2.4 ZL-n-91處理后U2OS細胞凋亡變化如Fig 4所示,流式細胞術結果表明,隨著ZL-n-91濃度的增加,其誘導細胞凋亡的作用呈劑量依賴性增高。其中,經300 μmol·L-1ZL-n-91處理后,細胞凋亡比例明顯增加(P<0.01)。結果表明ZL-n-91可促使U2OS細胞發生凋亡。
2.5 Western blot 檢測ZL-n-91對U2OS細胞周期蛋白CDK2、CDK4、CyclinD1、CyclinE1表達的影響如Fig 5所示,不同濃度的ZL-n-91處理U2OS細胞48 h后,與EtOH組相比,CDK2、CDK4、CyclinD1、CyclinE1的表達水平逐漸降低(P<0.05)。結果進一步證明ZL-n-91導致U2OS細胞阻滯在G0/G1期。
2.6 Western blot 檢測ZL-n-91對U2OS細胞抗凋亡蛋白Bcl-2表達的影響如Fig 6所示,不同濃度的ZL-n-91處理U2OS細胞48 h后,與EtOH組相比,300 μmol·L-1處理可明顯降低Bcl-2的蛋白表達(P<0.01)。結果進一步證明ZL-n-91可誘導U2OS細胞凋亡。

Fig 3 Effect of ZL-n-91 on cell cycle distribution of U2OS cells n=3)

Fig 4 Effect of ZL-n-91 on apoptosis of U2OS cells n=3)**P<0.01 vs EtOH

Fig 5 Effect of ZL-n-91 on expression of CDK2,CDK4,CyclinD1,CyclinE1 protein in U2OS n=3)*P<0.05 vs EtOH ,**P<0.01 vs EtOH

Fig 6 Effect of ZL-n-91 on expression of Bcl-2 protein in U2OS cells n=3)**P<0.01 vs EtOH
3 討論
骨肉瘤惡性程度高,預后差,早期即能發生局部及遠處轉移,嚴重影響青少年的健康。盡管當前外科截肢手術及化療藥物不斷發展,骨肉瘤患者的5年生存率得以明顯提高,但高劑量的化療藥物不良反應嚴重[10],因此尋找新型高選擇性的靶向治療藥物極為重要。本研究通過體外實驗證實新型PDE4抑制劑ZL-n-91可導致骨肉瘤U2OS細胞周期阻滯并促進細胞凋亡,顯著抑制細胞增殖,為臨床治療骨肉瘤提供新的思路。
ZL-n-91作為新型PDE4抑制劑,選擇性高,副作用低,其在急性肺損傷[11]、帕金森疾病[12]、慢性阻塞性肺疾病[13]、前列腺癌[9]等疾病的治療中都取得了很好的療效。基于前期研究表明骨肉瘤細胞中高表達PDE4,提示PDE4有可能成為治療骨肉瘤的一個潛在靶點,通過PDE4抑制劑有望治療骨肉瘤。本研究選用新型的PDE4抑制劑ZL-n-91,觀察其對骨肉瘤細胞的抑制作用。結果發現ZL-n-91可以以劑量依賴性抑制骨肉瘤細胞U2OS的增殖,顯著抑制U2OS細胞的克隆形成能力。
癌癥的發生發展與不受控制的細胞增殖有關,大多數化療藥物主要是通過調控腫瘤細胞的周期進程來抑制細胞的快速增殖而達到抗腫瘤的效果。本研究發現ZL-n-91可使U2OS細胞阻滯在G0/G1期,這與PDE4抑制劑羅氟司特誘導卵巢癌OVCAR3細胞和SKOV3細胞G0/G1期周期阻滯[14]的研究結果相一致。CDK2-cyclinE1和CDK4/6-cyclinD1兩種細胞周期激酶復合體是啟動細胞周期從G1期到S期順利轉換的關鍵調節因子[15]。本研究發現ZL-n-91顯著下調骨肉瘤U2OS細胞中周期相關蛋白CDK2、CDK4、CyclinD1、CyclinE1的表達,表明ZL-n-91可以通過調節細胞周期相關蛋白的表達,誘導骨肉瘤U2OS細胞阻滯在G0/G1期。
細胞周期阻滯能夠使細胞進行自我介導的DNA修復或者細胞凋亡[16]。本研究發現ZL-n-91顯著誘導骨肉瘤U2OS細胞發生凋亡。Bcl-2是一種抗凋亡蛋白,通過控制線粒體膜通透性來調節細胞凋亡[17]。本研究觀察到ZL-n-91處理后,U2OS細胞中Bcl-2的表達顯著下調。因此ZL-n-91可通過下調抗凋亡蛋白Bcl-2觸發線粒體途徑介導的細胞凋亡。
綜上所述,新型的PDE4抑制劑ZL-n-91可抑制骨肉瘤U2OS細胞的增殖,誘導細胞凋亡和細胞周期阻滯,為研發抗骨肉瘤新藥提供了一定的理論基礎。

