分泌型叢生蛋白通過抑制線粒體自噬緩解H2O2誘導的心肌細胞損傷
賀靜,孫曉慧△,楊莉,烏宇亮
活性氧(reactive oxygen species,ROS)在氧化應激條件下可在心肌細胞內過量聚集而引起細胞毒性,造成心肌細胞的凋亡和功能失調[1]。叢生蛋白(clusterin,CLU)是一種多功能伴侶蛋白,可分為分泌型和核型。其與氧化還原反應關系密切,是氧化應激反應的感受器,可保護細胞抵抗應激反應。研究顯示,CLU可以通過抑制線粒體片段化進而抑制缺血、缺氧條件下的視網膜血管內皮細胞凋亡,從而保護內皮細胞[2]。在心肌梗死患者血清中,分泌型CLU(secretory clusterin,sCLU)水平顯著升高[3-4]。然而,sCLU對心肌細胞氧化應激損傷的作用尚不清楚。本研究擬探討sCLU對氧化應激條件下心肌細胞損傷的作用及其可能的作用機制,以期為心肌氧化應激損傷的治療提供新思路。
1 材料與方法
1.1 主要材料與試劑 大鼠心肌細胞H9C2購自中科院上海細胞庫。DMEM培養基購自美國Gibco公司。胎牛血清購自浙江天杭生物科技股份有限公司。MTT試劑盒、磷酸鹽緩沖溶液(phosphate buffered solution,PBS)購自武漢博士德生物工程有限公司。H2O2購自國藥集團化學試劑有限公司。大鼠sCLU酶聯免疫吸附試驗(enzyme-linked immunosorbent assay,ELISA)試劑盒購自上海酶聯生物科技有限公司。丙二醛(malonaldehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)測定試劑盒購自南京建成生物工程研究所有限公司。Trizol試劑盒、反轉錄試劑盒購自寶日醫生物技術(北京)有限公司。實時熒光定量聚合酶鏈式反應(qPCR)引物由生工生物工程(上海)股份有限公司合成。SuperReal PreMix Plus(SYBR Green)購自天根生化科技(北京)有限公司。ECL化學發光試劑盒、RIPA裂解液、聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)蛋白濃度測定試劑盒、DCFH-DA熒光探針、原位末端轉移酶標記(TUNEL)細胞凋亡檢測試劑盒購自上海碧云天生物技術有限公司。脂質體LipofetamineTM2000購自美國Invitrogen公司。線粒體自噬抑制劑Mdivi-1購自美國Sigma公司。sCLU過表達載體pcDNA3.1-sCLU由廣州銳博生物科技有限公司合成。兔抗大鼠CLU單克隆抗體、兔抗大鼠磷酸酶及張力蛋白同源物誘導的蛋白激酶1(PTEN induced putative kinase 1,PINK1)、小鼠抗大鼠Parkin單克隆抗體、兔抗大鼠微管相關蛋白1輕鏈3(microtubule-associated protein 1 light chain 3,LC3)單克隆抗體、兔抗大鼠甘油醛-3-磷酸脫氫酶(GAPDH)單克隆抗體、辣根過氧化物酶(horseradish peroxidase,HRP)標記的山羊抗兔免疫球蛋白G(IgG)、HRP標記的山羊抗小鼠IgG購自英國Abcam公司。
1.2 研究方法
1.2.1 H9C2細胞的培養及分組 采用快速融化法[5]復蘇H9C2細胞,用含10%胎牛血清、1×105U/L青霉素、100 g/L鏈霉素的DMEM培養基,置于37℃、5%CO2培養箱中常規培養。每2~3 d傳代1次,選取對數生長期的心肌細胞備用。實驗分3個部分。(1)實驗1。對數生長期的心肌細胞分為Control組(僅更換培養基)和H2O2組(100μmol/L H2O2處理)。(2)實驗2。對數生長期的心肌細胞分為Control組(僅更換培養基)、pcDNA3.1組(轉染pcDNA3.1對照空質粒)、pcDNA3.1-sCLU組(轉染pcDNA3.1-sCLU過表達質粒)、H2O2組(100μmol/L H2O2處理)、H2O2+pcDNA3.1組(pcDNA3.1對照空質粒轉染48 h后加入100μmol/L H2O2處理)、H2O2+pcDNA3.1-sCLU組(pcDNA3.1-sCLU過表達質粒轉染48 h后加入100μmol/L H2O2處理)。(3)實驗3。對數生長期的心肌細胞分為DMSO組(加入1%體積分數的DMSO)、Mdivi-1組(10μmol/L的Mdivi-1處理)、H2O2+DMSO組(加入1%體積分數的DMSO處理30 min后加入100μmol/L的H2O2處理)、H2O2+Mdivi-1組(10μmol/L的Mdivi-1處理30 min后加入100μmol/L的H2O2處 理)、H2O2+pcDNA3.1-sCLU組(pcDNA3.1-sCLU過表達質粒轉染48 h后加入100μmol/L H2O2處理)、H2O2+pcDNA3.1-sCLU+Mdivi-1組(pcDNA3.1-sCLU過表達質粒轉染48 h后加入10μmol/L的Mdivi-1處理30 min,再加入100μmol/L H2O2處理)。
1.2.2 qPCR檢測細胞中sCLUmRNA表達水平 收集1.2.1分組中實驗1各組細胞,采用Trizol試劑提取各組細胞總RNA,檢測RNA純度和濃度。采用反轉錄反應試劑盒合成cDNA。反應總體積20μL:SuperReal PreMix Plus 10μL,上、下游引物各0.8μL,cDNA模板2μL,ROX Reference Dye 0.4μL,無RNA酶雙蒸水6μL。反應條件:95℃15 min;95℃10 s,60℃30 s,40個循環。sCLU引物:上游5′-TGCCTCTCTCCCACTACGG-3′,下 游5′-CTCCTTGCACACT?GTCGGG-3′;GAPDH引物:上游5′-GGAGAGTGTTTCCTC?GTCCC-3′,下游5′-ACTGTGCCGTTGAATTTGCC-3′。采用2-ΔΔCt法計算目的基因的相對表達量。
1.2.3 ELISA檢測培養液上清液中sCLU蛋白含量 收集1.2.1分組中實驗1各組細胞培養液上清液,采用ELISA試劑盒檢測培養上清中sCLU的含量。將100μL的各處理組細胞培養上清液加入酶標板,37℃孵育2 h。棄上清液后加入100μL sCLU抗體工作液孵育1 h。洗滌3次加入100μL親和鏈霉素-HRP孵育30 min,TMB顯影液顯影。在450 nm波長處檢測樣品吸光度(A)值。根據標準品繪制標準曲線并計算樣品濃度。
1.2.4 Western blot檢測細胞中CLU、PINK1、Parkin、LC3蛋白表達 收集1.2.1分組中實驗1、實驗2各組細胞。采用0.05%胰蛋白酶消化,PBS洗滌3次;加入450μL RIPA蛋白裂解液裂解細胞,提取細胞總蛋白。采用BCA蛋白濃度測定試劑盒檢測蛋白濃度。各組分別取30μg蛋白上樣,SDS-PAGE蛋白電泳;電泳結束后將蛋白轉移到硝酸纖維素膜上,用5%脫脂奶粉封閉,按照常規的方法加入CLU、PINK1、Parkin、LC3、GAPDH抗體(均1∶1 000稀釋),4℃孵育過夜;TBST緩沖液洗膜3次;加入HRP標記的羊抗兔IgG(1∶5 000),室溫孵育2 h;TBST緩沖液洗滌;采用ECL化學發光試劑盒顯色。Image J 1.8.0圖像分析系統分析灰度值,計算目的蛋白相對表達水平。
1.2.5 MTT法檢測細胞活力 將1.2.1分組中實驗2、實驗3各組細胞接種于96孔板,每孔200μL,含2×104個細胞,每組設3個復孔。每孔加入MTT溶液(5 g/L)10μL,孵育4 h,棄上清液,按每孔100μL加入二甲基亞砜(DMSO),震蕩10 min,酶標儀490 nm處讀取A值,設對照組細胞活力為100%,計算其余各處理組細胞活力。處理組細胞活力=(處理組A值/對照組A值)×100%。
1.2.6 TUNEL試劑盒檢測細胞凋亡 將1.2.1分組中實驗2、實驗3各組細胞接種于6孔板中,4%多聚甲醛固定25 min,PBS洗滌2次,0.2%的TritonX-100處理5 min,漂洗2次,加入50μL TUNEL反應混合液,37℃避光孵育1 h。漂洗后加入DAPI染核,抗熒光淬滅封片液封片后,熒光顯微鏡(×200)下觀察(激發波長550 nm)各組細胞紅色熒光陽性細胞所占比例,即為細胞凋亡率。
1.2.7 MDA和SOD水平檢測 將1.2.1分組中實驗2各組細胞接種于6孔板中,培養結束后收集各組細胞的上清液,依據試劑盒說明書,檢測各組細胞中MDA和SOD水平。
1.2.8 DFCH-DA熒光探針測定細胞ROS水平 將1.2.1分組中實驗2各組細胞接種于6孔板中,用血清將DCFH-DA按照1∶1 000稀釋制備試劑,加入6孔板中,每孔1 mL,37℃培養箱中孵育30 min。吸掉培養液,無血清DMEM洗滌3次。收集細胞,熒光顯微鏡(×200)下觀察(激發波長488 nm)各組細胞的熒光強度。ROS水平以相對于Control組的相對熒光強度表示。
1.3 統計學方法 采用GraphPad 7.0軟件進行數據分析。符合正態分布的計量資料以均數±標準差(±s)表示,2組間均數比較采用t檢驗;多組間比較采用單因素方差分析,組間多重比較采用Tukey檢驗(方差齊)或Dunnett’s T3法檢驗(方差不齊)。以P<0.05為差異有統計學意義。
2 結果
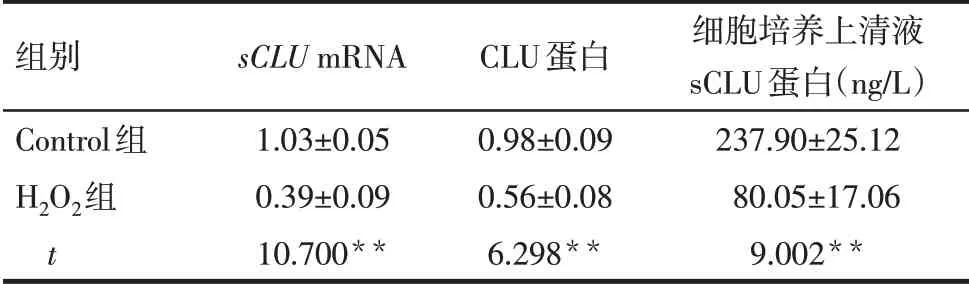
2.1 實驗1 與Control組比較,H2O2組細胞中sCLUmRNA、細胞培養上清液中sCLU蛋白及細胞中CLU蛋白表達水平均降低(P<0.01),見表1、圖1。
Tab.1 Comparison of the relative mRNA and protein levels of CLU in cells,and the protein levels of sCLU in the medium of H9C2 cells between the control group and the H 2O2 group表1 Control組和H 2O2組細胞中sCLU mRNA和蛋白相對表達水平、細胞培養上清液中sCLU蛋白水平的比較(n=3,±s)
Tab.1 Comparison of the relative mRNA and protein levels of CLU in cells,and the protein levels of sCLU in the medium of H9C2 cells between the control group and the H 2O2 group表1 Control組和H 2O2組細胞中sCLU mRNA和蛋白相對表達水平、細胞培養上清液中sCLU蛋白水平的比較(n=3,±s)
**P<0.01。
組別Control組H2O2組t sCLU mRNA 1.03±0.05 0.39±0.09 10.700**CLU蛋白0.98±0.09 0.56±0.08 6.298**細胞培養上清液sCLU蛋白(ng/L)237.90±25.12 80.05±17.06 9.002**
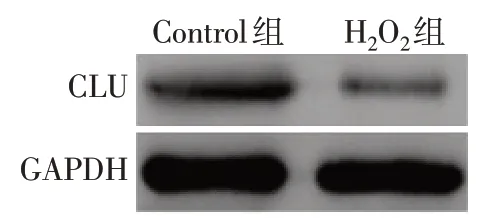
Fig.1 Comparison of the protein levels of CLU between the control group and the H2O2 group圖1 Control組和H2O2組細胞中CLU蛋白表達水平的比較
2.2 實驗2
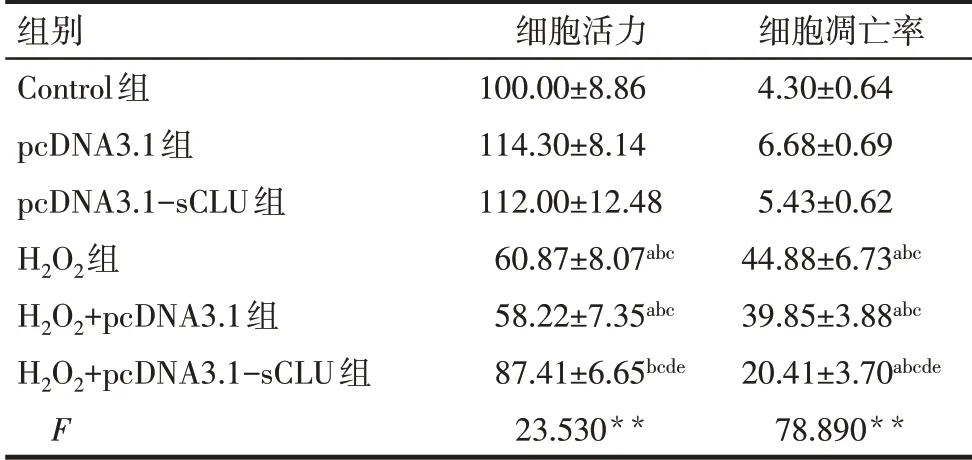
2.2.1 各組細胞活力和凋亡水平比較 與Control組比較,pcDNA3.1組和pcDNA3.1-sCLU組細胞活力及細胞凋亡率差異均無統計學意義,H2O2組、H2O2+pcDNA3.1組細胞活力降低,細胞凋亡率升高(P<0.05),H2O2+pcDNA3.1-sCLU組細胞凋亡率升高(P<0.05),但細胞活力差異無統計學意義。與H2O2組比較,H2O2+pcDNA3.1組細胞活力及細胞凋亡率差異均無統計學意義,H2O2+pcDNA3.1-sCLU組細胞活力升高,細胞凋亡率下降(P<0.05),見表2、圖2。
2.2.2 各組細胞ROS、MDA和SOD水平的比較 與Control組比較,pcDNA3.1組和pcDNA3.1-sCLU組細胞ROS、MDA和SOD水平差異均無統計學意義,H2O2組、H2O2+pcDNA3.1組、H2O2+pcDNA3.1-sCLU組ROS、MDA水平均升高,SOD水平均降低(P<0.05)。與H2O2組比較,H2O2+pcDNA3.1組細胞ROS、MDA和SOD水平差異均無統計學意義,H2O2+pcDNA3.1-sCLU組ROS和MDA水平均降低(P<0.05),SOD水平升高(P<0.05),見圖3、表3。
Tab.2 Comparison of the viability and apoptosis levels between the six groups of cells表2 各組細胞活力和凋亡率的比較(n=3,%,±s)
Tab.2 Comparison of the viability and apoptosis levels between the six groups of cells表2 各組細胞活力和凋亡率的比較(n=3,%,±s)
**P<0.01;a與Control組比 較,b與pcDNA3.1組比 較,c與pcDNA3.1-sCLU組比較,d與H2O2組比較,e與H2O2+pcDNA3.1組比較,P<0.05。
組別Control組pcDNA3.1組pcDNA3.1-sCLU組H2O2組H2O2+pcDNA3.1組H2O2+pcDNA3.1-sCLU組F細胞活力100.00±8.86 114.30±8.14 112.00±12.48 60.87±8.07abc 58.22±7.35abc 87.41±6.65bcde 23.530**細胞凋亡率4.30±0.64 6.68±0.69 5.43±0.62 44.88±6.73abc 39.85±3.88abc 20.41±3.70abcde 78.890**
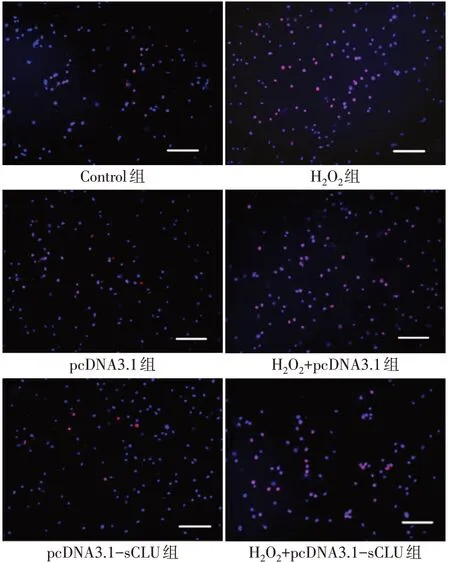
Fig.2 Comparison of the apoptosis levels between the six groups(Bar=100μm)圖2 各組細胞凋亡水平的比較(標志線=100μm)
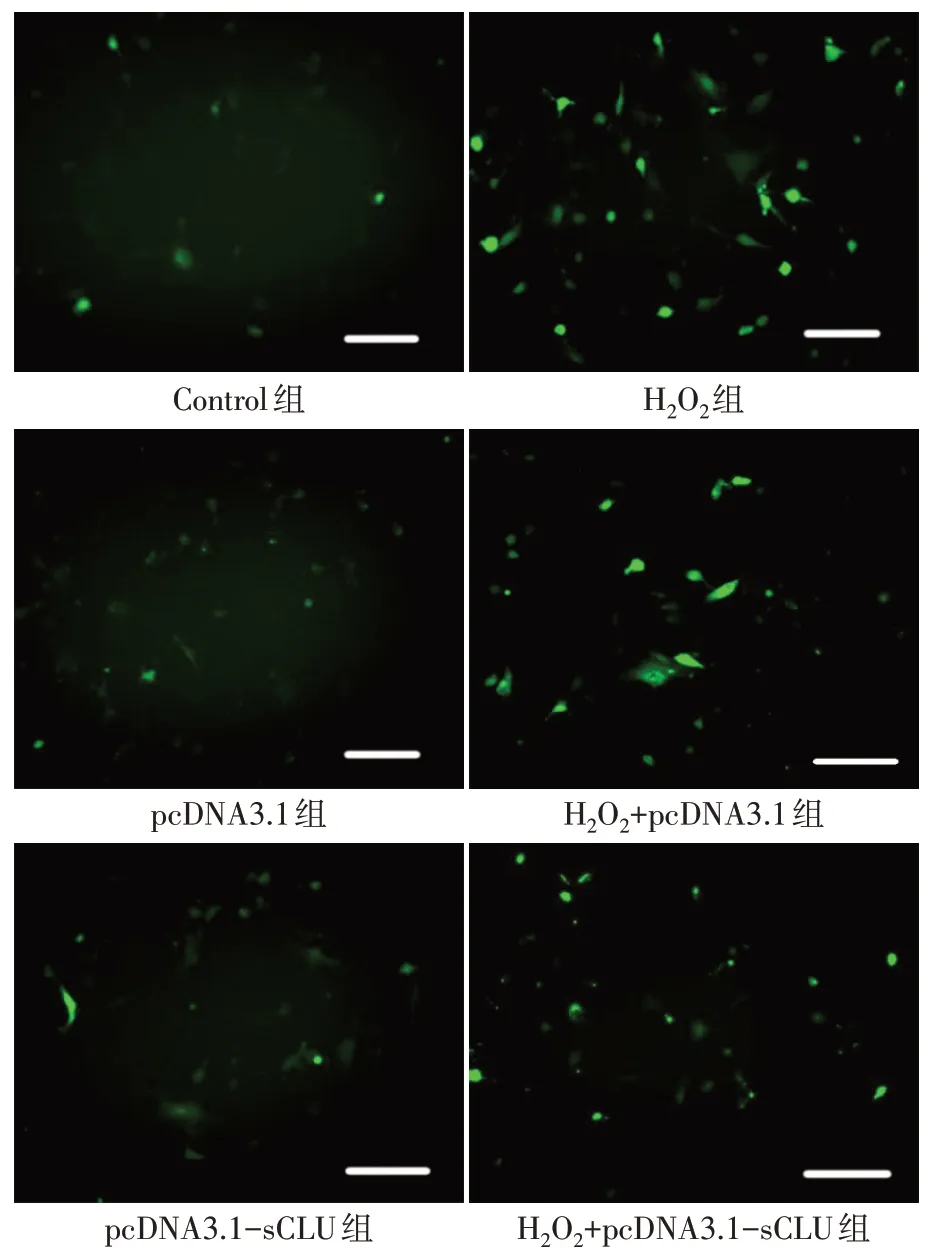
Fig.3 Comparison of the ROS levels between the six groups(Bar=100μm)圖3 各組細胞ROS水平的比較(標志線=100μm)
Tab.3 Comparison of the ROS,MDA and SOD levels between the six groups表3各組細胞ROS、MDA和SOD水平的比較(n=3,%,±s)
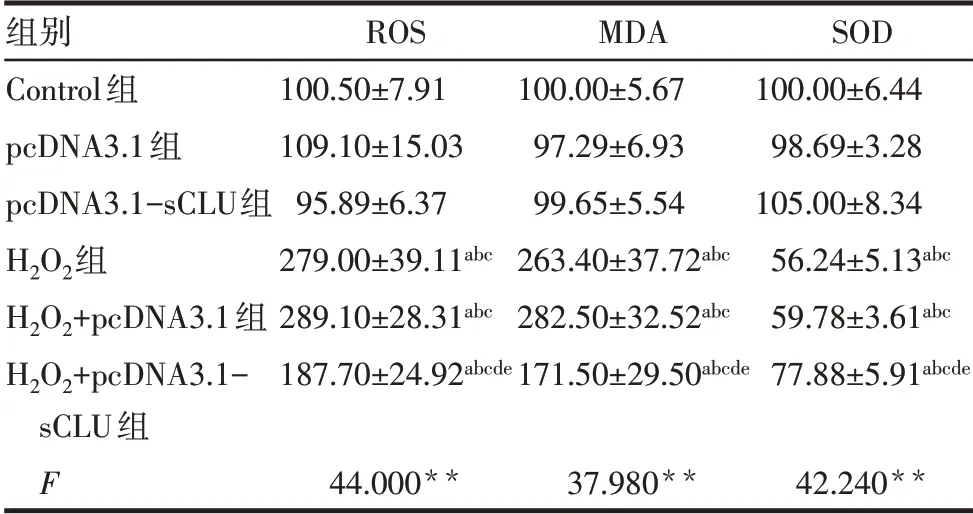
Tab.3 Comparison of the ROS,MDA and SOD levels between the six groups表3各組細胞ROS、MDA和SOD水平的比較(n=3,%,±s)
**P<0.01;a與Control組比 較,b與pcDNA3.1組比 較,c與pcDNA3.1-sCLU組比較,d與H2O2組比較,e與H2O2+pcDNA3.1組比較,P<0.05。
組別Control組pcDNA3.1組pcDNA3.1-sCLU組H2O2組H2O2+pcDNA3.1組H2O2+pcDNA3.1-sCLU組F ROS 100.50±7.91 109.10±15.03 95.89±6.37 279.00±39.11abc 289.10±28.31abc 187.70±24.92abcde MDA 100.00±5.67 97.29±6.93 99.65±5.54 263.40±37.72abc 282.50±32.52abc 171.50±29.50abcde SOD 100.00±6.44 98.69±3.28 105.00±8.34 56.24±5.13abc 59.78±3.61abc 77.88±5.91abcde 44.000**37.980**42.240**
2.2.3 各組細胞PINK1、Parkin和LC3蛋白表達水平的比較 與Control組比較,pcDNA3.1組和pcDNA3.1-sCLU組細胞PINK1、Parkin蛋白表達水平和LC3-Ⅱ/LC3-Ⅰ比值差異均無統計學意義,H2O2組和H2O2+pcDNA3.1組細胞PINK1和Parkin蛋白表達水平均升高,LC3-Ⅱ/LC3-Ⅰ比值均降低(P<0.05),H2O2+pcDNA3.1-sCLU組PINK1和Parkin蛋白表達水平及LC3-Ⅱ/LC3-Ⅰ比值差異均無統計學意義。與H2O2組比較,H2O2+pcDNA3.1組細胞PINK1和Parkin蛋白表達水平及LC3-Ⅱ/LC3-Ⅰ比值差異均無統計學意義,H2O2+pcDNA3.1-sCLU組PINK1和Parkin蛋白表達水平降低,LC3-Ⅱ/LC3-Ⅰ比值升高(P<0.05),見圖4、表4。
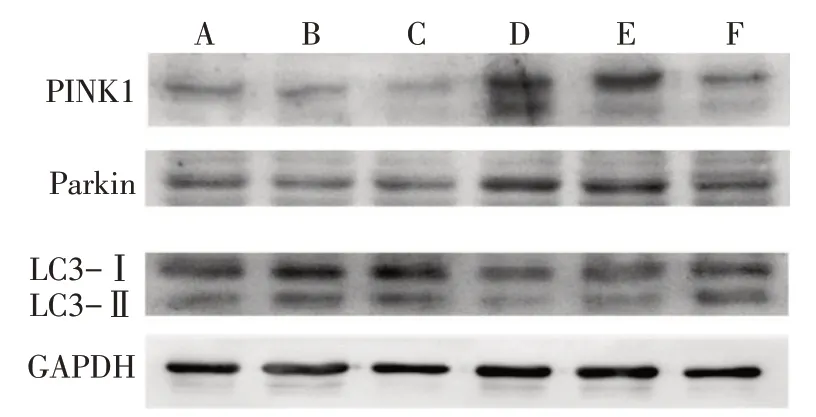
Fig.4 The protein levels of PINK1,Parkin and LC3 in each group圖4 各組細胞PINK1、Parkin和LC3蛋白表達水平
Tab.4 Comparison of the protein levels of PINK 1,Parkin and LC3 between the six groups表4 各組細胞PINK1、Parkin和LC3蛋白表達水平的比較(n=3,±s)
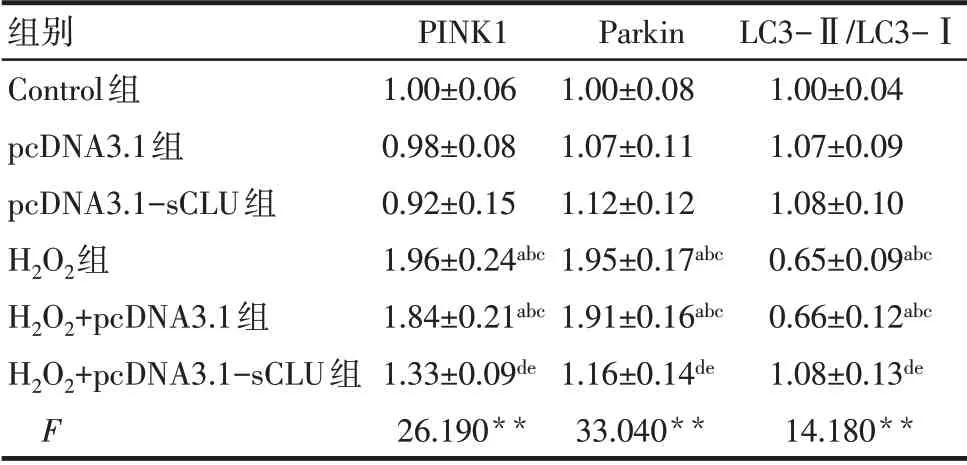
Tab.4 Comparison of the protein levels of PINK 1,Parkin and LC3 between the six groups表4 各組細胞PINK1、Parkin和LC3蛋白表達水平的比較(n=3,±s)
**P<0.01;a與Control組比較,b與pcDNA3.1組比較,c與pcDNA3.1-sCLU組比較,d與H2O2組比較,e與H2O2+pcDNA3.1組比較,P<0.05。
組別Control組pcDNA3.1組pcDNA3.1-sCLU組H2O2組H2O2+pcDNA3.1組H2O2+pcDNA3.1-sCLU組F PINK1 1.00±0.06 0.98±0.08 0.92±0.15 1.96±0.24abc 1.84±0.21abc 1.33±0.09de 26.190**Parkin 1.00±0.08 1.07±0.11 1.12±0.12 1.95±0.17abc 1.91±0.16abc 1.16±0.14de 33.040**LC3-Ⅱ/LC3-Ⅰ1.00±0.04 1.07±0.09 1.08±0.10 0.65±0.09abc 0.66±0.12abc 1.08±0.13de 14.180**
2.3 各組細胞活力和凋亡水平的比較(實驗3)與DMSO組比較,Mdivi-1組細胞活力與細胞凋亡率差異均無統計學意義,H2O2+DMSO組細胞活力下降,而細胞凋亡率升高(P<0.05)。與H2O2+DMSO組比較,H2O2+Mdivi-1組、H2O2+pcDNA3.1-sCLU組和H2O2+pcDNA3.1-sCLU+Mdivi-1組細胞活力均升高,細胞凋亡率均降低(P<0.05)。與H2O2+Mdivi-1組比較,H2O2+pcDNA3.1-sCLU組和H2O2+pcDNA3.1-sCLU+Mdivi-1組細胞活力差異均無統計學意義,細胞凋亡率降低(P<0.05)。與H2O2+pcDNA3.1-sCLU組比較,H2O2+pcDNA3.1-sCLU+Mdivi-1組細胞活力及細胞凋亡率差異無統計學意義,見表5。
3 討論
心血管疾病中,心肌損傷的很大一部分原因來自缺血過程中細胞的氧化應激產生的氧自由基[6]。CLU是一種廣泛存在于人體組織和體液中,具有分子伴侶活性,可與多種分子結合并發揮多種功能的蛋白[7]。CLU可分為sCLU和核型。研究發現,sCLU參與多種重要的生理過程,包括細胞凋亡[8]、炎癥反應[9]、內質網應激反應[10]、細胞黏附及組織修復[11]等,并與腫瘤的發生和發展關系密切[12]。此外,Turkieh等[3]發現,H9C2細胞中過表達sCLU可以降低蛋白酶體抑制劑MG-132誘導的細胞凋亡。小鼠心臟移植過程中,應用重組CLU保存的離體心臟受損程度降低,表現為細胞凋亡、中性粒細胞浸潤和促炎因子分泌減少[13]。因此,sCLU可能作為氧化應激條件下的氧化還原傳感器,對氧化應激損傷的細胞發揮保護作用。Polimeno等[14]也發現,H2O2誘導的膠質瘤細胞氧化損傷模型中sCLU蛋白表達水平降低。本研究應用H2O2處理離體培養的大鼠心肌細胞,結果發現,與Control組比較,H2O2組細胞中sCLUmRNA、細胞培養上清液中sCLU蛋白及細胞中總CLU蛋白相對表達水平均降低,提示sCLU可能在細胞氧化應激損傷過程中發揮保護作用。Jun等[15]研究發現,CLU可以通過激活Akt和GSK-3β信號通路而保護心肌細胞免受氧化應激損傷的影響。本研究結果亦顯示,與Control組比較,H2O2組細胞活力降低,細胞凋亡率升高,ROS和MDA水平升高,SOD水平降低,證實H2O2能夠通過氧化應激誘導心肌細胞損傷;另外,與H2O2組比較,H2O2+pcDNA3.1-sCLU組細胞活力升高,細胞凋亡率下降,ROS和MDA水平降低,SOD水平升高,再次證實sCLU過表達能減輕氧化應激對心肌細胞的損傷。另有研究顯示,CLU過表達還可保護骨關節炎軟骨細胞及腎足突細胞抵御氧化應激損傷[16-17],而在骨肉瘤、前列腺腫瘤等細胞中敲低CLU則可增強腫瘤細胞對氧化應激損傷的敏感性[18]。結合本研究,筆者認為CLU有保護細胞抵御氧化應激損傷的作用。
Tab.5 Comparison of the viability and apoptosis levels between the six groups表5 各組細胞活力和凋亡率的比較(n=3,±s)
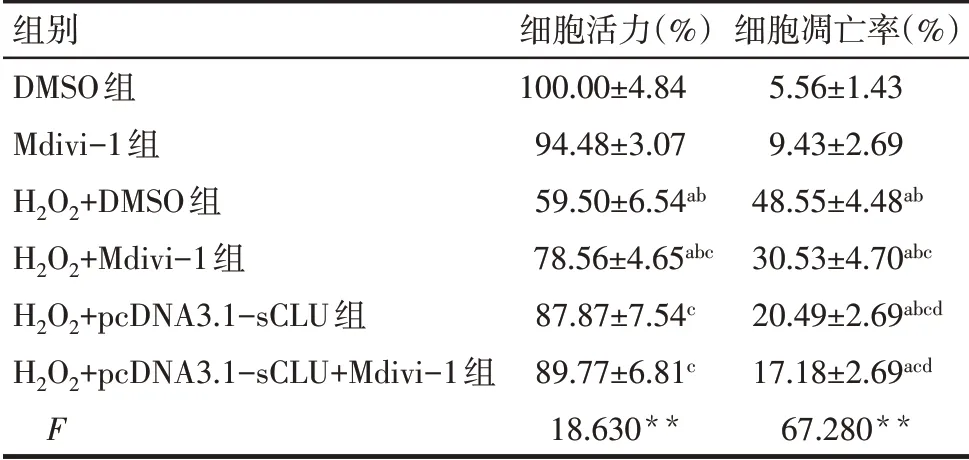
Tab.5 Comparison of the viability and apoptosis levels between the six groups表5 各組細胞活力和凋亡率的比較(n=3,±s)
**P<0.01;a與DMSO組比較,b與Mdivi-1組比較,c與H2O2+DMSO組比較,d與H2O2+Mdivi-1組比較,e與H2O2+pcDNA3.1-sCLU組比較,P<0.05。
組別DMSO組Mdivi-1組H2O2+DMSO組H2O2+Mdivi-1組H2O2+pcDNA3.1-sCLU組H2O2+pcDNA3.1-sCLU+Mdivi-1組F細胞活力(%)100.00±4.84 94.48±3.07 59.50±6.54ab 78.56±4.65abc 87.87±7.54c 89.77±6.81c 18.630**細胞凋亡率(%)5.56±1.43 9.43±2.69 48.55±4.48ab 30.53±4.70abc 20.49±2.69abcd 17.18±2.69acd 67.280**
既往研究顯示,CLU可以通過參與氧化應激、炎癥、胰島素生長因子1信號通路、KU70/BAX信號通路、腫瘤壞死因子α信號通路及絲裂原活化蛋白激酶信號通路等途徑在心肌細胞中發揮作用[19]。本研究發現,與Control組比較,pcDNA3.1-sCLU組細胞活力、細胞凋亡率、ROS和MDA水平、SOD的差異無統計學意義,考慮可能是由于CLU僅在氧化應激等特定條件下才發揮相應的作用。He等[17]研究也發現,單獨采用外源性CLU刺激腎足突細胞對細胞活力及氧化應激水平無顯著影響。
線粒體自噬是一種以線粒體為目標的特殊自噬形式,其對整個線粒體網絡的功能完整性和細胞存活具有重要作用。線粒體自噬通過調節線粒體的質量與數量維持心肌細胞的正常功能,線粒體自噬過度或不足均可影響心肌細胞的功能,甚至導致心肌細胞死亡。線粒體自噬過程受多種途徑調控,PINK1/Parkin是線粒體自噬中研究最多的信號通路,而氧化應激是Pink1/Parkin介導的線粒體自噬發生的重要始動因素[20]。因此,本研究分析了sCLU在心肌細胞中是否通過PINK1/Parkin介導的線粒體自噬發揮抗氧化應激損傷作用,結果顯示,與Control組比較,H2O2組PINK1和Parkin蛋白表達水平升高,且細胞活力下降,細胞凋亡率升高,表明H2O2過度激活了線粒體自噬,進而導致心肌細胞損傷;與H2O2組比較,H2O2+pcDNA3.1-sCLU組PINK1和Parkin蛋白表達水平降低,表明sCLU過表達抑制了線粒體自噬,同時細胞活力升高,細胞凋亡率下降。本研究進一步采用線粒體自噬抑制劑Mdivi-1處理細胞,結果發現,與H2O2+DMSO組比較,H2O2+Mdivi-1組、H2O2+pcDNA3.1-sCLU組和H2O2+pcDNA3.1-sCLU+Mdivi-1組細胞活力均升高,細胞凋亡率均下降;與H2O2+Mdivi-1組比較,H2O2+pcDNA3.1-sCLU組和H2O2+pcDNA3.1-sCLU+Mdivi-1組細胞活力無顯著變化,細胞凋亡率降低,提示sCLU對氧化應激條件下H9C2細胞損傷的保護作用可能通過抑制線粒體自噬活性實現。另有研究顯示,在口腔癌細胞中sCLU可以通過AMPK/Akt/mTOR通路促進線粒體自噬,進而提升口腔癌細胞在饑餓條件下的生存能力[21]。然而,在氧化應激損傷的心肌細胞中,sCLU調控PINK1/Parkin的分子機制尚不明確。
綜上所述,sCLU可對氧化應激條件下的心肌細胞產生保護作用,其機制可能與抑制線粒體自噬的活化有關。sCLU有望成為一個新的治療心肌氧化應激損傷的潛在靶標分子。

