降調節激素替代周期雌激素啟動時機對既往移植失敗患者FET臨床結局的影響
雷敏,黃開淑,覃雅倩
(常德市第一人民醫院生殖醫學中心,常德 415000)
隨著胚胎冷凍復蘇技術的發展成熟,凍融胚胎移植(FET)因具有降低卵巢過度刺激的風險、能保存更多剩余胚胎等優勢,越來越受到輔助生殖醫師的青睞,而其內膜準備方案的選擇是影響FET妊娠結局的一個重要因素。其中自然周期、雌孕激素替代周期、促排卵周期和降調節激素替代周期是目前FET周期主要的內膜準備方案。降調節激素替代周期相對自然周期、雌孕激素替代周期,屬于一種較新的內膜準備方案,尤其適用于多囊卵巢綜合征(PCOS)、反復移植失敗、子宮內膜異位癥、子宮腺肌癥、盆腔手術史等不孕患者[1]。已有研究顯示,降調節激素替代周期相對其他內膜準備方案可以改善反復移植失敗患者的FET妊娠結局[2-4]。因此關于降調節激素替代周期的研究逐漸成為目前生殖領域的研究熱點。但既往相關研究,多數是在比較降調節激素替代周期相比其他內膜準備方案的優勢及其適用人群,而如何控制促性腺激素釋放激素激動劑(GnRH-a)降調節后外源性雌激素的啟動時機,以獲得最佳的臨床結局卻鮮有報導。本文通過比較GnRH-a降調節后外源性雌激素的不同啟動時機對既往移植失敗患者FET臨床結局的影響,旨在探討GnRH-a降調節后最佳的雌激素啟動時機,以期改善既往移植失敗患者FET臨床結局。
資料與方法
一、研究對象
通過常德市第一人民醫院生殖醫學中心電子病歷系統篩選出2018年1月至2019年12月在本中心進行FET的患者作為研究對象。納入標準:(1)年齡20~40歲;(2)予降調節激素替代周期準備內膜;(3)既往曾有≥1次胚胎移植失敗史。排除標準:(1)降調節后出現FSH和LH一過性升高的Flare Up效應;(2)夫妻任何一方存在染色體異常;(3)輸卵管積水;(4)宮腔形態異常(包括子宮粘膜下肌瘤、宮腔中-重度粘連、粘膜下肌瘤、內膜息肉等);(5)患有自身免疫疾病或易栓傾向相關疾病。
共納入316個周期,根據GnRH-a降調節后雌激素啟動時機分為兩組:A組:GnRH-a降調節后14~29 d添加外源性雌激素,共157個周期;B組GnRH-a降調節后30~40 d添加外源性雌激素,共159個周期。
二、研究方法
1.內膜準備:所有患者均給予降調節激素替代周期準備內膜。兩組患者均于早卵泡期(月經第2~3天)皮下注射長效GnRH-a(達必佳,輝凌,德國)3.75 mg降調節。A組患者于降調節后14~29 d來院抽血檢測血清卵泡刺激素(FSH)、黃體生成激素(LH)、雌二醇(E2)水平,待性激素水平達到降調節標準(FSH≤5 U/L、LH≤5 U/L、E2<185 pmol/L),再行經陰道超聲檢查患者子宮內膜厚度、形態及卵巢內竇卵泡情況,并于降調節后14~29 d之間予雌激素(補佳樂,拜耳,法國)4~6 mg/d啟動。B組于降調節后≥30 d來院抽血查FSH、LH、E2,直到激素水平達標(標準同A組),并行陰道超聲檢查,于降調節后30~40 d之間予雌激素4~6 mg/d啟動。2組患者均于服藥1周后來院行陰道超聲檢測子宮內膜厚度及形態,并根據內膜生長情況調整外源性雌激素用量,如子宮內膜厚度達到8 mm以上,肌肉注射黃體酮注射液(浙江仙琚)60 mg轉化內膜。
2.胚胎凍融方法及移植時機:胚胎凍融采用玻璃化快速冷凍和復蘇的方法,于內膜轉化第3~5天行胚胎移植術,B超引導下在距宮底1~2 cm處放置胚胎1~2枚,移植后給予雪諾同凝膠(默克,英國)90 mg/d陰道給藥或黃體酮注射液60 mg/d肌肉注射進行黃體支持。
3.妊娠判斷:卵裂期胚胎移植后14 d/囊胚移植后12 d抽血查血清β-HCG,血β-HCG>5 U/L者為HCG陽性。胚胎移植后4~5周行陰道B超檢查胚胎發育情況及妊娠胎數,凡宮腔內有妊娠囊或流產、異位妊娠,術后病理檢查顯示有絨毛者,均視為臨床妊娠。
4.觀察指標:患者一般臨床資料包括年齡、體質量指數(BMI)、不孕年限、基礎性激素水平(bFSH、bLH、bE2);降調節后臨床指標包括雌激素啟動日性激素水平(FSH、LH、E2)、雌激素使用時長、雌激素使用量及移植前子宮內膜厚度、移植胚胎數、優質胚胎數;妊娠結局指標包括胚胎種植率(孕囊數/總移植胚胎數×100%)、臨床妊娠率(臨床妊娠周期數/移植周期數×100%)、早期流產率(早期流產周期數/臨床妊娠周期數×100%)、異位妊娠率(異位妊娠周期數/臨床妊娠周期數×100%)及活產率(活產患者數/總移植例數×100%)。
三、統計學分析
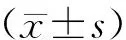
結 果
一、患者的一般臨床資料比較
兩組患者年齡、不孕年限、BMI、基礎性激素水平等一般臨床資料比較,均無統計學差異(P>0.05)(表1)。

表1 兩組患者一般臨床資料比較
二、降調節后兩組患者實驗室指標比較
統計結果顯示,兩組患者GnRH-a降調節后啟動日性激素水平、外源性雌激素使用時間以及移植前子宮內膜厚度、移植胚胎數和優質胚胎數均無統計學差異(P>0.05);但B組外源性雌激素用量顯著低于A組(P<0.05)(表2)。
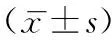
表2 兩組患者降調節后實驗室指標比較
三、兩組患者的妊娠結局比較
兩組患者的早期流產率和異位妊娠率無統計學差異(P>0.05);B組的胚胎種植率、臨床妊娠率及活產率均顯著高于A組(P<0.05)(表3)。

表3 兩組患者妊娠結局比較(%)
討 論
影響凍融周期成功率的關鍵因素有年齡、胚胎質量和內膜容受性[5],其中內膜因素約占三分之二[6],因此內膜準備方案的選擇尤為重要。降調節激素替代周期,又稱降調節人工周期,是指先通過長效GnRH-a達到垂體降調節作用后,適時添加外源性雌激素,內膜達到一定厚度時誘導內膜向分泌期轉化,行FET。降調節激素替代周期最初廣泛應用于合并子宮內膜異位癥或子宮腺肌病的FET人群[7]。隨著對降調節激素替代周期的深入了解,目前普遍認為GnRH-a可能通過以下幾個方面來改善FET的成功率:(1)抑制下丘腦-垂體-卵巢軸(HPO軸)使垂體降調節,避免不受控制的卵泡發育、LH升高等問題[8],避免胚胎與內膜發育不同步;(2)增加子宮內膜胞飲突的數量,提高整合素αvβ3和同源框基因10(HOXA-10)基因的表達,促進胚胎黏附與侵入[2];(3)通過調節能量代謝和免疫反應影響子宮內膜容受性,促進母胎免疫耐受[9]。對于既往移植失敗的患者,降調節激素替代周期已成為臨床醫師常用的內膜準備方案。
有研究顯示,降調節激素替代周期相比其他內膜準備方案可能有更好的妊娠結局[10-11];但也有部分研究結果顯示,與普通的雌孕激素替代周期比較,降調節激素替代周期在臨床妊娠率和胚胎種植率方面無明顯優勢[12-13]。導致上述兩種不同結論的主要原因可能是研究對象的納入標準和排除標準不同,以及降調節后雌激素啟動時機不同有關,需要進一步研究加以探討。
促性腺激素釋放激素(GnRH)是下丘腦分泌的一種十肽激素,正常情況下可以刺激腺垂體產生FSH和LH,進而刺激卵巢分泌性激素,構成下丘腦-垂體-卵巢調節系統[14]。GnRH-a是一種人工合成的GnRH,其改變了GnRH第6位和第10位氨基酸,使其生物效應較天然GnRH增加了50~200倍。當外源性GnRH-a與垂體的GnRH受體結合后,初期會促使腺垂體分泌FSH和LH,產生一過性激發作用,用藥5~7 d后,FSH和LH開始下降,14 d內降低到基礎值以下,當垂體的GnRH受體被耗盡,垂體對正常的GnRH不起反應,稱為藥物去垂體狀態,導致HPO軸被阻斷,卵巢內的卵泡停止發育,卵巢釋放的雌激素減少至絕經期水平,從而達到降調節的作用[15]。注射長效GnRH-a(3.75 mg)后,28 d內其血藥濃度一般維持在0.23 μg/L左右,呈藥物去垂體狀態,40~45 d后藥物被完全吸收,垂體功能得以恢復[16]。42~49 d后卵巢釋放的雌激素水平開始上升,49~56 d左右LH水平開始上升[17]。長效GnRH-a最初用于控制性促排卵周期,目前卵泡期長效長方案成為國內控制性促排卵的主要方案,大量關于長效GnRH-a后促性腺激素(Gn)啟動時機的研究均顯示適當延長Gn啟動時機,一定程度上可以提高IVF的胚胎種植率和臨床妊娠率,降低早期流產率[18-19],這可能與垂體抑制程度有關。
目前認為,注射長效GnRH-a后,降調節作用的時間大約為14~45 d,但降調節激素替代周期添加外源性雌激素的時機,目前尚無統一的標準,國內外大部分生殖中心均根據臨床經驗在14~40 d添加,以14~28 d為主。有研究顯示長效GnRH-a降調節后,待血清雌激素水平呈上升趨勢時添加外源性雌激素,雌激素用藥時間更短,外源性雌激素用量更少,有利于降低早期流產率,改善妊娠結局[8]。但此方法需多次抽血檢測患者體內雌激素水平,增加了患者來院檢測次數,增加了患者的經濟負擔和不便。
本研究以降調節后雌激素不同啟用時機為分組標準,相對簡便,可以減少患者來院抽血檢查次數和費用,患者依從性更高。通過本研究,我們觀察到降調節后30~40 d添加外源性雌激素的患者,其外源性雌激素的用量顯著低于30 d以內添加雌激素的患者(P<0.05),這可能與適當延長雌激素給藥間隔患者垂體功能恢復更好,機體對外源性雌激素敏感性增加有關。同時由于外源性雌激素用量減少,降低了藥物副作用和患者的經濟負擔,有利于增加患者的依從性。有研究顯示,補充外源性雌激素可能引起子宮內膜相關因子的變化,降低子宮內膜對胚胎的容受能力,繼而對妊娠結局產生負面影響[20-21]。因此,降調節30~40 d添加外源性雌激素的患者,其外源性雌激素用量減少,可能得到更好的臨床結局。
本研究結果顯示,降調節30~40 d添加外源性雌激素的患者,其胚胎著床率、臨床妊娠率及活產率均較降調節30 d內添加外源性雌激素的患者顯著增高(P<0.05)。其原因可能有以下兩點:(1)外源性雌激素用量減少,可能改變子宮內膜容受性相關細胞因子的表達,提高子宮內膜接受胚胎的能力,有利于胚胎種植,提高了臨床妊娠率和活產率;(2)雌激素啟動時機延后,垂體功能恢復更好,有利于黃體功能的改善,得到更好的妊娠結局。GnRH-a降調節后30~40 d添加外源性雌激素的患者,胚胎移植日距長效GnRH-a注射日的時間普遍大于7周,卵巢黃體功能開始恢復;而GnRH-a降調節后14~29 d添加外源性雌激素的患者胚胎移植時,垂體仍處于抑制狀態,卵巢功能尚未恢復,黃體功能不足,從而影響妊娠結局。不同時機添加外源性雌激素對子宮內膜的微觀結構、各類細胞因子表達等的影響,還有待于后續從微觀和分子生物學角度進行更深入的研究探討。
綜上所述,長效GnRH-a降調節后30~40 d啟動雌激素治療,外源性雌激素的使用量更少,可以一定程度上提高既往移植失敗患者FET的胚胎種植率、臨床妊娠率及活產率,改善妊娠結局。但該研究系回顧性研究,研究結論存在一定的局限性,后續仍需大樣本、多中心的隨機對照研究來進一步證實。

