釓塞酸二鈉增強MRI預測乙型肝炎肝硬化合并肝細胞癌切除術后肝功能不全的研究
劉愛民,譚邦國,盧福麟,吳玉平,陳天武
(1.醫學影像四川省重點實驗室,川北醫學院附屬醫院放射科,四川 南充 637000;2.內江市第二人民醫院放射科,四川 內江 641000)
目前在我國存在大量乙型肝炎病毒(HBV)感染的肝硬化患者,原發性肝細胞癌(hepatocellular carcinoma,HCC)作為肝硬化的重要并發癥[1],其外科治療是患者獲得長期生存的最重要手段,如果患者腫瘤負荷過重或肝功能異常,很可能導致術后肝功能不全的發生,因此術前對這類患者進行肝臟儲備功能的精準評估是非常必要的。目前臨床上應用比較廣泛的肝功能評估方法包括吲哚菁綠(indocyanine green,ICG)清除實驗、Child-pugh分級、終末期肝病模型(model for end-stage liver disease,MELD)評分、白蛋白-膽紅素(albumin-bilirubin,ALBI)分級等,使用影像學方法評估肝功能儲備主要包括用CT或MRI測量預估切除術后剩余肝臟體積[2],但這些方法評估的主要是肝臟整體功能儲備情況,其應用有一定的局限性。近年來,隨著肝臟特異性對比劑釓塞酸二鈉(Gd-EOB-DTPA)的推廣應用,已有大量文獻支持其可以有效評估肝功能儲備[3-6],但是應用釓塞酸二鈉增強MRI預測乙型肝炎肝硬化合并HCC患者術后發生肝功能不全的報道尚少。本研究主要利用釓塞酸二鈉增強MRI獲得肝臟各段及總體攝取指數、虛擬肝癌切除后殘余攝取指數,探討其預測患者術后發生肝功能不全的可行性。
1 資料與方法
1.1 一般資料
回顧性分析2018年8月至2021年8月于川北醫學院附屬醫院接受手術切除的乙型肝炎肝硬化合并HCC40例患者的臨床和影像學資料。納入標準:(1)有乙型肝炎病史,并有影像學或病理學可見的肝硬化表現;(2)手術后病理證實為肝細胞癌;(3)術前2周內行釓塞酸二鈉(拜耳醫藥保健有限公司,德國)增強MRI檢查,術前及術后1周內行實驗室肝功能檢查。排除標準:(1)有肝臟局部手術或介入治療病史;(2)肝外病變引起的黃疸;(3) MRI圖像質量差,導致肝臟體積和信號強度測量不準確。術后發生肝功能不全的判斷標準為:術后血清總膽紅素(total bilirubin,TBIL)>51 μmol/L,或術后7 d TBIL>34 μmol/L[7]。本組共納入研究對象40例,其中男性35例,女性5例;年齡(55.9±10.16)歲;共計切除病灶44個,大小(0.55~726.76)cm3。
1.2 肝臟分段標準和手術切除方式
肝臟解剖分段方法:按照Couinaud分段法[8],將肝臟分為尾狀葉(S1)、左外葉上段(S2)、左外葉下段(S3)、左內葉(S4)、右前葉下段(S5)、右后葉下段(S6)、右后葉上段(S7)及右前葉上段(S8)。肝切除術方式:參考《肝臟解剖和肝切除手術命名以及肝血流阻斷方法與選擇原則》,分為肝腫瘤剜除術、限制性肝切除術、局部肝切除術、肝腫瘤摘除術、肝楔形切除術、肝段切除術、半肝切除術和肝三葉切除術,本組患者采用肝局部切除術22例,肝段切除術6例,半肝切除8例,肝段切除+局部切除4例。
1.3 肝功能相關檢查及肝功能評分
記錄患者MRI檢查鄰近1周內及術后第7日的TBIL、血清白蛋白(ALB)、凝血酶原時間(PT)、丙氨酸轉氨酶(ALT)、天冬氨酸轉氨酶(AST)、谷氨酰胺轉氨酶(GGT)及肝性腦病、腹腔積液情況,進行術前肝功能Chlid-Pugh及ALBI分級[9],其中Child-Pugh A級39例,B級1例;ALBI 1級25例,2級14例,3級1例。陽性組,即術后發生肝功能不全8例,占比20%;陰性組,即術后未發生肝功能不全的患者32例,占比80%。
1.4 MRI掃描與圖像分析
采用GE 3.0T MRI掃描儀(DISCOVERY MR 750;GE Medical Systems),32通道相控陣體部線圈。患者行檢查前6~8 h禁飲、禁食,檢查體位為雙臂上舉仰臥位;增強掃描對比劑使用釓塞酸二鈉,注射劑量0.025 mmol/kg,經外周靜脈團注,注射速率2 mL/s,并用20 mL生理鹽水沖管,注射后20 min獲取肝膽期全肝圖像,掃描序列使用BHLAVA-Flex,掃描參數:重復時間4.0 ms,回波時間2.3 ms,翻轉角12°,視野36×36 cm,層厚5.2 mm,層間距0 mm,激勵次數1。
將所有患者的釓塞酸二鈉增強MRI肝膽期數據導入3D Slicer軟件包(3Dslicer4.8.1,www.slicer.org),使用Segment Editor內scissor工具對肝臟按照Couinaud法進行分段勾畫(見圖1 A-D),避開肝門區主要血管和肝臟腫瘤位置,記錄肝臟各段體積(Volume1-8,V1-8)、各段平均信號強度(Signal intensity,SIliver1-8)以及脾臟平均信號強度SIspleen。根據已有文獻報告,肝臟攝取指數采用計算公式[4]:HUI=(SIliver/SIspleen-1)×Vliver,計算出肝臟各段對比劑攝取比率(Hepatic uptake ratio,HUR1-8=SI1-8/SIspleen-1)及其變異系數、各段攝取指數(HUI1-8=HUR1-8×V1-8)及全肝攝取指數(total hepatic uptake index,THUI=HUI1+HUI2+…+HUI8),使用軟件行肝癌虛擬切除(圖1E-F),計算出殘余肝臟攝取指數(remnant hepatic uptake index,RHUI)及殘余肝臟體積占術前肝臟體積的比例(remnant liver volume to total liver volume ratio,RLVR),分析各段攝取系數HUR1-8變異系數、全肝攝取指數THUI、殘余肝臟攝取指數RHUI及殘余肝臟體積占術前肝臟比例RLVR與術后發生肝功能不全的關系。

1.5 統計學分析

2 結果
2.1 術后發生與未發生肝功能不全患者臨床和血清肝功能指標的比較
乙型肝炎肝硬化并發肝細胞癌術后發生與未發生肝功能不全患者間臨床和血清肝功能指標的比較,見表1。統計顯示兩組間年齡及血清GGT水平差異均有統計學意義(P<0.05),但性別構成、血清TBIL、ALB、ALT、AST水平差異均無統計學意義(P>0.05)。
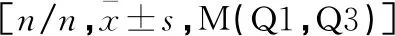
表1 肝細胞癌術后發生與未發生肝功能不全患者臨床和血清肝功能指標比較
2.2 術后發生與未發生肝功能不全患者術前肝臟各段攝取指數的比較
乙型肝炎肝硬化并發肝細胞癌術后發生與未發生肝功能不全患者間肝臟各段攝取指數HUI1-8差異統計結果見表2,Mann-Whtiney U檢驗顯示乙型肝炎肝硬化并發肝細胞癌術后發生與未發生肝功能不全患者間肝臟各段攝取指數HUI1-8差異均有統計學意義,陽性組各段攝取指數HUI均明顯低于陰性組(P<0.05)。

表2 肝細胞癌術后發生與未發生肝功能不全患者間肝臟各段HUI差異比較[M(Q1,Q3)]
2.3 術后發生與未發生肝功能不全患者間肝臟各段HUR之間的變異系數、THUI及RHUI的比較
陽性組各段HUR變異系數明顯大于陰性組,陽性組THUI、RHUI明顯小于陰性組(P<0.05)。

表3 兩組患者間肝臟各段HUR之間的變異系數、THUI及RHUI的比較 [M(Q1,Q3)]
2.4 術前肝臟各段HUR變異系數、THUI、RHUI預測HCC術后肝功能不全的效能
基于Mann-Whtiney U檢驗,發現陽性組、陰性組間肝臟各段HUR變異系數、THUI、RHUI的差異性有統計學意義,本研究使用這些指標對術前預測乙型肝炎肝硬化合并HCC切除術后肝功能不全效能做ROC曲線分析(圖2),顯示肝臟各段HUR變異系數、THUI、RHUI的ROC曲線下面積(area under the curve,AUC)分別為0.855、0.805、0.848,臨界值分別為0.606、252.60、168.04,敏感性分別為0.875、0.875、0.750,特異性分別為0.781、0.750、0.844,對應的P值分別為0.002、0.008、0.003。

3 討論
3.1 使用釓塞酸二鈉增強MRI獲取的肝臟攝取指數開展本研究的可行性
乙型肝炎后肝硬化合并HCC患者獲得長期生存最重要的手段是手術切除,術前進行肝功能儲備評估及制定個性化的治療方案,可以盡量避免圍手術期肝功能不全甚至肝功能衰竭的發生,目前臨床和影像常用方法主要是針對整體肝臟功能的評估,然而既往研究表明肝硬化患者肝臟功能受損分布可能是不均勻的[6],使得上述評估方法存在一定的局限性。釓塞酸二鈉是一種順磁性肝膽特異性MRI對比劑,與常規細胞外對比劑不同的是,其可經肝細胞膜上的有機陰離子轉運多肽由細胞外間隙轉運至肝細胞內,濃度在注射對比劑后第20 分鐘左右達到峰值,通過短回波時間采集的3D-GRE肝膽期序列,肝臟信號強度與肝功能的相關性遠大于其他因素(如鐵質沉著或脂質沉著、纖維化)[4]。因此可以通過測量肝膽期肝實質信號強度來間接反應肝臟局部功能[10],但MRI信號強度是相對值,受掃描參數的影響,信號強度測量既不能用于不同患者間比較,也不能用于同一患者的重復檢查間比較。研究表明肝臟HUI與肝功能具有相關性,也有研究發現使用釓塞酸二鈉聯合肝臟體積測量,可以對總肝功能和節段性肝功能進行定量評估,因此釓塞酸二鈉增強MRI掃描聯合3D slicer軟件對肝臟各段體積進行精準測量及腫瘤模擬切除,使得定量評估術前肝功能儲備及預測術后肝功能不全具有可行性[4-5,11]。本研究選擇僅用肝膽期序列即可分析的HUI作為評價肝功能的參數。
3.2 乙型肝炎肝硬化合并HCC切除術后發生與未發生肝功能不全患者肝臟各段HUR及其變異系數、THUI、RHUI的比較
本研究發現,乙型肝炎肝硬化并發肝細胞癌術后發生肝功能不全患者各段攝取指數HUI及總肝攝取指數THUI,明顯低于未發生肝功能不全患者肝臟各段HUI及THUI。已有研究報道,釓塞酸二鈉可被肝細胞膜上轉運體選擇性攝取入細胞內,隨著肝硬化嚴重程度的加重,受損的轉運體數量增加和轉運體功能減低,都會減少肝細胞對釓塞酸二鈉的攝取[13],使得肝膽期肝臟信號強度(SIliver)降低;而脾臟內不含有上述轉運體,釓塞酸二鈉增強MR掃描僅顯示非特異性細胞外對比劑的強化特征,肝膽期其信號強度受肝功能變化影響很小[10,12],從而導致肝臟各段攝取比率(HUR= SIliver/SIspleen-1)值降低。隨著肝臟纖維化程度加重,多伴隨著肝臟的體積(Vliver)減少[14]。前述改變協同作用,導致乙型肝炎肝硬化合并HCC切除術后發生肝功能不全患者肝臟各段HUR、THUI、RHUI均低于未發生肝功能不全患者,提示術前肝臟功能儲備降低,術后肝功能不全發生幾率升高。
本研究還發現,乙型肝炎肝硬化合并HCC切除術后發生與未發生肝功能不全患者比較,其肝臟各段HUR變異系數明顯更高,張繼云等[15]報道不同程度肝功能受損患者各段間肝功能儲備不一致,與本研究結果相符。分析其可能的機制是因為肝臟不同部位血管和膽管分布不同,在肝硬化的進展過程中,局部肝細胞減少和纖維組織增加程度不一致,導致釓塞酸二鈉攝取量不同,最終體現為肝膽期肝臟各段實質MRI信號強度的不均勻,表明乙型肝炎肝硬化合并HCC切除術后發生肝功能不全患者肝臟各段功能受損的不均勻程度,明顯高于術后未發生肝功能不全患者,從而導致術后發生肝功能不全患者肝臟各段HUR變異系數高于未發生肝功能不全患者。
3.3 乙型肝炎肝硬化合并HCC術前肝臟各段HUR變異系數、THUI、RHUI預測術后肝功能不全的效能
本研究使用乙型肝炎肝硬化合并HCC患者術前肝臟各段HUR變異系數、THUI、RHUI預測其術后肝功能不全的發生,AUC值均超過0.8,表明各方法均具有較好的預測效能,并且均能獲得較高的特異性和敏感性,顯示出釓塞酸二鈉增強MRI掃描在預測乙型肝炎肝硬化合并HCC患者術后肝功能不全的優勢,在這些方法中,使用患者術前肝臟各段HUR變異系數進行術后肝功能不全預測的效能最高,AUC為0.855,其臨界值是0.606,敏感度0.875,特異性0.781。
3.4 本研究的優勢與不足
本研究綜合肝臟實質質地及體積的改變,選用釓塞酸二鈉增強MRI獲取的肝臟HUI作為評價指標,在此基礎上結合肝硬化肝臟各段改變的不一致性,用肝段HUI開展研究。本研究針對乙型肝炎肝硬化合并HCC患者,引入虛擬HCC切除的概念,用虛擬HCC切除術前肝段HUI研究HCC切除術后肝功能不全發生的可能性。研究顯示,釓塞酸二鈉增強MRI掃描能有效評估乙型肝炎肝硬化合并HCC患者術前肝功能儲備,并展示出肝臟各段功能的異質性,同時聯合模擬切除后殘余肝臟攝取指數,可以較為準確的預測該類患者術后肝功能不全的發生,為臨床醫生更為合理的選擇治療方式提供定量參考依據。本研究的不足主要在于研究樣本量偏小,對患者術后存活周期及死亡率缺乏跟蹤,計劃在今后的相關研究中繼續深入探討。

