TRIB3 與AKT 在大鼠睪丸細胞中的相互關聯*
劉 娜 張 巖 李 妍 楊 錚 云 霞 白 杰 張信來 劉陶迪
內蒙古醫科大學基礎醫學院 內蒙古醫科大學附屬醫院( 110032)
男性不育的發病率在全球呈上漲趨勢[1],發病年齡也趨向年輕化。 確定與男性不育相關的分子機制對其診斷和治療非常重要。 Trib3 是一種存在于哺乳動物中的假激酶,用于控制細胞增殖、凋亡、遷移和侵襲[2]。 本實驗室前期研究發現,Trib3 基因在大鼠睪丸組織中表達,且在大鼠出生后第10 天比大鼠出生后第8 天轉錄表達上調20.3 倍之多,是在大鼠精子發生過程中,表達差異比較顯著的基因之一[3]。 TRIB3 蛋白有一個中心絲氨酸/ 蘇氨酸激酶樣結構域[4],這個假激酶結構域在蛋白質與靶蛋白的相互作用中起著重要作用。 研究表明TRIB3 是通過調節和結合幾種關鍵蛋白質的活性實現其功能, 包括AKT、 轉錄因子ATF4、DDIT3 等,且TRIB3 通過調節細胞內的各種信號通路發揮作用[5]。 有研究發現TRIB3 通過結合AKT 可以抑制腫瘤發生[6]。但TRIB3 在大鼠睪丸細胞中是否能與AKT 結合發揮作用,目前尚未有研究。 本研究主要分析確定了在大鼠睪丸細胞中TRIB3 與AKT 存在蛋白互作關系,為進一步研究TRIB3 對大鼠生殖的影響以及發揮作用的可能機制提供更多實驗證據。
材料與方法
一、材料
(一)實驗動物
內蒙古醫科大學實驗動物中心購買20~25 日齡雄性Wistar 大鼠[許可證號:[SCXK(蒙)2015-0001]。 Trib3基 因 敲 除 雄 性Wistar 大 鼠 (SCXK 京2019-0002),20~25 日齡,委托北京維通利華實驗動物技術有限公司制備F0 代基因敲除純合鼠,F0 代基因敲除鼠自然交配產生后代純合鼠。 在內蒙古醫科大學實驗動物中心同一條件下飼養。
(二)主要試劑
DMEM/F12 培養基(美國Giboico 公司),胎牛血清(天津TBD 公司),免疫共沉淀試劑盒(美國Millipore公司),全蛋白提取試劑盒(凱基生物公司),總RNA 提取試劑盒(天根生化有限公司),總DNA 試劑盒(天根生化有限公司),兔抗TRIB3 抗體(武漢菲恩生物科技有限公司),兔抗AKT 抗體(美國CST 公司),羊抗兔IgG(美國Abcam 公司),RT-qPCR 試劑盒(大連寶生物公司)。
二、實驗方法
(一)TRIB3 基因敲除大鼠鑒定
剪取8~10 日齡大鼠腳趾, 裝入0.2 ml PCR 管,提取DNA,使用紫外分光光度儀測定DNA 濃度及純度。以提取的DNA 為模板對部分Trib3 片段擴增, 基因型鑒定引物列表,見表1,將擴增完的PCR 產物進行瓊脂糖凝膠電泳。 基因型判斷標準,見表2。
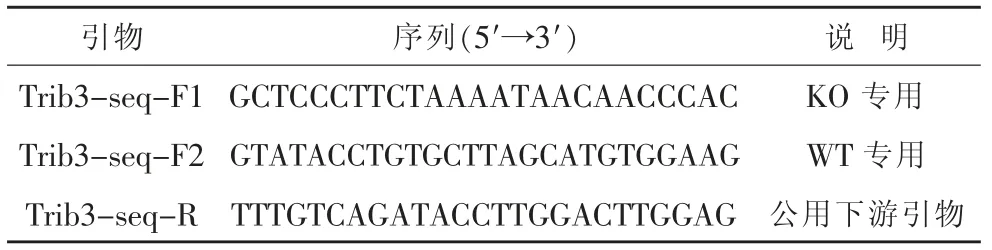
表1 基因型鑒定引物列表

表2 基因型判斷標準
(二)大鼠睪丸組織細胞體外共培養體系建立
實驗分為對照組和實驗組,對照組即未敲除基因的Wistar 雄鼠,實驗組為Trib3 基因敲除雄鼠,兩組同時進行睪丸組織細胞體外共培養。 隨機將20-25 日齡大鼠采用頸椎脫臼法處死,75%酒精浸泡10 分鐘,取出兩側睪丸,冰上75%酒精浸泡10 分鐘,用DPBS 清洗3 次以去除酒精,將清洗后的睪丸放在冰上含有4ml DPBS 的培養皿中,去除睪丸白膜和血管,放入加了雙抗的培養液中,把組織塊剪成大約2mm 小塊,轉移到含有4ml 培養液的60mm 培養皿中, 培養液中分別加入4μLVitamin A、Vitamin C、Vitamin E 等營養因子, 每個培養皿放10塊左右。 37℃,5%CO2的恒溫培養箱中培養。 每周換液3 次,觀察細胞狀態,出現成片細胞時同時收集細胞。
(三)RT-qPCR
收集培養皿中的細胞,提取兩組細胞總RNA,并測定其濃度和純度,RNA 反轉錄成cDNA,進行PCR 擴增。 引物序列表,見表3,GAPDH 為內參對照,設置反應條件:95℃30s,95℃5s,60℃30s,38 個循環。 每個樣本設置3個復孔,取平均值,采用2-ΔΔct的方法計算相對表達水平。
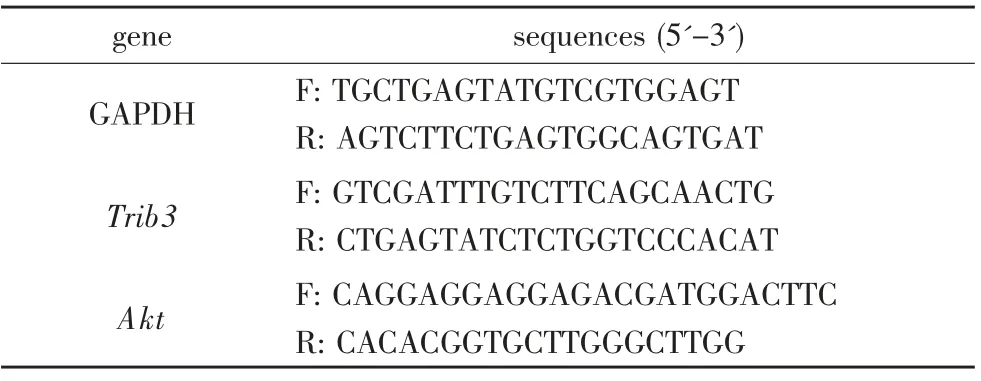
表3 RT-qPCR 所用引物序列
(四)Western blot
收集對照組和實驗組的細胞, 按照總蛋白提取試劑盒提取細胞總蛋白,利用BCA 法測定蛋白濃度。 進行SDS-PAGE 后將蛋白轉移至PVDF 膜,轉膜完成后,將膜置于5%脫脂奶粉中室溫封閉1h,一抗4℃孵育過夜,次日二抗室溫孵育1h。
(五)免疫共沉淀
按照免疫共沉淀試劑盒說明書操作。 利用兩步酶消法得到大鼠睪丸組織細胞, 經RIPA 裂解提取蛋白后,分為正向和反向免疫共沉淀組。 取下分離柱底塞,5000r 離心30s,1×Wash Buffer 洗兩次,將底塞塞回分離柱底部;按如下順序加樣:1×Wash Buffer 140μl、裂解液350μl、Antibody capture10μl 為 陰 性 對 照;1 ×Wash Buffer 130μl、裂解液350μl、TRIB3 抗體10μl、Antibody capture10μl 為 正 向 免 疫 共 沉 淀 組;1×Wash Buffer 130μl、 裂 解 液350μl、AKT 抗 體10μl、Antibody capture10μl 為反向免疫共沉淀組,4 ℃孵育過夜; 取下分離柱底塞, 離心1×Wash Buffer 洗3 次, 加入70μl1×Non-Denaturany Eluston Buffer 離心30s,最后收集到的洗脫液中即含有相互作用的蛋白質。 按照6 的步驟對蛋白質進行Western blot 分析。
三、統計學分析
數據采用SPSS 19.0 進行統計學處理,計量資料以均數±標準差表示,兩組均數比較采用t 檢驗,多個樣本均數比較采用單因素方差分析,P<0.05 為差異有統計學意義。
結 果
一、TRIB3 基因敲除結果及效果
瓊脂糖凝膠電泳結果顯示, 引物為Trib3-seq-F1+Trib3-seq-R 時,1、2、3、4、5 在333bp 處有條帶; 引物為Trib3-seq-F2+Trib3-seq-R 時,1、2、3、4、5 無產物, 表明1、2、3、4、5 為Trib3 基因敲除大鼠。 RT-qPCR 結果顯示,與對照組相比,Trib3 基因敲除組Trib3 mRNA 無表達(P<0.05),見圖1A、圖1B。
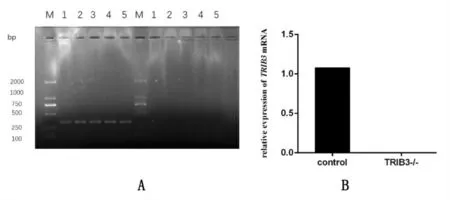
圖1 Trib3 基因敲除效果
(二)對照組和實驗組AKT 蛋白和mRNA 的表達
與對照組相比,Trib3 基因敲除組AKT 蛋白表達升高(P<0.05),見圖2A、圖2B,Akt mRNA 的表達水平升高(P<0.01),見圖3。

圖2 AKT 蛋白在對照組和實驗組中的表達(n=3)

圖3 Akt mRNA 在對照組和實驗組中的表達(n=3)與control 比較:***P<0.01
(三)免疫共沉淀法驗證TRIB3 與AKT 在細胞內相互作用
使用TRIB3 抗體對大鼠睪丸細胞蛋白裂解物進行免疫沉淀,然后使用AKT 抗體進行Western blot 分析,結果在復合物中檢測到AKT 蛋白。 隨后使用AKT 抗體對大鼠睪丸細胞蛋白裂解物進行反向免疫沉淀,發現免疫復合物中可檢測到TRIB3 蛋白。 在大鼠睪丸細胞中,TRIB3 和AKT 之間存在相互作用,見圖4。

圖4 免疫共沉淀結果
討 論
男性不育癥作為一種病因不明的異質性疾病,截止到現在全球至少有7%的男性受到影響[8]。 導致男性不育的原因有多種, 從細胞水平探究基因變化導致男性不育已成為近年來研究的熱點。
精子發生及成熟是一系列復雜的事件, 需要多種基因共同調控。 不同的生精細胞在曲細精管中按特定順序排列,構成了精子發生過程,分為三個階段:有絲分裂、減數分裂和精子發生[9]。
有研究發現Trib3 基因在精子發生初期差異性表達,這一時期正是精子發生開始[3]。TRIB3 在多種癌癥細胞中高表達[10]。 近年來,TRIB3 作為代謝性疾病和癌癥的生物標志物和治療靶點得到了積極的研究[11]。 一些研究表明,TRIB3 可與許多激酶依賴性蛋白結合,并通過負向調節其磷酸化來其功能減弱, 從而影響多種信號轉導途徑的激活[12]。
有研究表明TRIB3 的最佳功能是對AKT 活性的負調節, 一些證據表明,TRIB3 通過與AKT 的直接相互作用破壞Thr308 和Ser473 殘基的磷酸化[13], 敲低TRIB3 可升高AKT 蛋白磷酸化,從而激活AKT-mTOR信號通路, 抑制子宮內膜癌細胞增值[14]。 AKT 位于mTOR 信號通路上游,mTOR 信號通路對于調控男性生殖具有重要作用[15],本研究預測Trib3 在大鼠睪丸細胞中可能存在相似的作用機制,調節AKT-mTOR 信號通路進而影響精子發生過程, 但國內外尚未見男性生殖有關方面的報道。 為此,本實驗在前期構建Trib3 基因敲除大鼠, 構建大鼠睪丸組織共培養體系, 提取細胞, 進一步觀察TRIB3 水平與AKT 表達之間的關系;運用免疫共沉淀技術進一步確定兩種蛋白質在完整細胞內生理性相互作用[16]。研究結果表明,與對照組相比,敲除Trib3 基因可顯著升高AKT 蛋白和Akt mRNA 表達量,正向和反向免疫共沉淀法均證實TRIB3 與AKT在大鼠睪丸細胞內可形成復合物,為臨床靶向TRIB3 治療男性不育提供了實驗室證據。
但TRIB3 和AKT 蛋白之間是緊密結合還是短暫相互作用, 復合物如何調控睪丸細胞其他基因表達及其具體機制,尚需在后續實驗中加以完善。

