熱應激下大鼠Hspa2 基因啟動子區CpG 島甲基化狀態變化研究*
李 銳 陳雪丹 張慶華**
1.陸軍軍醫大學大坪醫院生殖醫學中心(重慶 400042)2.陸軍軍醫大學基礎醫學院醫學遺傳學教研室(重慶 400038)
前 言
熱休克蛋白A2 (heat shock protein A2,HSPA2)是一種在睪丸內部組成型高表達的蛋白, 其在精子發育中的關鍵作用已為大量研究所證實[1]。 本課題組前期研究顯示,熱應激條件下大鼠睪丸中HSPA2 的表達顯著下調[2],與Krawczyk 等[3]的研究結果一致,這很可能成為回答熱應激致精子發育功能損傷機制的一個關鍵突破口,但直到目前熱應激導致HSPA2 表達水平降低的內在機制不明。
表觀遺傳是指在DNA 序列不變的條件下,生物表型或基因表達發生穩定的可遺傳變化, 其涉及到多種不同的分子機制,包括DNA 甲基化、組蛋白共價修飾、染色質重塑及非編碼RNA 調控等, 其中DNA 甲基化是發現最早、研究最多的一種表觀遺傳修飾方式。 從整個生物界來說,DNA 甲基化可發生于胞嘧啶C-5 位、腺嘌呤N-6 位及鳥嘌呤N-7 位等點位,但發生在CpG 二核苷酸中胞嘧啶C-5 位的甲基化,則是動、植物等真核生物DNA 甲基化的主要形式,也是迄今為止發現的哺乳動物DNA 甲基化的唯一形式。CpG 二核苷酸在基因組中分布不均, 其中某些區段的CpG 二核苷酸保持或高于正常概率,形成所謂的CpG 島,其主要位于基因啟動子及第一外顯子區, 并在基因表達調控和染色質結構重塑等方面扮演重要角色。
既往研究[4]顯示,表觀遺傳機制可能是調控HSPA2表達的首要因素,而大量證據表明DNA 甲基化是調節人類細胞中HSPA2 表達最重要的表觀遺傳機制之一,在眾多乳腺癌、宮頸癌、膀胱癌和腎癌細胞系中均可檢測到HSPA2 基因甲基化[5,6]。 以DNA 甲基化抑制劑處理細胞系后,可觀察到HSPA2 基因轉錄水平升高,但過度甲基化則導致其表達水平降低[7]。這似乎表明,HSPA2基因的作用被過度甲基化所抑制, 但這一點目前尚存有爭議。 有研究認為, 原發性膀胱腫瘤中HSPA2 基因的抑制作用與過度甲基化相關[8],但另有研究發現HSPA2基因在膀胱癌細胞系和原發性尿路上皮腫瘤中均呈現高表達[9]。總之,DNA 甲基化在HSPA2 基因表達中發揮關鍵作用。
通過在線查詢UCSC 數據庫, 可見大鼠Hspa2 基因啟動子區也存在一個CpG 島, 熱應激是否可能通過此CpG 島區域的DNA 甲基化來介導Hspa2 基因的表達下調,這是一個極有意思的問題。 本課題組通過構建大鼠生殖系統的熱應激模型, 并運用甲基化特異性PCR(methylation specific PCR,MSP)和重亞硫酸鹽測序PCR(bisu-lfite sequencing PCR,BSP)檢測大鼠睪丸組織中Hspa2 基因啟動子區CpG 島的甲基化狀況, 試圖揭示熱應激條件下HSPA2 表達下調的內在機制。
材料與方法
一、樣品采集
動物模型建立、分組與高溫模型(熱應激組)建立,大鼠睪丸組織取材及保存方法參見本課題組前期研究[2]。
二、主要儀器與試劑
HOPE-MED 8150E 型特定環境智能型模擬實驗艙(天津合普公司),基因擴增儀(北京東勝創新生物科技有限公司),Gel Doc XR+凝膠成像系統(美國Bio-Rad公司),EPS 301 Power Supply 電源(美國GE 公司),多功能水平電泳槽HM-I 型 (大連競邁生物科技有限公司),組織基因組DNA 小量提取試劑盒(北京天漠科技開 發 有 限 公 司,TD325-50),EZ DNA 甲 基 化 試 劑 盒-GOLD (北京天漠科技開發有限公司,D5005),EpiTaq酶(日本Takara 公司,R110Q),OMEGA 膠回收試劑盒(美國Omega Biotek 公司,D2500-01),pMD 19-T Vector Cloning Kit(日本Takara 公司,6013),DH5α 感受態細胞(生工,B528413-0020),X-gal(美國Thermo Fisher Scientific 公司,R0404),IPTG (異丙基-β-D- 硫代半乳糖苷)(生工,A600168-0050)。
三、生物信息學分析
在線查詢UCSC 數據庫(http://genome-asia.ucsc.edu/cgi-bin/hgGateway?hgsid=1172038731_2dobyI1s0Y9jp I6aHMZWeFcAtRIO&redirect=manual&source=genome.ucsc.edu), 可見大鼠Hspa2 基因啟動子區有一個CpG島(如圖1 所示),其總長2670 bp(chr6:99,432,862-99,435,531),內含CpG 總數為217。

圖1 CpG 島在Hspa2基因啟動子區位置
四、大鼠睪丸組織基因組DNA 的提取
從熱應激組(含8 份睪丸組織樣本)和對照組(含8份睪丸組織樣本)各隨機選出5 份睪丸組織樣本,提取大鼠睪丸組織基因組DNA, 并運用紫外吸收法測定所提取的基因組DNA 溶液濃度。
五、大鼠睪丸組織基因組DNA 的C-U 轉換
熱應激組和對照組每個DNA 樣品取200 ng,體積不足20ul 的,用雙蒸水補平,具體見表1。使用EZ DNA甲基化試劑盒-GOLD 法得到經重亞硫酸鹽處理 (即C-U 轉換)并純化的基因組DNA 溶液。
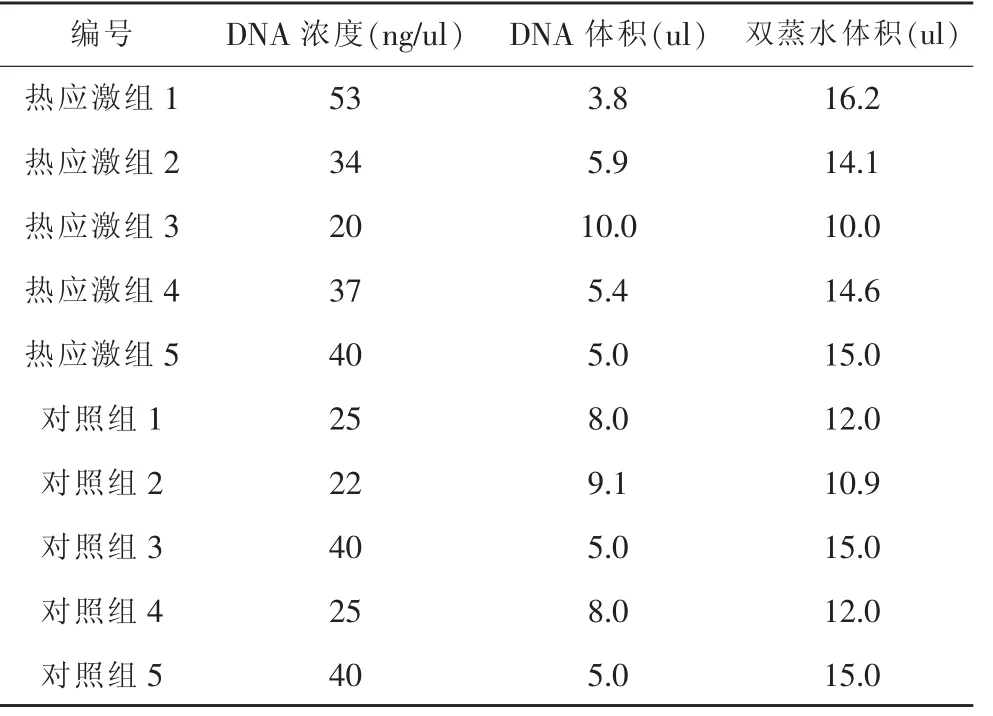
表1 各DNA 樣品濃度、200ng DNA所取體積及雙蒸水體積
六、MSP 法檢測大鼠睪丸組織中Hspa2 基因啟動子區CpG 島的甲基化
以大鼠Hspa2 基因啟動子區CpG 島的序列為模板,運用Methyl Primer Express v1.0 軟件設計針對甲基化和非甲基化序列的引物,如表2 所示,所有引物均由擎科新業生物技術有限公司合成。 以經重亞硫酸鹽處理(即C-U 轉換)并純化的基因組DNA 為模板,根據EpiTaq 酶法進行普通PCR(反應體系50 ul,反應條件:94℃預變性20 秒;94℃20 秒,53℃30 秒每完成一輪循環降低0.5℃,72℃60 秒,共10 個循環;94℃20 秒,48℃30 秒,72℃60 秒,共25 個循環)。 PCR 結束后,對反應終產物進行瓊脂糖凝膠電泳, 之后將凝膠自電泳糟取出,置于Gel Doc XR+凝膠成像系統照相。

表2 MSP 引物序列及擴增產物長度
七、BSP 法檢測大鼠睪丸組織中Hspa2 基因啟動子區CpG 島的甲基化
與MSP 相類似, 運用Methyl Primer Express v1.0軟件設計針對BSP 的引物, 如表3 所示, 除引物與MSP 不同外,BSP 其余反應體系及熱反應程序設置與MSP 完全一致。PCR 結束之后,將反應液進行瓊脂糖凝膠電泳。 根據Marker 指示,運用OMEGA 膠回收試劑盒法割膠提取目的DNA 擴增產物,隨后將回收的目的DNA 片段連接至pMD 19-T Vector,并以連接產物轉化DH5α 感受態細胞。將轉化后的DH5α 感受態細胞置入無抗生素的LB 培養基,37℃振蕩培養60 分鐘進行擴增,取適量菌液接種至含X-gal 及IPTG 的氨芐平板,用玻璃棒涂抹均勻,37℃放置14h。待菌落長出后,每個平板挑選10 個白色菌落,以37℃振蕩培養過夜,最后菌液送擎科新業生物技術有限公司進行測序(一代測序)。

表3 MSP 引物序列及擴增產物長度
八、數據分析
使用Vector NTI Advance 11.5.1 對BSP 測序結果進行比對分析,并將序列中的CpG 位點,根據其甲基化狀態的不同,繪制成黑白圈點圖(黑色代表甲基化,白色代表非甲基化)。 使用SPSS 20.0 對數據作統計分析。本研究涉及到熱應激組和對照組,為兩組獨立樣本,要比較的是兩組甲基化率的差異, 可以整理為四格表資料,根據單元格理論頻數的實際情況,采用Pearson χ2檢驗,連續性校正χ2檢驗或Fisher 確切概率法檢驗。檢驗結果的解讀:P >0.05 為差異不顯著, 結果無統計學意義;P <0.05 為差異顯著,P <0.01 為差異極顯著,此二者均具統計學意義。
結 果
一、MSP 法檢測大鼠睪丸組織中Hspa2 基因啟動子區CpG 島的甲基化情況
從瓊脂糖凝膠電泳的結果來分析, 無論是使用甲基化引物,還是非甲基化引物,熱應激組和對照組,都能成功擴增出目的DNA 片段,從所拍的片子上均可以看到清晰明亮的條帶,如圖2A、圖2B 所示。 這說明,對兩組DNA 樣本而言,甲基化引物(或非甲基化引物)所在區域的CpG 位點, 其甲基化與非甲基化狀態是同時存在的,也就是都存在部分甲基化,但無從得知二者之間的分布比例。 因此,通過MSP 尚難以判斷熱應激是否會導致CpG 位點的甲基化狀態發生顯著改變。
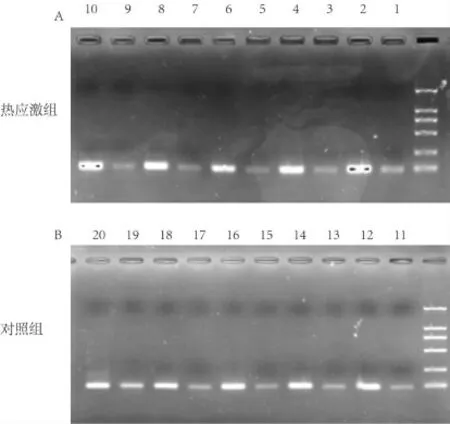
圖2 熱應激組與對照組MSP 終產物凝膠電泳圖
二、BSP 法檢測大鼠睪丸組織中Hspa2 基因啟動子區CpG 島的甲基化情況
熱應激組及對照組共10 個DNA 樣本, 每個樣本選擇10 個陽性單克隆(依次編號為1-10)進行DNA 測序。從返回的數據來看,只有一個陽性單克隆(對照組4號樣本的第2 個陽性單克隆) 測序失敗, 測序成功99個。 使用Vector NTI Advance 11.5.1 軟件對測序成功的數據進行比對分析后發現, 一部分單克隆并不含目的DNA 片段,另一部分單克隆可能僅含空載體,將這一部分數據予以剔除。
熱應激組實際有效的單克隆為:1 號樣本的(1-2、1-3、1-4、1-6、1-7、1-9、1-10)號單克隆;2 號樣本的(2-3、2-5、2-6、2-8、2-9、2-10)號單克隆;3 號樣本的(3-1、3-2、3-3、3-4、3-5、3-7、3-8) 號單克隆;4 號樣本的(4-1、4-3、4-5、4-8、4-10)號單克隆;5 號樣本的(5-1、5-2、5-7、5-8、5-9、5-10)號單克隆。
對照組實際有效的單克隆為:1 號樣本的(1-1、1-3、1-5、1-7、1-8)號單克隆;2 號樣本的(2-2、2-4、2-5、2-10)號單克隆;3 號樣本的(3-1、3-2、3-3、3-4、3-5、3-6、3-10)號單克 隆;4 號 樣 本 的(4-1、4-2、4-4、4-5、4-6、4-7、4-8、4-9、4-10)號單克隆;5 號樣本的(5-1、5-3、5-4、5-10)號單克隆。
經BSP 擴增的目的DNA 片段長為259 bp,內含22個CpG 位點。根據Vector NTI Advance 11.5.1 軟件比對結果,針對熱應激組和對照組每一個樣本的不同有效單克隆,繪制黑白圈點圖(黑色代表甲基化,白色代表非甲基化),如圖3A、圖3B 所示。從比對的整體結果來看,熱應激組和對照組發生甲基化的CpG 位點均較少, 且分布不規律,無法針對單個CpG 位點進行差異性分析。本課題組以22 個CpG 位點作為整體進行分析,比較熱應激組和對照組在這22 個CpG 位點甲基化率的差異。由于熱應激組和對照組各個樣本有效單克隆的數目不盡相同,為提高數據分析質量,我們從有效單克隆在4 個以上的樣本中隨機抽取4 個,保證所有樣本有效單克隆的數目一致,均為4 個。熱應激組和對照組各含20 個有效單克隆,440 個CpG 位點, 其中熱應激組發生甲基化的CpG 位點總數為6, 對照組發生甲基化的CpG 位點總數為7。在四格表卡方檢驗中,所有單元格理論頻數均大于5,且樣本例數大于40,可以直接讀取Pearson χ2檢驗的結果,χ2=0.078,P=0.780,P >0.05,差異無統計學意義。 因此, 熱應激組和對照組在BSP 所擴增的目標DNA 片段內,其甲基化率沒有明顯差異(P >0.05)。
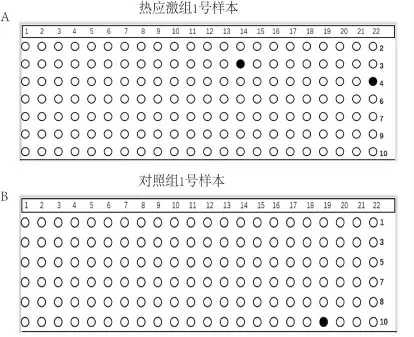
圖3 熱應激組與對照組各樣本有效單克隆CpG 位點的黑白圈點圖(黑色代表甲基化,白色代表非甲基化)
討 論
大量證據顯示,HSPA2 在精子發育過程中發揮重要作用, 其表達失調或功能障礙都會顯著影響精子發生,并最終引發不育[1]。 既往研究表明,熱應激下精子濃度顯著降低,精子活性及運動能力受損[10],而精子頭部的某些性狀也可發生改變,并直接影響受精[11],但其內在機制不明。 有證據顯示,熱應激可通過一系列途徑引發生精細胞凋亡[12-14],但這些研究僅能從一定角度說明精子數量減少的根本原因, 很難解釋熱應激所致的精子活性及運動能力損傷。
本課題組前期研究發現, 熱應激可導致大鼠睪丸中HSPA2 表達水平降低[2],這是一個非常有意思的發現, 同時也為熱應激致精子發育受損的內在原因提供了一個可能的解釋。 但熱應激條件下HSPA2 表達下調的本質原因卻不清楚。 既往研究表明,表觀遺傳機制可能是調控HSPA2 表達的首要因素[4],而DNA 甲基化則是調節人類細胞中HSPA2 表達最重要的表觀遺傳機制之一[5,6]。 本研究試圖通過已經構建的大鼠生殖系統的熱應激模型,運用MSP 和BSP 技術去探索甲基化在熱應激致HSPA2 表達下調過程中可能發揮的作用。
從本次實驗MSP 的結果來看,熱應激組和對照組的所有DNA 樣本,在MSP 所研究的區域(即引物結合區域)都同時存在著甲基化和非甲基化兩種狀態。 由于MSP 的局限性, 還難以判斷熱應激是否引起甲基化狀態的變化。 但可以推測,熱應激組和對照組可能存在甲基化率的差異,這是BSP 要回答的問題。
從本實驗BSP 的結果分析, 熱應激組和對照組在BSP 目標擴增區域的甲基化率都很低, 且差異無統計學意義(P >0.05)。
綜合MSP 和BSP 的結果來看,熱應激在短時間內導致HSPA2 的表達下調, 可能不是通過DNA 的甲基化修飾來實現的, 盡管甲基化是由甲基轉移酶來催化完成的(從理論上說,這個過程并不需要很長時間)。 但同時需要注意的是,本次BSP 實驗涉及的259 bpDNA 片段只是全長2670bp 的CpG 島中很小一段區域, 因此不能完全排除熱應激通過甲基化修飾來下調HSPA2 表達的可能性。如前所述, 在眾多腫瘤細胞系中檢測到了HSPA2 基因甲基化,且多數研究顯示,這種甲基化導致了HSPA2 表達水平降低。但甲基化在這些腫瘤細胞系中發生的內在原因是未知的。 盡管如此,我們可以推測,HSPA2 基因甲基化很可能與HSPA2 表達水平降低高度相關。
總而言之,熱應激致HSPA2 表達下調的機制可能是多方面的, 甲基化修飾是可能的機制之一。 直到目前, 關于HSPA2 表達調控機制的研究還非常有限,究竟是轉錄調控為主,還是表觀調控為主,都還具有極大的不確定性。
毫無疑問, 對HSPA2 表達調控機制的深入研究是有重大意義的,這對于解決諸多因HSPA2 表達或功能失常所致的不育問題大有裨益。同時,有助于我們更好地認識熱應激致HSPA2 表達下調的深層原因,對于推動解決熱應激致精子發育損傷的問題也是有重大幫助的。

