以準Cu-BTC作為類芬頓體系催化劑催化氧化NO的性能研究
李 貞,葉中洲,李 根,于金鑫,趙松建
(江蘇理工學院資源與環境工程學院,江蘇 常州 213001)
十九世紀六十年代以來,在人們的日常生產生活過程中產生大量的氮氧化物[1],從而使空氣中的NOx含量增加,對生態系統和人類健康造成嚴重的危害[2]。2013年由國務院發布的《大氣污染防治行動計劃》明確指出要加快工業脫硫、脫硝、除塵等技術的研發與成果轉化應用,要加快重點行業脫硫、脫硝、除塵改造工程建設。但目前處理工藝仍存在很多不足,導致廢氣無法達到排放標準。
工業中干法脫硝去氮氧化物應用最為廣泛,其中SCR[3]是目前比較成熟的工藝,但因其成本較高,操作復雜,低成本的濕法脫硝技術的研究就顯得比較重要,其中芬頓體系大量使用于工業中。芬頓過程[4]由于羥基自由基的產生而引起了越來越多的關注具有高氧化電位(E0=2.8 V)來自過氧化氫(H2O2),但是均相芬頓體系在高pH條件下會產生鐵泥造成二次污染,異相芬頓不受pH限制,催化效果更好,比均相芬頓應用潛力更大。多相催化劑可以有效活化H2O2形成·OH用于降解有機污染物[5]。但是多相催化芬頓也表現出許多缺點,例如制備復雜,催化劑塌縮、團聚和強酸性pH下泄漏的多步驟/復雜技術[6]。
金屬有機骨架材料[7](Metal-Organic Frameworks,MOFs)有著優越的比表面積、結晶度、可調性、孔隙度和分散性,以及豐富的拓撲結構[8]。Cu-BTC,是一種具有代表性的MOF[9],其不飽和金屬位點可與碳氫化合物分子接觸,并且這些位點可在不影響底層骨架結構的情況下進行調整,這種材料在開放金屬場所對高能氣體表現出優異的吸附性能[10],并且在催化[11]、氣體儲存[12]等方面有廣泛應用。Cu-BTC的性能在很大程度上取決于其合成條件,不同的反應溫度、反應時間和后處理方法不僅會影響吸附分離能力,還會影響催化能力[13]。
本研究通過準Cu-BTC作為類芬頓催化劑以異相芬頓氧化法對NOx進行處理,準Cu-BTC是300 ℃的管式爐在氮氣保護下鍛燒1 h Cu-BTC制備,相比Cu-BTC其具有水/熱穩定性更高、催化性能優良的優點。利用SEM、XRD、FT-IR、TGA等表征方法分析其物理化學特性;通過煙氣分析系統考察準Cu-BTC的NOx去除性能,探究不同空速、pH值、溫度、物料比等因素的影響,篩選準Cu-BTC去除NOx的最佳的反應條件以及工藝參數;同時探討準Cu-BTC去除NOx的反應機理,為開發新型高效、經濟、穩定的脫硝催化劑奠定了基礎。
1 實 驗
1.1 試劑與儀器
三水合硝酸銅,上海麥克林生化科技有限公司;1,3,5-苯三甲酸(純度98%),上海麥克林生化科技有限公司;聚乙二醇,上海麥克林生化科技有限公司;N,N-二甲基甲酰胺,上海凌峰化學試劑有限公司;無水乙醇,上海凌峰化學試劑有限公司;氨水,上海凌峰化學試劑有限公司;氯化銨,上海凌峰化學試劑有限公司;乙二胺四乙酸二鈉,上海凌峰化學試劑有限公司;硝酸,上海凌峰化學試劑有限公司;七水合硫酸亞鐵,無錫市凱爾化工產品有限公司;PAN標準指示劑(純度1 g/L),以達科技(泉州)有限公司。上述藥品未單獨標明的均為分析純,使用前并無進一步純化。
PTX-FA110電子分析天平,華志(福建)電子科技有限公司;HP-WF5催化評價裝置,南京皓而普分析設備有限公司;NXA-5空氣發生器,上海諾析儀器有限公司;NXN-500氮氣發生器,上海諾析儀器有限公司;FGA10煙氣分析儀,深圳市貝特分析儀器有限公司;500 ml鼓泡反應器,北京博美玻璃有限公司;AdvanceD8型X射線衍射儀,德國Bruker公司;VG Multilab 2000X射線光電子能譜儀,VG公司;JEM-2010HT透射電子顯微鏡,日本電子株式會社;Nicolet IR 200傅里葉紅外光譜儀,美國Thermo Fisher公司;熱重分析儀,美國Thermo Fisher公司、費爾伯恩精密儀器有限公司。
1.2 催化劑的制備
(1)Cu-BTC材料以及Cu-BTC衍生物制備:依據Cu-BTC傳統制備方法[14],以Cu(NO3)2·3H2O作為銅源,取2.078 g溶于20 mL去離子水中;以1,3,5-苯三羧酸(H3BTC)作為有機連接劑的來源,取1.056 g將其溶于40 mLN,N-二甲基甲酰胺(DMF)與無水乙醇1:1溶劑,兩溶液混合后攪拌0.5 h。然后將混合樣品于110 ℃下的高壓釜中持續反應18 h。溶液冷卻到室溫后,用N,N-二甲基甲酰胺(DMF)與無水乙醇1:1混合溶劑洗至干凈,最后在110 ℃真空干燥箱中烘干得到藍色Cu-BTC材料。用300 ℃的管式爐在氮氣保護下鍛燒1 h,獲得Cu-BTC-1催化劑。
(2)CuO 制備:CuO是通過使用一種已報道的方法合成的。首先,取2.416 gCu(NO3)2·3H2O溶于60 mL蒸餾水中。然后取0.0125 g聚乙二醇溶于30 mL蒸餾水中,將兩溶液混合。在攪拌下緩慢加入80 mL10%氨水溶液。將形成的沉淀用無水乙醇離心洗滌,然后干燥12 h,最后于500 ℃下煅燒2 h,得到CuO。
1.3 材料表征
催化劑的X-射線衍射表征在X射線衍射儀(AdvanceD8,德國)上進行,掃描范圍為5°~80°。通過分析,研究得到的催化劑的骨架結構。催化劑的形貌結構通過Elyra 7高分辨場發射掃描電鏡來分析檢測。吸附劑的紅外光譜測試通過Nicolet IR 200傅里葉紅外光譜儀完成,采用KBr壓片,掃描波段4000~400 cm-1,分析Cu-BTC是否合成成功以及Cu-BTC-1是否還保留有機三維骨架。催化劑隨溫度改變的重量損失實驗由BOEN-021105熱重分析儀進行測試,測試樣品的溫度范圍為30~600 ℃。以配制的EDTA標準溶液作為滴定銅離子的滴定劑,使用氨緩沖溶液調節pH,滴加2~5滴PAN標準指示劑。取不同時間的催化劑水溶液,測定催化劑的水穩定性。
1.4 NO去除性能評價
配置一定濃度的H2O2溶液500 mL,轉移至鼓泡反應器中,反應體系溫度改變由水浴鍋控制,反應溶液的初始pH值由提前配置的硝酸溶液和NaOH溶液調節,反應系統為鼓泡反應器,氣體經反應器中的吸收液鼓泡,在該過程中完成NO的催化氧化。模擬煙氣組分由N2、O2、NO組成,組分氣體由質量流量計控制比例,進入催化裝置混合后形成模擬煙氣,尾氣有干燥管及尾氣吸收瓶處理后排放。每次實驗開始之前,混合后的模擬煙氣流經鼓泡式反應器旁通,在氣流穩定后,煙氣分析儀測量出NO的起始濃度NOin;將制備的催化劑投入到鼓泡反應器中,再通過管道輸送到反應器的反應路徑。用煙氣分析儀對反應路出口氣體濃度NOout[16]進行監測。NO的氧化效率可如下計算:
式中:Eoxi——NO氧化效率,%
NOin——NO反應前初始濃度,mg/kg
NOout——NO反應后最終濃度,mg/kg
2 結果與討論
2.1 表征分析

圖1 Cu-BTC及Cu-BTC-1材料的SEM及其EDS譜圖Fig.1 SEMand EDS spectra of Cu-BTC and Cu-BTC-1 materials
對合成的材料進行了SEM表征。圖1(a)是本實驗制備的Cu-BTC催化劑,SEM圖顯示Cu-BTC催化劑顯然具有空間八面體結構,這與文獻[17]中報道的一致,結合Cu-BTC催化劑的EDS圖可以看出Cu2+的確和H3BTC中的羧酸根結合,并且Cu2+均勻的分散在有機骨架中,這表明本實驗中合成的Cu-BTC催化劑成功。圖1(g)為Cu-BTC材料在氮氣氣氛中煅燒得到的Cu-BTC-1催化劑的SEM圖,從圖中可以看出經過煅燒后的Cu-BTC-1催化劑仍然呈現出八面體結構,并且八面體晶體比Cu-BTC催化劑的表面更加光滑。Cu-BTC-1催化劑的EDS圖顯示出與Cu-BTC催化劑同樣的元素分散度,說明氮氣中煅燒之后Cu-BTC的基本結構并未遭到破壞。Cu-BTC-1催化劑的八面體結構比Cu-BTC催化劑更光滑,說明Cu-BTC經過煅燒之后結晶度更高,可能是因為在一定溫度下,水合作用增強,配體的去離子度變小,更有利于形成八面體結構。圖1(g)中出現了不完整的八面體結構,這可能是部分有機骨架的坍塌,從而形成微孔或介孔結構的結晶體,這不僅產生更多的活性中心,而且還可以增加傳質速度。
圖2顯示Cu-BTC及Cu-BTC-1催化劑主要失重溫度為40~360 ℃。Cu-BTC及Cu-BTC-1催化劑從起始溫度到140 ℃損失了大約5%的重量,該階段除去催化劑吸附的水蒸氣以及空氣。在140~300 ℃之間Cu-BTC-1催化劑出現了一個平臺,該階段發生了放熱過程,即Cu-BTC-1催化劑的再生階段,在該溫度范圍可以保持穩定的結構。相比之下,Cu-BTC催化劑在該溫度范圍穩定性沒有Cu-BTC-1好。在煅燒之后是可以提高Cu-BTC催化劑的穩定性,這可能是在氮氣氣氛中煅燒之后Cu-BTC結晶度增大所導致。
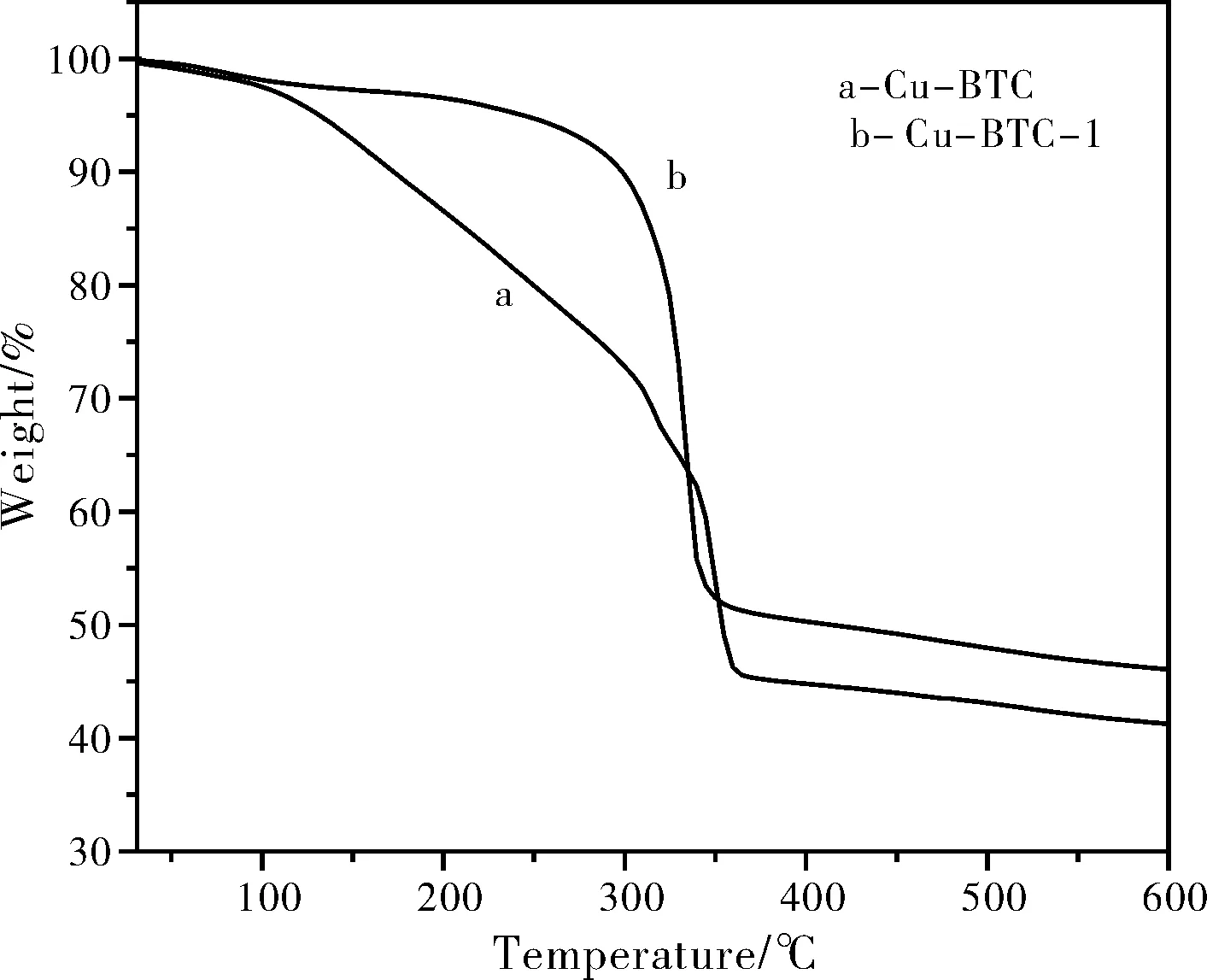
圖2 Cu-BTC及Cu-BTC-1的TGA分析Fig.2 TGA analysis of Cu-BTC and Cu-BTC-1

圖3 Cu-BTC及Cu-BTC-1的XRD分析Fig.3 XRD analysis of Cu-BTC and Cu-BTC-1
圖3為Cu-BTC及Cu-BTC-1催化劑的XRD譜圖,掃描角度范圍為5°~80°。Cu-BTC材料的出峰位置與文獻[18]非常匹配,這一結果表明合成的Cu-BTC催化劑具有良好的結晶度。Cu-BTC-1材料在9.5°、11.65°也有出峰,這是Cu-BTC材料的特征峰,這表明本實驗中煅燒得到的Cu-BTC-1催化劑仍保留了Cu-BTC材料的結構,這與上述SEM分析及TGA分析得到的結果一致。此外,Cu-BTC-1催化劑在42.4°出現了CuO的特征峰,在73.7°出現了Cu2O的特征峰。
圖4為Cu-BTC及Cu-BTC-1催化劑的IR譜圖,Cu-BTC的IR譜圖與文獻[20]一致,在1650 cm-1附近出現C=O的不對稱伸縮振動,由于H3BTC與Cu2+的配位使得H3BTC中的電子云平均化,因此C=O的峰出現了紅移。Cu-BTC-1催化劑的IR譜圖與Cu-BTC出峰位置基本一致,同樣可以表明Cu-BTC-1催化劑保留了有機骨架。此外,Cu-BTC-1催化劑的IR譜圖在550 cm-1出峰,該處為Cu-O鍵的特征峰,Cu-BTC-1的晶體中出現了Cu的氧化物。

圖4 Cu-BTC和Cu-BTC-1的FT-IR譜圖Fig.4 FT-IR spectra of Cu-BTC and Cu-BTC-1
2.2 NO去除性能評價

圖5 相同條件下的不同催化劑的NO去除活性Fig.5 NO removal activities of different catalysts under the same conditions
圖5顯示了不同催化劑在室溫25 ℃,且氣體流量、NO濃度等條件相同下對NO催化氧化的性能曲線。以Fe2+為催化劑的均相芬頓體系催化氧化NO效率明顯低于異相芬頓體系,均相芬頓體系在催化劑投入的初始階段有較高的氧化效率,隨后效率降低,維持在10%左右。這可能是因為初始階段大量催化劑與H2O2溶液反應,瞬間產生的羥基自由基較多,所以效率較高。隨著反應的進行,Fe3+/Fe2+電對建立平衡,反應較為穩定,羥基自由基穩定生成,但是含量沒有初始階段高,所以效率下降但穩定。異相芬頓體系的催化效率都是逐漸上升隨后維持穩定,由于活性位點不能像均相芬頓體系一樣與H2O2溶液直接接觸,因此固體催化劑的電對平衡建立需要時間,所以會出現上升的趨勢。當電對平衡建立之后,催化效率趨于穩定。異相芬頓體系催化效率高于均相芬頓體系,一方面是因為Cu2+/Cu+電對的轉化效率高于Fe3+/Fe2+電對,可以從標準電極電勢看出,銅電對的標準電極電勢低于鐵電對。另一方面,固體催化劑可以在晶體中高效傳遞電子,并維持基本晶體結構,所以具有持續的催化性能。Cu-BTC-1的催化效果優于Cu-BTC催化劑,這可能是由于經過煅燒后Cu-BTC-1暴露出更多的銅活性位點,有利于反應的進行。
H2O2溶液的濃度為0.1 mol/L,氣體流量為200 mL/min,NO的初始濃度為200 mg/kg,改變Cu-BTC-1催化劑的投入量影響去除NO效率所得結果如圖6所示。隨著Cu-BTC-1催化劑的投入量增加,NO的氧化效率也隨之提高,在投料比為1:100效率最大,當投料比為1:200時效率下降。對于本實驗可以確定投料比為1:100最佳。

圖6 不同投料比對NO去除效果的影響Fig.6 Influence of different feeding ratios on NO removal effect
考慮到傳統均相芬頓體系受到pH的限制嚴格,因此本實驗針對pH對NO的催化氧化影響進行了考察,結果如圖7所示。在pH為2~4即強酸性環境下催化氧化的效率較低,主要是由于Cu-BTC-1催化劑在強酸性水溶液中的不穩定性。在pH為5~8催化效率較高,當pH超過9之后H2O2溶液在強堿性環境就會自分解,從而反應底物減少,效率下降。

圖7 不同pH對NO去除效果的影響Fig.7 Effect of different pH on NO removal effect
本課題考慮了不同氣體流量下的Cu-BTC-1催化劑催化效率,如圖8顯示,Cu-BTC-1催化效率都是先升后降,在反應一段時間后,催化效率趨于穩定。這可能是因為催化劑在反應前期不僅具有催化能力,準MOF的特殊結構還有一定的吸附能力,隨著反應的進行,催化劑吸附達到飽和。隨后催化劑達到吸附平衡,催化性能也趨于穩定。從該圖8可以看出氣體流量為100 mL/min時Cu-BTC-1催化效率最好,這主要是因為氣體流量較低時NO可以在反應體系中與反應物充分接觸,傳質時間增加,有利于提高該體系的氧化效率。

圖8 不同氣體流量對NO去除效果的影響Fig.8 Influence of different gas flow rates on NO removal effect
如圖9顯示,NO初始濃度為300 mg/kg時,該體系氧化效率最高。隨著NO初始濃度的增加,Cu-BTC-1催化效率隨之升高,在NO初始濃度在300 mg/kg時達到峰值。NO初始濃度超過300 mg/kg之后該體系氧化效率隨NO初始濃度升高而降低。在NO濃度較低情況下,反應體系傳質接觸量較少,NO在水中溶解度低,NO并未來得及進入反應位點就離開反應體系,造成氧化效率較低。在NO濃度較高時增加了分子之間的斥力,NO分子之間相互競爭催化位點,大量的NO分子不能和羥基自由基反應就逸出,造成效率降低。

圖9 不同NO初始濃度對催化效率的影響Fig.9 Effect of different initial concentrations of NO on catalytic efficiency

圖10 不同溫度對催化效率的影響Fig.10 Influence of different temperatures on catalytic efficiency
不同溫度對類芬頓體系氧化效率有一定影響。如圖10顯示隨著溫度的升高,該體系的氧化效率隨之提高,在60 ℃條件下效率達到90%左右。本課題選取溫度范圍為25~60 ℃,該溫度范圍比較切合實際。H2O2溶液由于自身的不穩定性,在50 ℃條件下就有分解,在70 ℃分解率可以達到90%,因此本實驗溫度最高選取為60 ℃。隨著溫度的升高,反應物得到外界能量變成活化分子,提高了氧化效率。
對Cu-BTC-1催化劑反應前后進行了XRD分析,結果如圖11所示。取反應30 min后的Cu-BTC-1催化劑得到的XRD圖像與未反應的Cu-BTC-1進行對比可以發現,經過反應之后Cu-BTC-1在9.5°、11.65°仍有出峰,表明反應后的催化劑結構仍保留了一部分的MOFs結構,但9.5°位置的峰明顯變弱,表明在反應過程中催化劑的MOFs結構出現了一部分的坍塌。這可能是由于在反應過程中催化劑產生銅離子電對發生催化作用的時候部分銅離子從催化劑晶體中逸出而造成的,但是大部分晶體結構仍能保持說明Cu-BTC-1催化劑具有良好的穩定性。

圖11 Cu-BTC-1在反應前后的XRD表征Fig.11 XRD characterization of CU-BTC-1 before and after the reaction

圖12 Cu-BTC與Cu-BTC-1水穩定性比較Fig.12 Comparison of water stability between Cu-BTC and CU-BTC-1
MOFs材料水穩定性普遍較差,因此本實驗對合成的Cu-BTC催化劑以及Cu-BTC-1催化劑的水穩定性進行了比較,結果如圖12所示。Cu-BTC催化劑在15 min時就出現了84%的分解率,即在水中很快就出現了有機骨架的坍塌或者可能是在水中H3BTC離子發生了質子化,使得銅離子與H3BTC離子解離,造成的分解率較高。在水中存在120 min后,銅離子基本全部從有機骨架中釋放,表明此時Cu-BTC催化劑的有機骨架的確發生了坍塌。相比之下Cu-BTC-1催化劑在15 min時分解率僅有26%,遠低于Cu-BTC催化劑的分解率。在水中浸泡24 h之后Cu-BTC-1催化劑的分解率才達到70%,可見經過煅燒之后Cu-BTC-1并未出現MOFs材料易水解的情況,水穩定性得到了較大的提升。
3 結 論
本研究選取金屬有機材料中常用催化劑Cu-BTC,在300 ℃的管式爐在氮氣保護下鍛燒1 h獲得準Cu-BTC。將合成出來的催化劑應用在以鼓泡反應器為基礎的芬頓體系中,進行NO催化氧化性能評價。
實驗對比發現在相同條件下準Cu-BTC表現出比傳統均相芬頓體系及異相芬頓中Cu-BTC催化劑具有更好的催化性能,并且準Cu-BTC的水/熱穩定性明顯優于Cu-BTC,經過煅燒之后的Cu-BTC催化劑仍然保留一部分的有機骨架,且Cu2+與H3BTC離子的進一步結合,增強了催化劑的結晶度。其機理可能是因為準Cu-BTC在芬頓體系中產生了Cu2+/Cu+電子對傳遞電子,以促進H2O2產生羥基自由基而發揮催化作用。綜上所述,準Cu-BTC比傳統Cu-BTC有著更好的催化性能和水/熱穩定性,為解決實際工業化濕法脫硝提供了指導作用。

