口服營養補充劑對乳腺癌術后化療患者腸黏膜屏障功能及營養情況的影響*
薛 姣,代建波,高海燕,楊方亮,呂國君△
(1.南京醫科大學附屬常州第二人民醫院普通外科,江蘇 常州 213000; 2.蘇州大學附屬常州市第四人民醫院乳腺外科,江蘇 常州 213000)
乳腺癌在全世界成年女性癌癥發病率中排名首位。2020年Cancer Statistics全球腫瘤數據顯示,全球每年有2 621 419 例新發乳腺癌患者,占新發腫瘤患者總數的11.7%[1]。在我國,乳腺癌發病率也呈逐年上升趨勢,在一線大城市中,乳腺癌在女性惡性腫瘤發病率中位于首位[2]。
乳腺癌綜合治療中輔助化療已成為不可或缺的重要治療手段。有研究表明,術后輔助化療可使乳腺癌患者長期生存率得到明顯改善[3-4]。環磷酰胺聯合表阿霉素貫序方案(EC-T)是最常見的基礎化療方案[5]。根據以往的臨床經驗,腫瘤化療藥物容易引起患者的腸道黏膜屏障受損,通常表現為腹瀉、營養不良等,盡管并不影響患者的化療效果,卻降低了化療耐受度及生活質量,易導致化療方案失敗。腫瘤術后患者使用口服腸內營養能有效改善其營養狀況,近年來,大量研究表明,腸內營養是保護腸黏膜屏障功能的最有效的方法之一[6-9]。腫瘤術后患者使用口服腸內營養獲益有廣泛的研究基礎,而對1個EC-T化療周期的腸黏膜屏障功能的變化狀態及EC-T化療方案對腸黏膜屏障功能的長期影響尚未見相關文獻報道。本研究著重探究了乳腺癌術后接受EC-T方案化療患者在首個EC-T治療周期中腸黏膜屏障功能及營養狀態的變化。此外,本研究引入口服營養補充劑(ONS)的方案,探討了患者在接受ONS后對腸黏膜屏障功能、營養狀態變化的影響,旨在為乳腺癌化療患者耐受度和生活質量改善提供潛在的營養支持方案。
1 資料與方法
1.1資料
1.1.1一般資料 選取2019年12月至2020年12月南京醫科大學附屬常州第二人民醫院收治的乳腺癌根治術后單側乳腺癌患者80例,患者均已達到化療指征并同意EC-T化療。按照接受度分為研究組和對照組,每組40例。2組患者年齡、體重指數(BMI)、TNM腫瘤分期等一般資料比較,差異均無統計學意義(P>0.05)。見表1。本研究獲醫學倫理委員會批準(〔2018〕KY023-01)。

表1 2組患者一般資料比較
1.1.2納入標準 (1)年齡18~65歲;(2)符合2018年國際抗癌聯盟/美國癌癥聯合委員會TNM腫瘤分期標準[10],屬于Ⅱ~Ⅲ期;(3)化療前采用整體營養狀況評估量表(PG-SGA)評估為營養良好;(4)對本研究治療及營養方案知情并簽字同意參與。
1.1.3排除標準 (1)患有低蛋白血癥、佝僂病等營養發育不良疾病;(2)患有腸道慢性炎癥及其他腸功能異常的疾病;(3)肝、腎功能障礙;(4)患有免疫系統、血液系統疾病;(5)對化療方案嚴重不耐受;(6)因非醫學原因中斷化療者。
1.1.4剔除標準 (1)出現明顯的腸內營養禁忌證,如惡心、嘔吐、消化道梗阻、消化道出血等;(2)腫瘤病情惡化或生命體征不穩等;(3)患者因吞咽問題或營養制劑口感不適等導致腸內營養攝入顯著下降(超過50%);(4)自愿退出本研究者。
1.2方法
1.2.1治療方法
1.2.1.1化療方案 2組患者均接受EC-T治療,給予表阿霉素(瀚暉制藥有限公司,批準文號:國藥準字 H19990280,規格:10 mg) 80 mg/m2,于療程第1天靜脈滴注[11],環磷酰胺(南通精華制藥有限公司,批準文號:國藥準字 H32020796,規格:50 mg)500 mg/m2,于療程第1天靜脈滴注。
1.2.1.2腸內營養方案 研究組患者首個療程開始當天至第3天接受腸內營養方案;對照組患者首個療程開始當天至第3天接受常規飲食指導。腸內營養劑為康全甘(TP-MCT,紐迪希亞,國藥準字 H200700001,規格:500 mL),主要成分為水、麥芽糊精、乳清蛋白水解物、植物油、維生素、礦物質和微量元素[12-13]。研究組給予飲食指導,并從化療當天和化療第2天口服康全甘,每天攝入的熱卡為2 000 kcal(1 kcal=4.184 kJ),連用3 d。對照組給予飲食指導,營養醫師根據科學營養成分配比和熱卡計算等方法設計三餐進食方案,每天攝入的熱卡為2 000 kcal,化療期間不給予任何ONS。2組患者均控制每天最低攝入熱卡為2 000 kcal。
1.2.2觀察指標 2組患者均以首個療程EC-T作為觀察階段。
1.2.2.1腸黏膜屏障功能 (1)尿乳果糖/甘露醇(L/M):患者化療前1 d和首個療程結束后首日晨起首次排尿,按醫囑口服乳果糖 10 g和甘露醇5 g,30 min后適量飲水,在2 h后進食,約6 h后由患者自行收集尿液,取適量樣本凍存于-80 ℃或直接采用高效液相色譜法測定L/M。(2)血清二胺氧化酶(DAO):化療前1 d和首個療程結束后第2天采集晨起空腹外周靜脈血,離心分離血清后凍存于-80 ℃或直接采用分光光度法測定DAO[14]。
1.2.2.2營養情況 (1)營養評估:接受化療前1 d和首個療程結束后首日采用PG-SGA進行營養評估,0~1分為營養良好,2~3分為高風險營養不良,4~8分為中度營養不良,≥9分為重度營養不良。PG-SGA評分越高表示營養狀況越差,需進行營養干預[15]。(2)BMI評估:接受化療前1 d及首個療程結束后首日進行BMI評估。(3)血清清蛋白:接受化療前1 d及首個療程結束后首日采血進行血清清蛋白檢測,正常值范圍為35~50 g/L。
1.2.2.3化療不良反應 將腹瀉、惡心/嘔吐、骨髓抑制、肝腎功能損傷作為化療不良反應評估標準:(1)腹瀉,排便頻次大于每天2次、大便不成形等;(2)惡心/嘔吐,出現惡心伴食欲減退或嘔吐胃內容物,頻次大于或等于每天1次;(3)骨髓抑制,化療后白細胞、紅細胞、血小板計數3系中1項或1項以上指標下降;(4)肝腎功能損傷,化療后肝功能(谷丙轉氨酶和谷草轉氨酶)、腎功能(血肌酐和尿素氮)1項或1項指標明顯升高。2組患者化療前均無腹瀉、惡心/嘔吐、骨髓抑制及肝腎功能損傷。
2 結 果
2.12組患者治療前后腸黏膜屏障功能比較 2組患者化療前血清DAO、尿L/M水平比較,差異均無統計學意義(P>0.05);2組患者經首個療程化療后血清DAO、尿L/M水平均較治療前升高,且研究組患者治療后血清DAO、尿L/M水平均明顯低于對照組,差異均有統計學意義(P<0.05)。見表2。
表2 2組患者治療前后腸黏膜屏障功能比較
2.22組患者治療前后營養情況比較 2組患者化療前BMI[(21.57±1.39)kg/m2]和血清清蛋白水平[(22.08±1.88)g/L]均未低于正常值,PG-SGA評分小于2分,均評價為營養良好。2組患者治療后BMI[(22.19±1.89)kg/m2]和血清清蛋白水平[(22.38±2.18)g/L]與化療前比較,差異均無統計學意義(P>0.05);PG-SGA評分均出現一定程度的上升,且研究組患者PG-SGA評分明顯低于對照組,差異均有統計學意義(P<0.05);2組患者中絕大部分患者營養狀況均良好,研究組患者中出現中度營養不良1例,對照組患者中出現中度營養不良2例。2組患者中均未出現重度營養不良者。見表3、圖1。

表3 2組患者治療前后PG-SGA比較
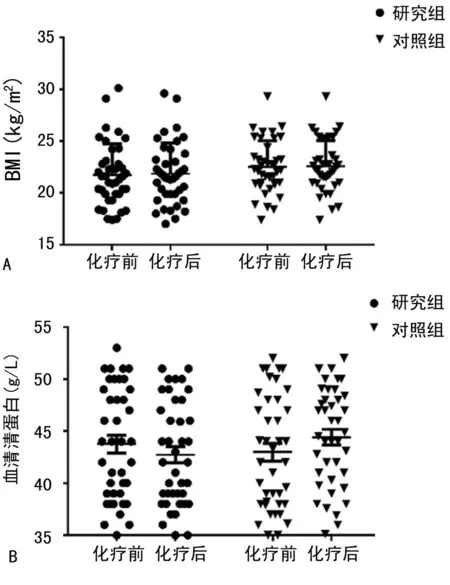
A.2組患者化療前1 d和首個療程結束后首日BMI比較;B.2組患者化療前1 d和首個療程結束后首日血清清蛋白水平比較。
2.32組患者化療不良反應發生情況比較 2組患者化療后均出現一定程度不良反應,研究組患者腹瀉發生率明顯低于對照組,差異有統計學意義(P<0.05);2組患者惡心/嘔吐、骨髓移植、肝腎功能損害不良反應發生率比較,差異均無統計學意義(P>0.05)。見表4。

表4 2組患者化療不良反應發生情況比較[n(%)]
3 討 論
目前,全球范圍內的乳腺癌治療仍以手術切除為主,放化療和免疫療法為輔,而近20年來新輔助治療的出現和推廣使患者廣泛獲益[16]。1998年有學者研究了含蒽環類藥物的新輔助化療方案,并提出了劑量密度療法可最大限度地抑制腫瘤生長[17]。其中EC-T方案的療效和安全性已被研究揭示,是美國國立綜合癌癥網絡指南推薦的乳腺癌輔助治療的標準治療方案。
化療藥物主要作用于細胞的生長過程,所以,不僅能殺傷腫瘤細胞,對正常組織器官也有不同程度的毒性作用,其中腸黏膜損傷正是抗癌藥物不良反應之一[18]。人體腸黏膜兼具消化、吸收和屏障功能,且存在不可忽視的分泌功能[19-20]。當外源性刺激或自身免疫異常導致腸黏膜損傷和腸功能發生障礙時,人體消化、吸收明顯減弱且存在毒素入血引發全身癥狀的風險。此外,長期慢性腸黏膜損傷和持續刺激的發生,最終顯著提升了腫瘤發生的風險[18]。因此,近年來,腸黏膜和腸道微生物代謝等話題成為研究熱點之一。
腸內營養起初是臨床營養支持的一種方式,在臨床實踐中擁有悠久的歷史。近年來,腸內營養在保護腸黏膜屏障功能方面的價值不斷被揭示。作為復合型營養補充劑,腸內營養制劑通常含有科學配比的復合成分,包括水、蛋白、脂質、維生素、礦物質、微量元素等,保證了人體營養的需求。此外,腸內營養成分易吸收,能快速吸收入血,有效增加內臟血流量,為腸黏膜屏障功能的修復提供了營養支持,同時,腸內營養能提升腸道淋巴系統活性,幫助維持腸道固有菌群的穩態,有效改善和維持腸道微環境。有學者認為,即使低劑量腸內營養對保護腸黏膜功能也是十分有益的[21-22]。腸黏膜屏障功能的評測方法不斷在發展,其中尿L/M和血清DAO是目前最常被使用的經典方法。尿液中L水平可反映腸道黏膜緊密連接的完整情況。DAO是一種細胞內酶,主要存在于腸道黏膜上皮中,在腸黏膜受到刺激時會釋放入血。因此,腸道屏障受損時尿L/M和血清DAO均出現早期變化,可作為腸道屏障健康度的判斷標準[23-24]。
本研究為一項前瞻性研究,僅選擇單側乳腺癌女性患者入組,排除了多發腫瘤和性別差異等對研究結果產生的偏倚。2組患者年齡、營養情況、BMI、臨床分期等一般資料基本保持一致,差異均無統計學意義(P>0.05)。結果顯示,ONS能有效控制腹瀉的發生,而患者尿L/M和血清DAO進行檢測結果也支持了這一點。對營養情況而言,雖然總體評估未出現明顯差異,但研究組患者PG-SGA評分明顯低于對照組,表明化療后ONS對患者營養情況的改善相比普通飲食存在一定優勢。2組患者除腹瀉外的化療不良反應發生情況比較,差異均無統計學意義(P>0.05)。
當然,本研究也存在一定的局限性:(1)近年來,有研究質疑了尿L/M和血清DAO等經典方法的可靠性,認為其雖具有完善的理論基礎,但其是間接檢測法且檢測結果易受到擾動,推薦使用透射電鏡、免疫細胞檢測、腸道菌群檢測等更加直觀的方法[25]。本研究因條件受限,仍采用經典方法評估患者腸黏膜屏障功能。(2)本研究為小型臨床研究,樣本量較為有限且時間較短。
綜上所述,本研究揭示了ONS對乳腺癌術后化療患者腸黏膜屏障功能的保護作用。盡管其對患者的營養狀況和術后其他不良反應發生情況并未出現根本性的改善,但基于腸道功能對于患者化療耐受和營養狀態的綜合考慮,本研究仍推薦乳腺癌術后接受EC-T化療患者常規使用ONS。

