變應性鼻炎大鼠TNFAIP3基因在鼻腔上皮細胞的表達
郭宇峰 高興強 鄧海燕 劉美蓮 陸旖
變應性鼻炎(allergic rhinitis,AR)是易感個體接觸變應原后由特異性IgE 介導的鼻黏膜的非感染性炎性疾病。AR患病率在全球范圍內逐年上升,患病率為2.2%~45.1%。我國AR發病率也在不斷升高,我國成人AR自報平均患病率則為11.4%,中國同齡兒童AR患病率為10.4%,并且每年以0.33%的速度上升[1-2]。對于變應性鼻炎的發病的機制尚無定論,目前研究熱點包括遺傳基因的影響、免疫功能紊亂及環境因素等方面。近年來對AR致病基因的研究發現有多個與它相關的候選基因區。美國學者Dixit等[3]發現了一種具有高度生物活性的胞質蛋白質,命名為腫瘤壞死因子α誘導蛋白3(tumor necrosis factor alpha-induced protein 3,TNFAIP3)。大 量 研究表明,TNFAIP3作為促炎因子核因子κB(nuclear factor kappa B,NF-κB)的負調控因子,是機體炎癥反應的保護因素之一[4-6]。TNFAIP3近年來成為治療炎癥性疾病的潛在靶點而受到關注。本實驗在2019年1月—2020年1月開展,利用變應性鼻炎大鼠模型,在其致敏-治療過程中研究TNFAIP3基因在鼻腔黏膜上皮的表達,研究其與變態反應進程的關系,為探討TNFAIP3在免疫進程中的作用、能否作為AR治療的新思路提供實驗依據。
1 材料與方法
1.1 一般材料
健康Wistar大鼠24只,雌雄各半,普通級,6~8周齡,體質量250~300 g。購自廈門大學實驗動物中心,由廈門大學實驗動物科學部代養。該研究獲得廈門市兒童醫院倫理委員會的批準。實驗動物隨機分為三組,每組8只。
1.2 動物模型的建立與模型評價
AR大鼠(取16只)參照文獻[7]方法進行建模。基礎致敏階段:造模大鼠每只以卵清蛋白(ovalbumin,OVA)(美國Sigma,貨號A5503-1G)0.3 mg作抗原,氫氧化鋁粉末(美國Sigma貨號239186-25g)30 mg作為佐劑,加生理鹽水1 mL形成混懸液腹腔注射;隔日1次,共7次(第1~14天的單數日)。加強致敏階段:腹腔注射完成后,每只大鼠以0.25%卵清蛋白生理鹽水霧化吸入10 min,1次/d,連續5 d(第15~19天)。激發階段:間歇3 d后,以10%卵清蛋白用微量加樣器滴入大鼠雙側鼻腔,20 μL/次,1次/d,共7次(第23~29天)。打噴嚏和撓鼻次數在最后一次激發結束后10 min進行計數。治療組(8只):模型組中選擇8只做治療組,給予西替利嗪滴劑(商品名:仙特明;生產企業:UCB Pharma S.p.A意大利;批準文號:進口藥品注冊證號H20110137;規格:10 mL∶100 mg),1次/d,每次20 μL滴鼻,連續2周。模型組(8只):除治療組外的剩余AR大鼠給與生理鹽水滴鼻。對照組(8只):全程只用生理鹽水(正常組)。
AR大鼠模型主要表觀指標:(1)出現擦鼻、噴嚏、流涕、鼻塞等局部過敏癥狀;(2)滴鼻激發后癥狀明顯增加;(3)按過敏反應行為的評分標準進行評分。表觀指標可量化積分或半量化分級。噴嚏次數:1~3次為1分,4~10次為2分,≥11次為3分;抓鼻次數:1~4次為1分,4次以上為4分;清涕:流至前鼻孔為1分,超出前鼻孔為2分,涕流滿面為3分。進行積分累加,其癥狀觀察時間為每次給致敏物開始計時,共30 min,總評分≥5分判定為成功致敏。
1.3 大鼠鼻腔黏膜標本的獲取
殺死大鼠,先取鼻中隔黏膜,將鼻部中間往上剪開,暴露鼻甲,鑷子從鼻中插入,向上掀開鼻甲骨,找到鼻中隔,小心剝離兩側附著的黏膜,一份固定做免疫組化,一份-80℃凍存。
1.4 組織病理學分析
應用免疫組織化學法檢測不同處理組的24個大鼠鼻腔黏膜組織的NF-κB、TNFAIP3的表達情況。大鼠鼻腔黏膜組織用4%多聚甲醛固定,流水滴洗,經不同濃度的乙醇梯度脫水,二甲苯進行組織透化后石蠟進行包埋,包埋后的蠟塊進行連續切片。按抗體說明書條件NF-κB、TNFAIP3均以檸檬酸修復液(pH 6.0)煮沸修復15 min;免疫組化油筆在組織周圍3~5 mm處畫圈,磷酸緩沖鹽溶液(phosphate buffered saline,PBS)沖洗3次,5 min/次;阻斷、滅活內源性過氧化物酶;正常羊血清工作液封閉非特異位點;按各抗體工作濃度稀釋抗體,滴加一抗4℃孵育過夜,PBS沖洗3次,5 min/次;滴加二抗,37℃孵育15 min,PBS沖洗3次,5 min/次;滴加鏈霉菌抗生物素-過氧化物酶,37℃孵育15 min,PBS沖洗3次,5 min/次;DAB反應染色,顯微鏡下觀察顯色情況,自來水充分沖洗結束顯色;蘇木素復染5 min,流水沖洗,自來水浸洗5 min返藍;脫水透明,中性樹膠封片。并應用蘇木素-伊紅染色(HE染色)后光鏡下觀察檢測鼻黏膜組織中嗜酸性粒細胞的分布情況。
1.5 實時熒光定量聚合酶鏈反應檢測
采用實時熒光定量聚合酶鏈反應(real-time quantitative polymerase chain reaction,RQ-PCR)對各組動物鼻黏膜樣本中NF-κB和TNFAIP3基因mRNA的含量進行檢測(引物序列見表1),實驗按照實時熒光定量RT-PCR試劑盒所規定的步驟進行,實驗所得數據用ΔCT法表示。

表1 qPCR引物序列
1.6 統計學處理
采用 Graphpad Prism 6統計軟件分析所得數據,數據經檢驗呈正態分布,樣本量較小,計量資料以(±s)表示,兩組間差異的比較采用t檢驗,多組間差異的比較采用方差分析,以P<0.05為差異有統計學意義。
2 結果
2.1 AR大鼠模型的建立
AR組大鼠可見擦鼻、噴嚏、流涕、鼻塞等局部過敏癥狀;滴鼻激發后癥狀明顯增加;評分總分均≥5分。模型組平均評分(6.31±0.57)分,明顯高于正常組的(0.92±0.18)分及治療組的(1.35±0.51)分,模型組與正常組相比差異有統計學意義(t=56.11,P<0.01),模型組與治療組相比差異有統計學意義(t=32.70,P<0.01),說明AR大鼠模型建立成功。
2.2 組織病理學變化
嗜酸性粒細胞染色主要是檢測樣本組織中嗜酸性粒細胞的存在和分布情況,對照組和治療組的所有組織切片中未觀察到嗜酸性粒細胞的存在,模型組部分組織中存在嗜酸性粒細胞密集分布的情況(如圖1)。
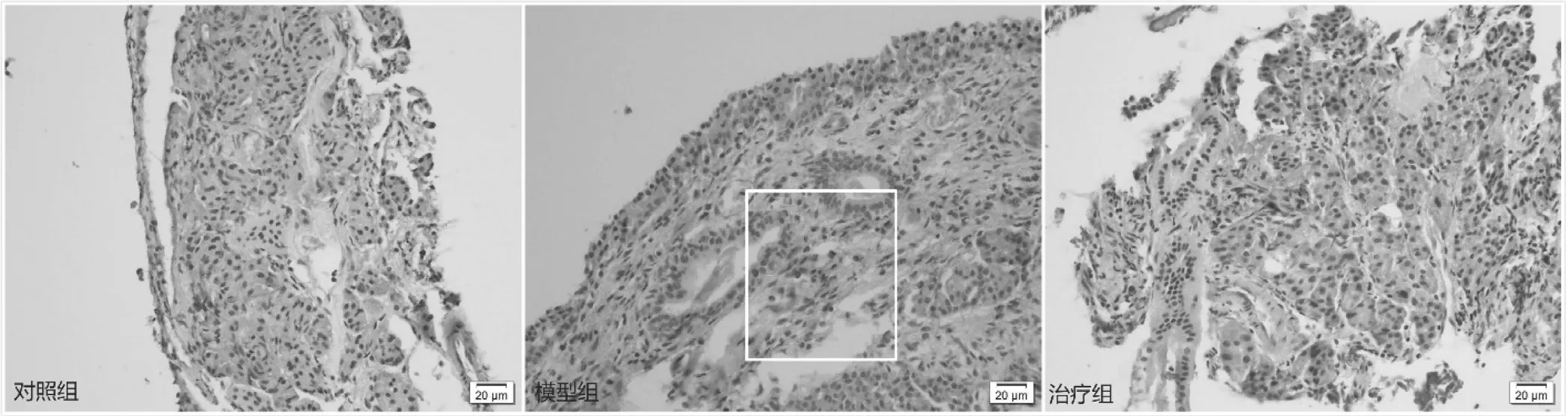
圖1 大鼠鼻中隔黏膜組織上皮嗜酸性粒細胞浸潤情況(HE染色,×400)
進行免疫組化NF-κB指標檢測的樣本切片閱片可見模型組切片陽性顯色密集,治療組有陽性顯色,對照組僅有散在的陽性顯色,各組切片有明顯差異(如圖2)。

圖2 大鼠鼻中隔黏膜NF-κB胞漿表達情況(鏈霉菌抗生物素蛋白-過氧化物酶連結法,×400)
免疫組化TNFAIP3指標檢測的樣本切片閱片可見治療組與對照組切片均有較密集的陽性顯色,兩組間對比差異不大,模型組呈陰性表達,模型組對比治療組與對照組有顯著差異(如圖3)。
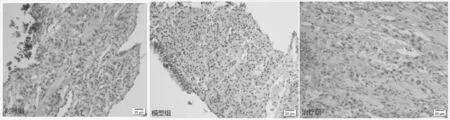
圖3 大鼠鼻中隔黏膜TNFAIP3胞漿表達情況(鏈霉菌抗生物素蛋白-過氧化物酶連結法,×400)
2.3 鼻黏膜組織中NF-κB、TNFAIP3基因在對照組、模型組及治療組中的表達水平
模型組TNFAIP3基因表達水平(4.601±0.796)、對照組(7.430±1.026)、治療組(7.175±0.804);模型組比對照組低,差異有統計學意義(t=2.178,P<0.05);模型組比治療組低,差異有統計學意義(t=2.274,P<0.05);治療組與對照組比較差異無統計學意義(t=0.195,P>0.05)。模型組NF-κB基因表達水平(6.046±0.665)、對照組(3.498±0.663)、治療組(4.056±0.333),模型組比對照組高,差異有統計學意義(t=2.714,P<0.05),模型組比治療組高,差異有統計學意義(t=2.677,P<0.05),治療組與對照組比較,差異無統計學意義(t=0.175,P>0.05)。
3 討論
變應性鼻炎是以清水樣鼻涕、鼻塞等臨床表現為主,可伴眼部癥狀及耳部癥狀,不危及生命,但會顯著影響患者的生活質量。隨著近年來對其發病機制的研究不斷深入,對AR致病基因的研究發現有多個與它相關的候選基因區,NF-κB是研究的熱點之一,NF-κB的激活使變態反應炎癥因子級聯放大,形成炎癥風暴,眾多文獻證明其在AR中起關鍵作用[8-9]。TNFAIP3蛋白同時具有泛素化以及去泛素化兩種功能,作為NF-κB的負調控因子,是機體炎癥反應的保護因素之一[10]。早期細胞系實驗發現持續過表達的TNFAIP3可顯著抑制NF-κB的激活,降低NF-κB靶基因的表達,包括細胞間黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1),白介素-8(interleukin-8,IL-8),核因子κB的抑制蛋白(inhibitor of NF-κB,IκBα)組織因子,血管細胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1),白介素-6(interleukin-6,IL-6)以及粒細胞-巨噬細胞集落刺激因子(granulocytemacrophage colony stimulating factor,GM-CSF)。TNFAIP3負調節NF-κB的生物活性,主要是通過抑制腫瘤壞死因子(tumor necrosis factor,TNF)途徑和Toll樣受體(Toll-like receptor,TLR)途徑來實現的[11-12]。TNFAIP3基因敲除小鼠模型證明了其在炎癥負調控中的重要作用,TNFAIP3-/-小鼠在出生后不久即死于多器官的嚴重炎癥和組織多發損傷,包括肝臟、腎臟、腸道、關節及骨髓等[13]。Lee等[14]研究發現TNFAIP3蛋白過表達可抑制由TNF,白介素-1(interleukin-1,IL-1)及脂多糖(lipopolysaccharide,LPS)刺激后核轉錄激活因子-1(activator protein-1,AP-1)的激活從而改善小鼠潰瘍性結腸炎的炎癥表現。TNFAIP3近年來成為治療炎癥性疾病的潛在靶點而受到關注。
本實驗免疫組化發現AR大鼠模型組鼻黏膜組織中炎癥因子NF-κB指標陽性顯色,RT-PCR檢測也發現鼻腔黏膜組織中NF-κB基因表達在模型組中高于治療組與對照組。NF-κB作為炎癥和免疫反應的樞紐因子,在炎癥反應中發揮級聯放大瀑布效應,在變態反應中發揮重要作用。本實驗模型組大鼠鼻黏膜免疫組化TNFAIP3指標檢測治療組與對照組切片均有較密集的陽性顯色,而模型組為陰性表達,兩者對比有顯著差異。RT-PCR檢測也發現TNFAIP3 mRNA在模型組中低于治療組與對照組,差異有統計學意義(P<0.05)。TNFAIP3作為促炎因子NF-κB的負調控因子,其水平下降意味著對NF-κB的負調控能力下調,后者升高可帶來一系列嚴重的炎癥反應,即模型組小鼠出現明顯的噴嚏、流涕等變應性炎癥癥狀。本實驗治療組TNFAIP3的表達較模型組明顯增高,而NF-κB降低,大鼠鼻腔炎癥反應減輕。說明TNFAIP3升高可下調NF-κB因子水平來降低氣道高反應性并抑制氣道炎癥因子級聯瀑布效應。
隨著遺傳學的研究進展,越來越多的學者認為變應性鼻炎的多種表現型都處于較強的遺傳控制之下,是一種具有多基因遺傳傾向的疾病;目前已知基因如IL-23R、MRPL4及TNF-α的SNP均與AR易感性有關[15]。國內學者發現TNFAIP3基因多態性與漢族人群AR遺傳易感性有關,楊盈琳等發現TNFAIP3基因的rs9494885SNP位點及rs7753873SNP位點與AR遺傳易感性密切相關[16]。且有研究報道在AR人群中鼻黏膜TNFAIP3基因和蛋白的表達水平較健康對照組降低,與本實驗動物模型研究指標一致[17]。除外變應性疾病,國內外較多文獻報道在各類自身免疫病及炎癥疾病人群中TNFAIP3的表達均較正常人群低。如Bruno等[18]發現在克羅恩病患者中,炎性結腸黏膜組織的TNFAIP3基因表達低于健康對照者;Wang等[19]發現TNFAIP3蛋白表達的下降與歐洲和韓國人群中SLE的發病呈顯著相關;魏潔瓊等[20]發現甲亢組外周血中鋅指蛋白TNFAIP3mRNA 表達水平低于正常對照組,低水平的TNFAIP3表達可能在甲亢Graves病發生發展免疫應答中起到作用。但在國內也有文獻報道AR模型小鼠鼻黏膜中TNFAIP3mRNA和蛋白表達水平增高,作者推測急性炎癥誘導了TNFAIP3的表達,從而抑制NF-κB的炎癥反應[21]。此結果與本實驗相反,可能為炎癥急性期TNFAIP3在鼻黏膜中表現出應激性增高,隨著炎癥的進展,TNFAIP3的表達逐漸降低。
綜上所述,變應性鼻炎的發生發展與許多炎癥因子密切相關。其中鋅指蛋白TNFAIP3作為炎癥觸發因子NF-κB的負調控因素,為阻止機體發生變態反應發揮了不可替代的作用。本實驗通過動物模型進一步證明了TNFAIP3的作用,為變應性疾病的預防和治療提供了新的思路。

