信息化監測模式對某三級甲等醫院藥品不良反應報告質量的影響
王 快,黎 麗,潘碚彬,方 健,危麗琴,羅崇彬
(1.廣東省廣州市花都區人民醫院,廣東 廣州 510800; 2.中山大學附屬第八醫院,廣東 深圳 518033;3.廣東醫科大學藥學院,廣東 東莞 523822)
醫療機構、藥品生產企業和經營企業是報告藥品不良反應(ADR)的主體[1]。為了減少ADR 對用藥人群的危害,及時、有效地控制用藥風險,我院積極開展ADR 報告與監測工作,但ADR 報告常存在信息填寫錯誤、過程描述過于簡單等問題,且新的或嚴重的ADR 上報率低,導致ADR 監測員不能快速、準確地識別藥品安全信息。ADR 報表填寫的真實性、規范性、完整性是ADR 信息可靠和有效的重要保證,是藥品風險分析與評價的基礎[2],尤其在當前開展對“4+7”藥品[3-4]、國家談判藥品[5-6]進行招標采購的形勢下,高質量的ADR 報告可作為此類重點關注藥品風險預警的可靠數據支持[7]。為優化ADR 報告與監測的工作流程,提高ADR 報告的質量,給臨床用藥風險預警及時提供可靠的資料,我院于2016 年實施ADR 信息化監測模式。本研究中分析了開展信息化監測模式前后ADR 原始報表的真實性、規范性及完整性,探討信息化建設對三級甲等醫院ADR報告質量的影響。現報道如下。
1 資料與方法
1.1 資料來源
收集我院開展信息化監測前(2011年至2015年,監測前)的ADR 紙質報告1 150 份,開展信息化監測后(2016年至2020年,監測后)的ADR原始電子報告1 227份。
1.2 質量評估標準與方法
根據《藥品不良反應報告和監測管理辦法》(衛生部令第81 號)、國家藥品不良反應監測中心發布的《藥品不良反應病例報告質量評估指導意見(試行)》制訂ADR報告質量的真實性、規范性和完整性評估項目。
真實性:通過ADR 原始報告表的信息追查患者的住院病程記錄、護理記錄、醫囑、門診病歷記錄、處方、檢驗檢查、體溫單等醫療記錄,有相關記錄的ADR 報告判斷為真實報告。
規范性:評估內容包括ADR 報告類型、報告時限、ADR 名稱、藥品通用名稱、劑型、生產廠家、生產批號、用法用量、用藥原因、原患疾病、關聯性評價和ADR 分析,統計分類主要為規范填寫、未填寫、填寫錯誤、填寫不完整、填寫為“不詳”等。
完整性:評估內容主要為ADR 過程描述及其處理情況和患者信息等其他項目,包括原患疾病描述、用藥情況、ADR 發生時間、干預時間、ADR 終結時間、出現ADR 的癥狀及體征、輔助檢查、病情動態變化、干預措施、轉歸等,統計分類主要為填寫、未填寫、填寫不完整。
根據《三級醫院評審標準(2020 年版)》(國衛醫發〔2020〕26 號)和《三級綜合醫院評審標準實施細則(2011年版)》(衛辦醫管發〔2011〕148號)三級甲等綜合醫院評審條款要求,患者發生的ADR 應被如實記入病歷中。我院ADR 報告和監測管理制度規定,住院患者的病程記錄和門診患者的門診病歷均應記錄患者發生的ADR,病案首頁應記錄發生過敏反應的藥物。因此,病歷是否記錄患者發生的ADR,病案首頁是否記錄患者發生過敏反應的藥物,同樣作為本次ADR 報告質量評估的項目之一,統計分類為是、否。
1.3 統計學處理
采用Excel 2019 軟件整理數據,采用SPSS 24.0 統計學軟件分析。若存在1 個或1 個以上小于5 的期望計數,采用Fisher's 精確檢驗(雙側),否則采用Pearsonχ2檢驗(雙側);紙質報告表與電子報告表的組間數據比較中,其中一個類型作為一個變量,其余類型的合計值作為另外一個變量,如批準文號規范填寫的ADR 報告例數與不規范填寫的(包括未填寫、填寫不完整、填寫錯誤、不詳)ADR 報告例數的前后數據比較。計數資料以率(%)表示,行χ2檢驗。P<0.05 為差異有統計學意義。采用品管圈質量管理工具柏拉圖進行根因分析。
2 結果
2.1 真實性評估
根據真實性評估標準與方法,監測前后的ADR 原始報告表均可溯源,在醫院電子病歷系統中均可查詢到相關信息記錄,未發現虛假報告。
2.2 規范性評估
報告類型:目前,我院ADR 報告類型長期以已知的一般ADR報告為主,監測前后分別為67.91%(781/1 150)和61.78%(758/ 1 227);新的或嚴重的ADR 報告比例偏低,無死亡病例。新的或嚴重的ADR 報告比例由32.09%(369/1 150)升至監測后的38.22%(469/1 227),監測前后差異有統計學意義(P=0.002)。
報告時限:已知的一般ADR 報告超時上報率由監測前的5.63%(44/781)降至監測后的3.43%(26/758),差異有統計學意義(P=0.038);但新的或嚴重ADR 超時上報率由監測前的25.75%(95/ 369)升至監測后的29.64%(139/469),差異無統計學意義(P=0.212)。
藥品信息:開展信息化監測后,ADR 報告表中的藥品信息規范填寫比例均大幅上升。詳見表1。
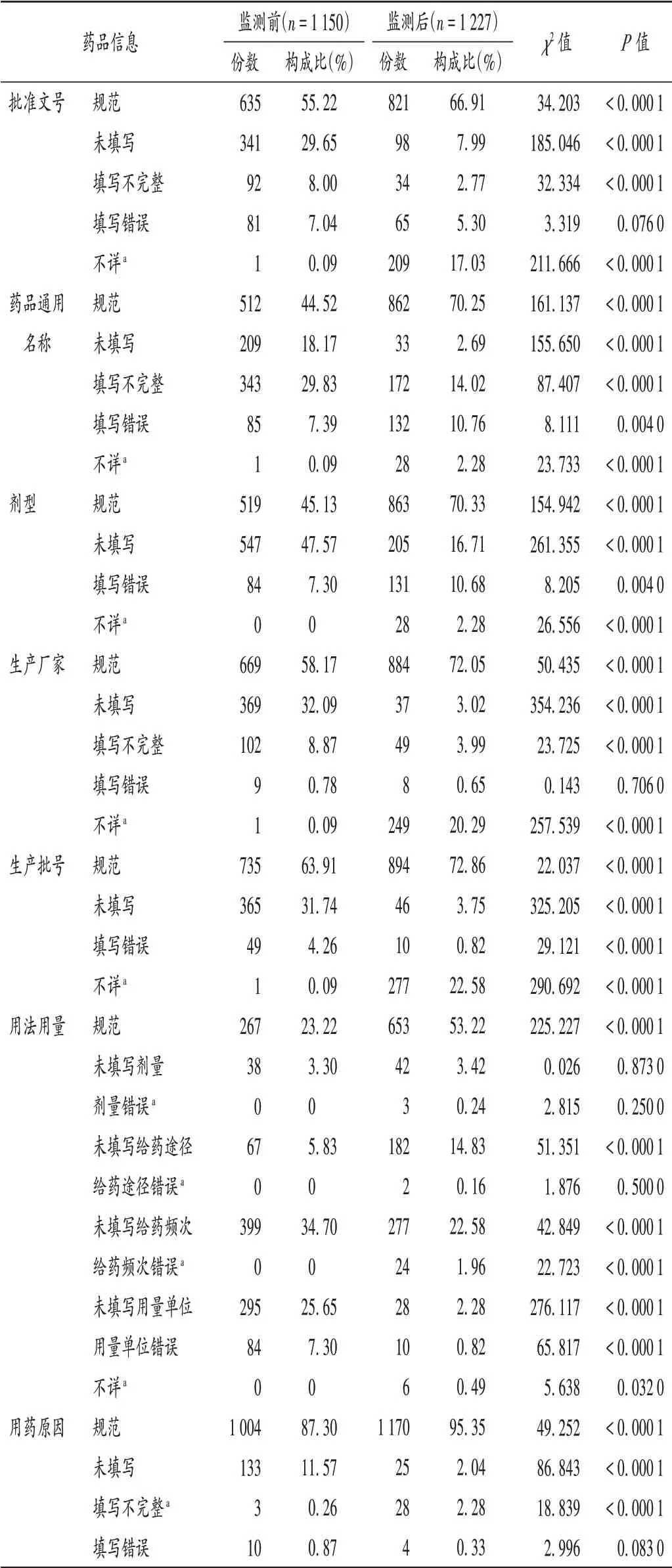
表1 藥品信息填報的規范性評價Tab.1 Normative evaluation of drug information filling
其他規范性評估項目:與監測前相比,監測后的ADR 報告類型、ADR 名稱、原患疾病、ADR 分析及關聯性評價的規范填寫比例均明顯提高(P<0.05),但ADR報告類型、ADR 分析和關聯性評價填寫錯誤的構成比也明顯提高(P<0.05)。詳見表2。
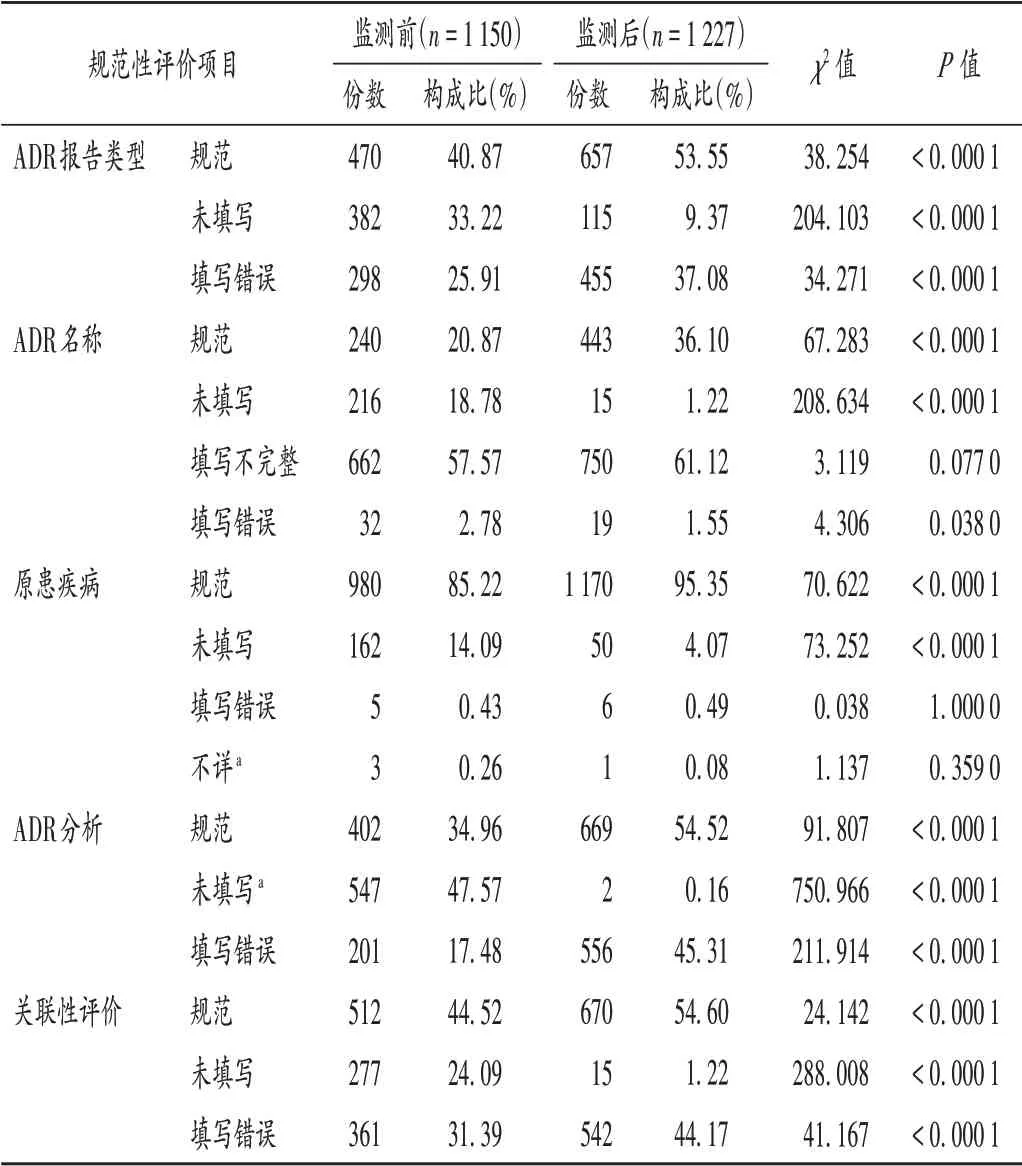
表2 其他信息填報項目的規范性評價Tab.2 Normative evaluation of filling items of the other information
2.3 完整性評估
監測后,患者信息完整填寫率為93.24%(1 144/1 227),顯著高于監測前的61.57%(708/ 1 150),差異有統計學意義(P<0.01);但原患疾病完整填寫率較低,且改善不明顯。與監測前比較,ADR/ 藥品不良事件(ADE)過程描述中,監測后的ADR 干預措施和干預時間填寫的完整性均明顯提高(P<0.05);但原患疾病描述、病情動態變化、ADR 終結時間、轉歸等描述的完整性并未明顯改善(P>0.05)。詳見表3。

表3 ADR報告表填寫完整性評價Tab.3 Evaluation of the completeness of ADR reports
2.4 病歷記錄ADR 和病案首頁記錄過敏反應藥物的評估
監測后,ADR被記錄在住院患者病程記錄或護理記錄、門診患者的病例記錄的比例為91.93%(1 128/1 227),明顯高于監測前的55.83%(642/ 1 150);住院患者病案首頁記錄過敏反應藥物的比例為80.07%(434/ 542),明顯高于監測前的53.39%(362/ 678),差異有統計學意義(χ2=406.96,94.565,P<0.000 1)。
2.5 ADR 報告表規范性和完整性填寫較差的根因分析
監測后,我院ADR 報告表中ADR 報告類型、ADR名稱、原患疾病、ADR 分析及關聯性評價填寫的規范性雖有改善,但占比仍較低;ADR 報告表完整性評價項目中只有ADR 干預措施和干預時間填寫的完整性較前改善,其他項目無明顯改善,甚至還較前降低。
通過統計非規范性填寫的項目,并采用質量管理工具繪制影響我院ADR 電子報告表填寫規范性的主要原因分析柏拉圖[8],根據80/ 20 法則[9],發現ADR 名稱、用法用量、ADR 報告類型、ADR 分析、關聯性評價、批準文號、藥品通用名稱、劑型未規范填寫的累計百分比為84.10%,為當前ADR 報告規范性評價項目中需要重點改善的項目。另外,考慮生產廠家與生產批號未規范填寫的數量也較多,且與藥品通用名稱、劑型等有一定關聯性,故生產廠家與生產批號也被納入改善的重點(見圖1)。按同樣的方法分析發現,原患疾病描述、ADR 終結時間、轉歸、病情動態變化、用藥情況、干預時間、干預措施未規范填寫的累計百分比為84.73%,為當前影響ADR電子報告表完整性的主要原因(見圖2),是需要重點改善的項目。
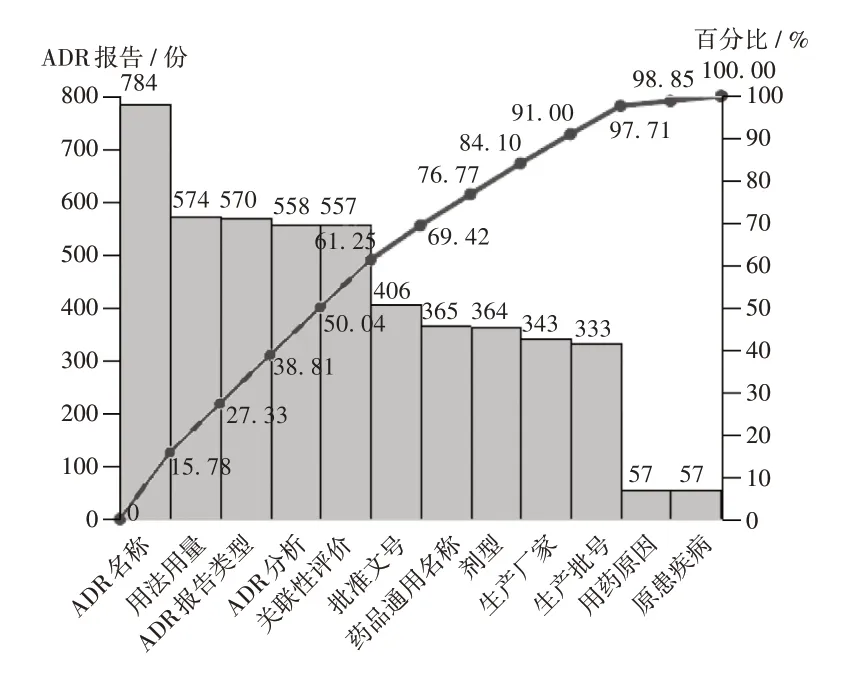
圖1 影響ADR電子報告表填寫規范性的主要原因分析Fig.1 Main reasons affecting the standardization filling of ADRelectronic reports

圖2 影響ADR電子報告表填寫完整性的主要原因分析Fig.2 Main reasons affecting the completeness filling of ADR electronic reports
針對上述需改善的重點項目,ADR 監測員深入臨床調查原因,并與醫院ADR 報告與監測小組成員開展頭腦風暴,認為影響我院信息系統填寫ADR 報告規范性和完整性的原因主要有:1)藥物信息填寫不規范,如漏填或錯填藥品通用名稱、批準文號、用法用量、劑型等,主要由上報人理解錯誤、上報不認真或藥物信息丟失等引起。如批準文號填寫為生產批號,藥品通用名稱填寫為商品名稱,或大部分藥物信息均填寫“不詳”等;2)錯填ADR 類型、ADR 分析、關聯性評價,主要與上報人缺乏判斷ADR 的專業知識有關;3)未完整填寫ADR過程描述及其處理情況,主要與上報人不熟悉ADR 相關知識、缺乏統一培訓、態度不嚴謹有關;4)未嚴格落實醫院獎懲制度。
3 討論
3.1 信息化監測模式的建立優化了工作流程
ADR 上報與監測工作中存在的效率低、監測信息接收不完整等問題,對安全用藥的隱患極大,我院藥學部聯合網絡中心緊跟國內醫療機構信息化建設步伐,聯合第三方信息公司成功上線ADR 上報系統。開展信息化建設前,臨床上報ADR 需填寫紙質報告表,并將其送至藥學部ADR 監測專員處,再由ADR 監測員調查、分析后上報至國家ADR 監測網,耗時較長,超時上報的現象時有發生,上報人與ADR監測員交流不便,且ADR紙質報告表填寫字跡潦草,難以辨認,ADR 報告表整體質量較差。針對存在的問題,我院于2016年開始通過信息系統直接上報ADR,杜絕了紙質版ADR 報告表填寫字跡潦草、難以辨認的弊端。另外,通過ADR 上報系統,監測員可第一時間接收到ADR 的上報信息,對于報告表缺項、填寫錯誤、填寫不完整、病歷未記錄ADR、病案首頁未填寫過敏反應藥物等問題,可直接在ADR 上報系統與上報者溝通交流,為ADR 報告的上報節約了大量時間,也可讓ADR 監測員有針對性地深入臨床著重調查新的或嚴重ADR,加強ADR專業知識培訓,大大減輕了ADR 報告與監測工作的負擔。同時,提高了醫務工作者對新的或嚴重ADR的認識,ADR報告與監測意識,以及新的或嚴重ADR 上報率,加強了用藥風險監測。ADR 上報系統具有與國家藥品不良反應上報系統一鍵上傳的接口,可大大提升監測員的工作效率。
3.2 持續改進措施
加強信息化建設:針對需要重點改善的ADR 報告表中規范性和完整性填寫項目,全面升級ADR 上報系統,通過與醫院信息系統、藥庫系統對接,患者基本信息可直接被導入ADR 上報系統,且可在ADR 上報系統中查詢近1,3,6,12 個月的藥品出庫信息,上報者在核對相關信息無誤后,可直接導入藥品的批準文號、生產廠家、生產批號、商品名稱等信息。針對ADR 過程描述及其處理情況填寫不完整的問題,ADR 上報系統直接嵌入模板,提示醫師完整描述原患疾病、用藥情況、ADR 發生時間、出現的癥狀和體征、輔助檢查、病情動態變化、干預措施、干預時間、ADR 終結時間、轉歸。同時,ADR 上報系統填寫的過程描述及其處理情況可直接導入病歷系統,而病歷系統記錄的ADR 可直接導入ADR 上報系統,避免重復書寫。另外,ADR 上報系統直接與國家ADR 監測網對接,大大提高了ADR 上報與監測工作的效率。我院ADR 上報系統還建立了修改功能和預警功能模塊,監測員對ADR 進行調查分析后,可對ADR 報告表中填寫不完整或填寫錯誤的項目進行修改,并保留修改痕跡,以供上報者參考。無法提交存在未填寫項目的ADR 報告表,并提示上報者完善相關項目。預警功能主要針對病歷出現ADR 記錄或醫囑開具抗過敏藥物等ADR 相關信息時,可定時向臨床工作者發送ADR上報提示,督促臨床醫務人員及時上報ADR,避免漏報、瞞報、超時上報等。通過信息化建設,盡早實現主動監測ADR[10-11]。
貫徹落實相關規章制度:通過數據分析發現,我院ADR 總體超時上報的比率雖有下降,但改善不明顯,尤其是新的或嚴重ADR 超時上報。通過分層統計發現,ADR 發生后的24 h 內或72 h 內上報的比率較前明顯下降。為進一步降低ADR 超時上報比率,我院《藥品不良反應報告和監測管理制度》規定一般的ADR 應由醫護人員在72 h內填寫《藥品不良反應/事件報告表》上報,ADR 監測員應在ADR 發現之日起30 日內上報至國家ADR 監測網;新的或嚴重ADR 由醫護人員在24 h 內上報,ADR 監測員應在ADR 發現之日起15日內上報至國家ADR監測網;由于ADR導致死亡的嚴重事件應立即上報。同時,貫徹落實獎懲制度,對于真實發生的、規范完整填寫的ADR報告,我院每例獎勵上報者30元;對于發現ADR但未上報者,每例扣罰100元。通過信息化建設與具體機制相結合,共同促進我院醫療質量與安全。
加強ADR專項培訓:針對我院醫務工作者對ADR上報與監測工作認識的不足,ADR上報積極性不佳,上報時報表內容填寫不規范、不完整等問題,ADR上報與監測工作小組制訂并落實院內ADR 專項培訓計劃,包括每年一次的新晉人員、進修生、實習生的ADR 專題培訓,每年2次的院內全員培訓及各科室不定期的相關培訓等,要求培訓組織部門做好相關培訓記錄,且不定期進行督導檢查,切實加強了醫務工作者對ADR的深入認識。
3.3 小結
病歷記錄是防止偽造虛假ADR 報告,檢驗其真實性的指標[12]。病案首頁記錄患者過敏性藥物能讓醫護人員快速了解患者的過敏史,尤其是在緊急搶救時可避免使用過敏性藥物,預防ADR 發生,進而保障用藥安全。ADR 報告的真實性、規范性、完整性是報表質量的基礎,直接影響ADR 的監測水平[13-14]。提高ADR 報告與監測水平是我國三級甲等綜合醫院評審標準的核心指標,是藥事管理持續改進的重要內容,更是提高醫療質量安全的關鍵環節[15]。通過開展ADR 信息化監測,我院ADR 報告質量明顯提高,但個別ADR 評價項目仍需進一步改善。

