口服β-內(nèi)酰胺酶保護SD 大鼠腸道雙歧桿菌/乳酸桿菌免受β-內(nèi)酰胺抗生素所致?lián)p傷研究
羅啟劍
摘要抗生素經(jīng)注射給藥后排泄進入腸道并非治療所需,并且會破壞腸道菌群并導(dǎo)致一些不利臨床后果。為了減輕這種不利影響,我們開發(fā)了一種重組β-內(nèi)酰胺酶--BL,并制備成腸溶包衣微丸,用于降解排泄進入腸道的 β-內(nèi)酰胺抗生素。在此,我們報告了其在大鼠中進行的臨床前藥效評估,使用氨芐西林和頭孢替安作為模型抗生素。在其中一項研究中,動物經(jīng)尾靜脈注射1劑抗生素,經(jīng)過口給予3劑賦形劑或不同劑量的 BL(24~144μg/劑量),收集血液和腸道樣本,并測定抗生素濃度。在另一項研究中,動物每天腹腔注射1劑抗生素,連續(xù)3天,并每天經(jīng)口給予3劑賦形劑或不同劑量的 BL(72~216μg/劑),另有一組不進行任何給藥處理;在抗生素治療前后收集糞便樣本,培養(yǎng)用于雙歧桿菌、乳酸桿菌計數(shù)。結(jié)果顯示,經(jīng)口給予 BL 顯著降低了抗生素腸道濃度,而對血清抗生素濃度沒有明顯影響;抗生素治療導(dǎo)致雙歧桿菌、乳酸桿菌數(shù)量降低 5-6 個數(shù)量級,而 BL 干預(yù)可以防止腸道雙歧桿菌、乳酸桿菌受到這種損害,并保持其水平與未治療組相近。這些臨床前研究表明,BL 可以降解排泄進入腸道的 β-內(nèi)酰胺抗生素,并防止其對腸道益生菌造成的損害。
關(guān)鍵詞:重組β-內(nèi)酰胺酶,β-內(nèi)酰胺類抗生素,腸道菌群,雙歧桿菌,乳酸桿菌
1.簡介
腸道內(nèi)存有數(shù)以萬億計的微生物,分屬于多個細菌種類,共同構(gòu)成了腸道菌群。 數(shù)百萬年的共同進化,導(dǎo)致宿主和腸道菌群在代謝和其他一些方面(例如促進形成腸上皮屏障)建立起互利共生關(guān)系。
腸道本土菌群可以通過刺激宿主黏膜免疫防御間接調(diào)節(jié)定植抗性,防止?jié)撛谥虏⌒苑潜就廖⑸锏纳L和后續(xù)感染。越來越多的證據(jù)表明,腸道菌群在宿主先天性和獲得性免疫系統(tǒng)的主要成分的訓(xùn)練和發(fā)育中發(fā)揮著關(guān)鍵作用,涉及針對炎癥性疾病、自身免疫性疾病和其他一些疾病(如阿爾茨海默病)的免疫調(diào)節(jié)機制。
雖然抗生素治療可以降低某些微生物感染的發(fā)生率,但這些抗生素會被排泄進入腸道中,顯著降低腸道本土菌群的防御能力 。 抗生素,尤其是一些廣譜抗生素,給藥后可通過膽汁排泄,并以高濃度在糞便中蓄積,對腸道菌群組成造成長期影響,即使在停藥后也是如此。抗生素排泄進入腸道,造成耐藥性病原體進入腸道、過度生長以及某些疾病發(fā)展的發(fā)生率增加。
β-內(nèi)酰胺類抗生素是目前使用最廣泛的抗菌藥物之一,其中許多以高濃度排泄入腸道中。然而,據(jù)我們所知,迄今為止,還沒有任何產(chǎn)品上市并臨床用于降解腸道中的抗生素,減輕其對宿主和社區(qū)的潛在不良后果。
受某些細菌產(chǎn)生的β-內(nèi)酰胺酶可以打開β-內(nèi)酰胺環(huán)并使β-內(nèi)酰胺抗生素失活這一事實的啟發(fā),我們開發(fā)了BL,一種重組β-內(nèi)酰胺酶,通過降解排泄的β-內(nèi)酰胺抗生素來保護腸道菌群免受β-內(nèi)酰胺抗生素的損害,同時不影響注射抗生素治療的全身性藥效。
在對BL產(chǎn)品的初步藥效評價中,我們分步設(shè)計了兩項研究。第一項研究旨在考察口服BL對排泄入腸道抗生素濃度的變化,第二項旨在觀察BL對排泄進入腸道抗生素對腸道主要益生菌菌群破壞的保護作用。
氨芐西林和頭孢替安分別被選為青霉素和頭孢菌素類抗生素的模型抗生素,這兩類抗生素是使用最廣泛的兩類β-內(nèi)酰胺類抗生素。模型抗生素的選擇是根據(jù)這些抗生素的臨床使用率以及抗生素膽汁排泄率水平做出的。
2.材料與方法
2.1試驗樣品
BL是一種重組β-內(nèi)酰胺酶,通過大腸桿菌表達、收獲以及色譜柱純化得到原液,然后將原液通過流化床噴霧干燥方法制備成腸溶包衣微丸,微丸制備時以蔗糖丸芯,逐層包衣。 每個微丸含有約 12μg 的 BL,包衣在 pH ≥5.5 時溶解。賦形劑微丸采用和BL腸溶包衣微丸類似的方法制備,但不含活性藥物成分。
2.2動物和試劑
使用健康SPF級SD大鼠,6-8周齡,一半雄性一半雌性。 第一項研究中的動物由昭衍(蘇州)新藥研究中心有限公司提供,第二項研究中的動物購自上海斯萊克實驗動物有限公司。氨芐西林鈉(華北制藥集團)和頭孢替安(大熊制藥)購自于商業(yè)供應(yīng)商。
2.3動物試驗流程及樣品采集
我們設(shè)計了兩項大鼠研究,以逐步遞進方式對 BL 產(chǎn)品進行初步動物藥效評估。
為了考察口服BL對腸道抗生素濃度的影響,在第一項研究中,使用96只SD大鼠,將動物隨機分為四組,包括賦形劑組、BL 24μg/劑量組、BL 60μg/劑量組和BL 144μg/劑量組。每組中一半的動物通過尾靜脈注射接受1劑氨芐西林鈉 (150mg/大鼠),其他動物接受1劑頭孢替安 (40mg/大鼠)。在抗生素給藥前 60、10 分鐘和 給藥后60 分鐘,通過口腔導(dǎo)管向動物給予賦形劑或 BL 微丸。在抗生素注射給藥后 15 和 45 分鐘,通過下頜下靜脈或眼眶收集血液樣本。所有動物在抗生素給藥后 120 分鐘使用二氧化碳過量吸入處死,將十二指腸到盲腸前段的腸道部分切成兩個相等長度的部分(即腸段1和腸段2)。將血樣置于含有pH7.4 PBS緩沖液和200 mmol/L EDTA的離心管中,1000g離心10分鐘,收集血漿并在-20℃以下保存至分析。將腸段樣品用剪刀剪碎,轉(zhuǎn)移至50 mL離心管中,立即加入2 mL含20 mmol/L EDTA的pH7.4 PBS緩沖液,渦旋2 min,10000 g、4℃離心10 分鐘,收集上清液并儲存在-20°C 以下用于分析。
為了考察BL對排泄至腸道抗生素所致雙歧桿菌和乳酸桿菌損傷的保護作用,第二項研究采用 144 只 SD 大鼠,其中一半用于氨芐西林鈉隊列,另一半用于頭孢替安隊列。對于每個抗生素隊列,將SD大鼠隨機分為六組,包括未治療組、僅抗生素組、賦形劑組、BL 72μg/劑量組、BL 144μg/劑量組和BL 216μg/劑量組。除未治療組外,所有組動物每天腹腔注射抗生素(氨芐西林鈉150mg/劑或頭孢替安160mg/劑),連續(xù)3天。在與第一項研究中抗生素施用前后相同的預(yù)定時間點,分別向賦形劑組和三個 BL 組的動物每天三次給予賦形劑和 BL 微丸。在治療前(第 0 天)和治療開始后 1、3 天(第 1、3 天)從每只動物中采集糞便樣品。未治療組動物僅采集糞便樣品,不給予抗生素、賦形劑或BL處理。對糞便樣品稱重,用PBS緩沖液對糞便樣品進行10至10的系列稀釋,用于雙歧桿菌和乳酸菌培養(yǎng)。
2.4抗生素濃度檢測
使用液相色譜渦輪離子噴霧串聯(lián)質(zhì)譜法(LC/MS/MS)分析血漿和腸段上清液樣品的抗生素濃度。采用Ultimate XB-C18 分析柱,以 5 mM 甲酸銨(0.1% 甲酸)-乙腈為流動相進行梯度洗脫,用于氨芐青霉素濃度測定。 對于頭孢替安,選擇 Waters AltlantisT3柱,使用 5 mM 甲酸銨(0.1% 甲酸)-甲醇作為流動相進行梯度洗脫。 檢測詞用多反應(yīng)監(jiān)測 (MRM) 模式在正離子模式下使用電噴霧電離進行的。
2.5雙歧桿菌和乳酸桿菌糞便樣品培養(yǎng)和計數(shù)
渦旋后,將 5 個稀釋度的液體(10、10~10)各取 50 μl 涂在新鮮制備的 TPY 和 MRS 瓊脂平板上(培養(yǎng)基購于青島海博生物),然后在厭氧罐中用三元混合氣體(氧氣:氮氣:二氧化碳=5%:80-85%:10-15%)37°C 孵育過夜。
培養(yǎng)的雙歧桿菌和乳酸菌的計數(shù)方法采用之前報道并收載于FDA Bacteriological Analytical Manual中的常規(guī)平板計數(shù)法,稍作修改,包括將30~300設(shè)為正常平板的優(yōu)選范圍。
2.6數(shù)據(jù)及統(tǒng)計分析
所有統(tǒng)計分析采用雙側(cè)檢驗,設(shè)置顯著性水平為0.05。
首先采用Levene 檢驗檢測方差齊性。如果結(jié)果不顯著,則進行單因素方差分析 (ANOVA),否則進行 Kruskal-Wallis 檢驗。 如果ANOVA檢測出顯著性,進一步采用Dennett 檢驗進行多重比較;如果在 Kruskal-Wallis 檢驗中發(fā)現(xiàn)差異,多重比較采用 Mann-Whitney U 檢驗。
3結(jié)果
3.1 BL對血清β-內(nèi)酰胺抗生素水平無治療相關(guān)影響
在靜脈注射兩種抗生素后,在兩個給藥后時間點,所有動物的血漿中均可檢出抗生素。在兩個時間點的血清氨芐西林濃度和15min時間點血清頭孢替安濃度,所有四組之間均無顯著差異(表 1)。
對于45 min時的血清頭孢替安濃度,BL 60μg/劑量組、BL 144μg/劑量組與其他兩組差異有統(tǒng)計學(xué)意義。 然而,由于在考察劑量范圍內(nèi)沒有發(fā)現(xiàn)這種濃度降低具有劑量-反應(yīng)效應(yīng),并且變化幅度較小,因此推測這種變化與 BL 無關(guān)。
3.2 BL降低排泄入腸道的β-內(nèi)酰胺抗生素濃度
靜脈給藥后 120 分鐘,賦形劑組動物腸段兩種β-內(nèi)酰胺類抗生素均處于高濃度水平,氨芐青霉素最高至1881μg/mL,頭孢替安最高至 2274μg/mL。 腸段2氨芐西林和頭孢替安濃度分別比腸段1高3~65倍和13~237倍,表明靜脈注射2小時后排泄的抗生素大部分已進入腸道后半段(表2) 。
對于兩種抗生素及相應(yīng)兩個腸段,三個 BL 治療組均呈劑量依賴性降低抗生素濃度,并且在 BL 144μg/劑量組中只有很少腸段樣品可檢出抗生素。 BL三個劑量均顯著降低了腸段2抗生素濃度,中高劑量BL(60~144μg)顯著降低了腸段1抗生素濃度。60μg/劑量被認為當(dāng)前試驗條件下BL降解排泄入腸道氨芐青霉素和頭孢替安的有效劑量。
3.3 BL保護腸道益生菌免受β-內(nèi)酰胺類抗生素損傷
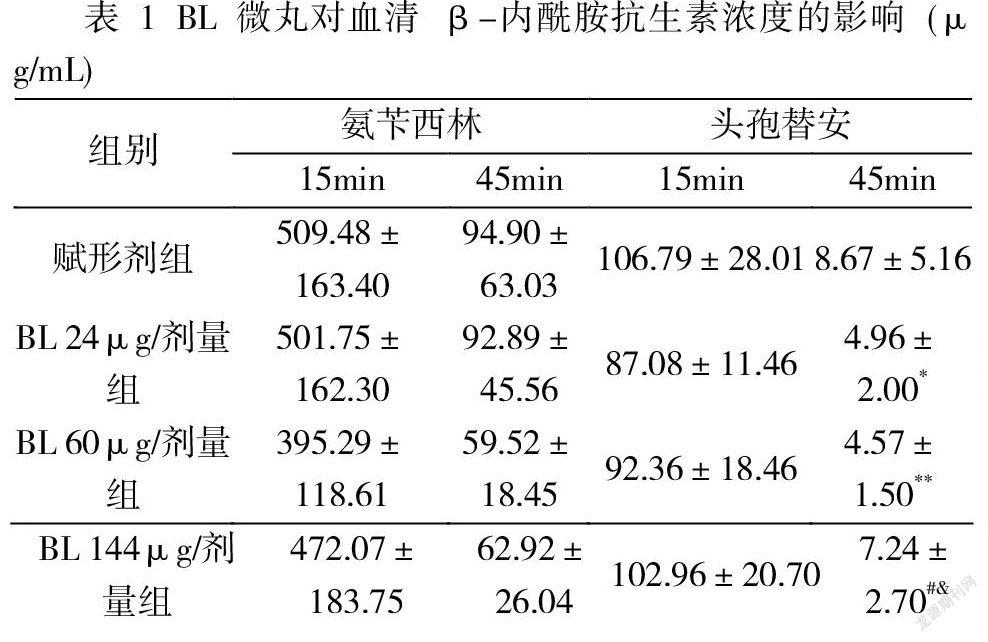
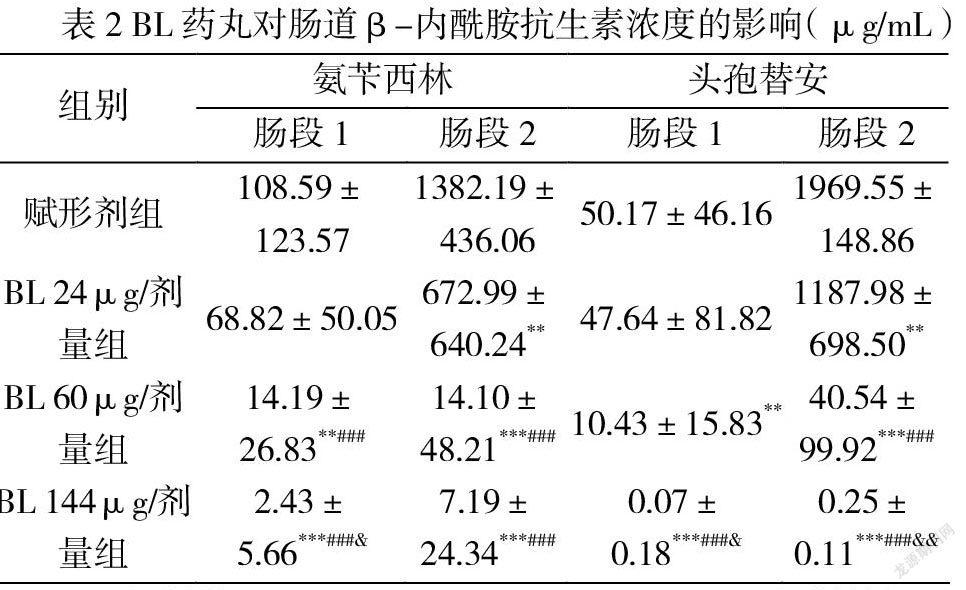
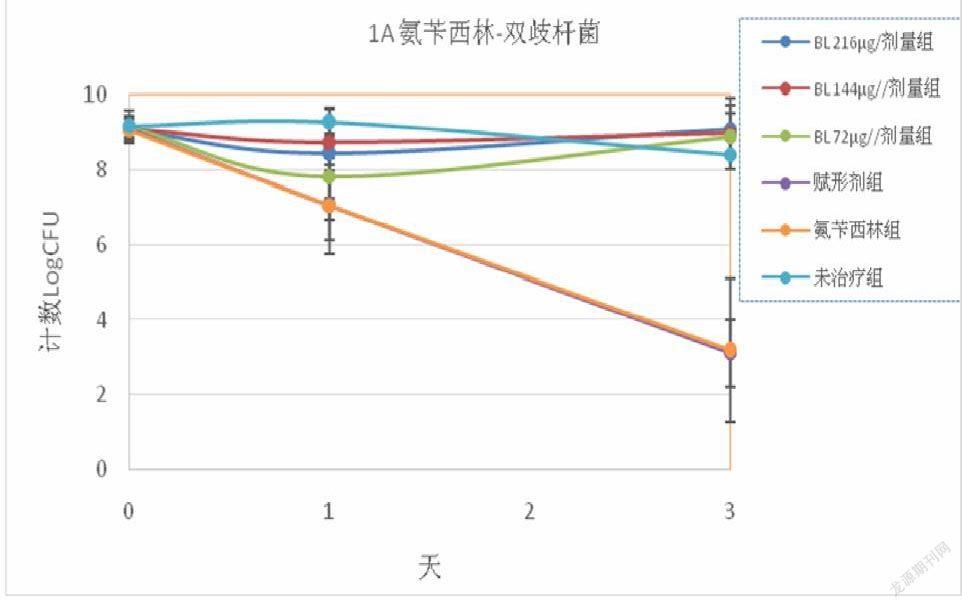
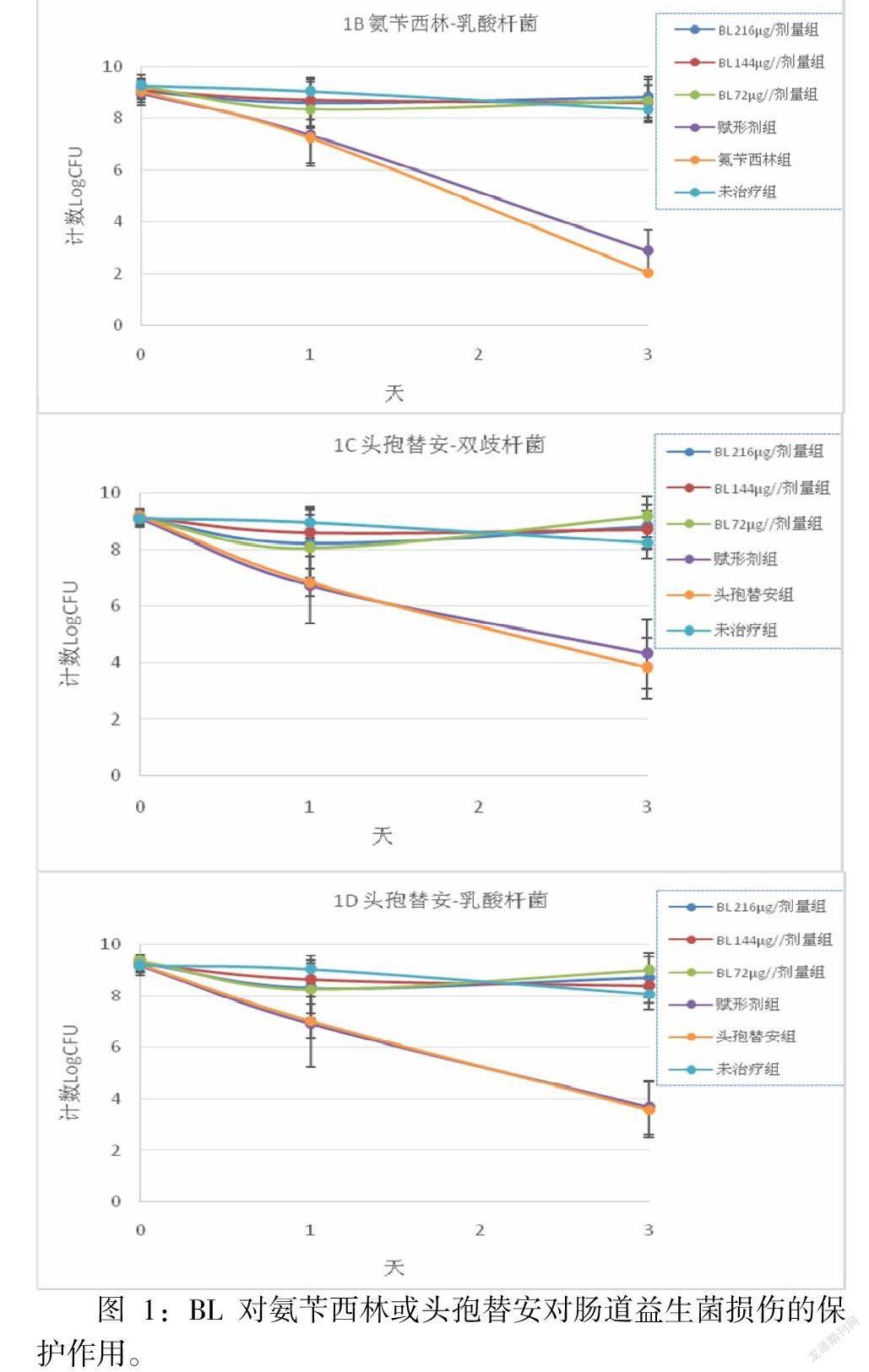
兩種β-內(nèi)酰胺抗生素均導(dǎo)致雙歧桿菌和乳酸桿菌水平隨時間顯著下降。 與未治療組相比,氨芐西林導(dǎo)致第 1 天雙歧桿菌和乳酸桿菌水平分別下降 1.79 和 2.22 logCFU,第 3 天下降 5.23 和 6.33 logCFU。頭孢替安表現(xiàn)出類似的變化趨勢,第 1 天下降 2.12 和 1.99 logCFU,第 3天下降 4.44 和 4.48 logCFU(圖 1),賦形劑處理與僅抗生素組相比沒有任何顯著差異。 然而,即使在最低劑量(72μg/劑量)下,BL干預(yù)也可以減輕這些抗生素對腸道益生菌的負面影響。對于兩種抗生素,BL組和未治療組之間以及三種BL治療之間的雙歧桿菌和乳酸菌計數(shù)均未觀察到統(tǒng)計學(xué)差異。
A和B:用氨芐青霉素處理動物和未治療組動物的雙歧桿菌和乳酸桿菌菌落計數(shù)(LogCFU)。 C和D:用頭孢替安處理動物和未治療組動物的雙歧桿菌和乳酸桿菌菌落計數(shù)(LogCFU)
4討論
我們在這些大鼠模型中表明,口服給予我們的重組β-內(nèi)酰胺酶--BL可以降解注射后排泄進入大鼠腸道中β-內(nèi)酰胺抗生素,同時維持抗生素高血清濃度和系統(tǒng)暴露水平,因此推測不會這些抗生素注射后的藥效作用產(chǎn)生不利影響。該發(fā)現(xiàn)與之前另一種重組 β-內(nèi)酰胺酶產(chǎn)品 P1A 的報告一致,后者在狗空腸瘺手術(shù)模型中證明口服 β-內(nèi)酰胺酶對血清抗生素濃度無不利影響,這可能是因為, 25kD 大分子量的蛋白質(zhì)在保持其功能構(gòu)象的同時被吸收到血液循環(huán)中理論上是難以實現(xiàn)的。
保護腸道菌群免受抗生素引起的損害對于維持人類健康至關(guān)重要。 數(shù)千年來,腸道菌群與其哺乳動物宿主共同進化,并在消化、大量營養(yǎng)素代謝、解毒、抵御病原體和許多其他方面使宿主受益。 據(jù)報道,菌群在宿主免疫系統(tǒng)的誘導(dǎo)、教育和功能中也具有重要作用。 在龐大的腸道細菌群落中,雙歧桿菌是嬰兒腸道中占主導(dǎo)地位的一個屬,而在成年后水平降低但保持穩(wěn)定。
值得注意的是,如我們的研究所示,β-內(nèi)酰胺類抗生素會以時間依賴性方式顯著破壞腸道菌群落,如雙歧桿菌數(shù)量降低最大約 10 倍,乳酸桿菌最大約 10 倍。 腸道菌群紊亂可能促進傳染病的發(fā)展,病原體經(jīng)常利用來自宿主腸道菌群的信號來傳播和加速感染進程。
BL干預(yù)可以保護腸道菌群雙歧桿菌和乳酸桿菌免受排泄入腸道β-內(nèi)酰胺抗生素造成的損害。 這種對腸道菌群的保護作用對于預(yù)防 β-內(nèi)酰胺抗生素導(dǎo)致的潛在不利后果,例如腹瀉、艱難梭菌感染假膜性腸炎等,具有重要臨床意義。
5結(jié)論
總之,我們在大鼠模型中證明,口服給予BL可以降解注射給藥后排泄入腸道中的青霉素和頭孢菌素類抗生素,并可以保護腸道益生菌免受β-內(nèi)酰胺類抗生素引起的破壞。
BL 在人類中的有效性需要進一步的研究來證明。
參考文獻
[1]Ubeda C, Djukovic A, Isaac S. 2017. Roles of the intestinal microbiota in pathogen protection. Clin Transl Immunology. 6, 2(Feb, 2017), e128.
[2]Libertucci J, Young VB. 2019. The role of the microbiota in infectious diseases. Nat Microbiol. 4, 1(Jan, 2019), 35-45.
[3]Zheng D, Liwinski T, Elinav E. 2020. Interaction between microbiota and immunity in health and disease. Cell Res. 30, 6(Jan, 2020), 492-506.
[4]Sochocka M, Donskow-?ysoniewska K, Diniz BS, Kurpas D, Brzozowska E, Leszek J. 2019. The Gut Microbiome Alterations and Inflammation-Driven Pathogenesis of Alzheimer's Disease-a Critical Review. Mol Neurobiol. 56, 3(Mar, 2019), 1841-1851.
[5]Newton DF, Macfarlane S, Macfarlane GT. 2013. Effects of antibiotics on bacterial species composition and metabolic activities in chemostats containing defined populations of human gut microorganisms. Antimicrob Agents Chemother. 57, 5(May, 2013), 2016-2025.
[6]Yoon MY, Yoon SS. 2018. Disruption of the Gut Ecosystem by Antibiotics. Yonsei Med J. 59, 1(Jan, 2018), 4-12.
[7]Becattini S, Taur Y, Pamer EG. 2016. Antibiotic-Induced Changes in the Intestinal Microbiota and Disease. Trends Mol Med. 22, 6(Jun, 2016), 458-478.
[8]Brogard JM, Arnaud JP, Blickle JF, Levy P, Dorner M, Lautier F. 1986. Biliary elimination of cefotiam, an experimental and clinical study. Chemotherapy. 32, 3, 222-235.
[9]Larry M,James T. P. 2001. Bacteriological Analytical Manual, Chapter 3: Aerobic Plate Count. FDA, 2001.
[10]Harmoinen J, Vaali K, Koski P, et al.2003. Enzymic degradation of a beta-lactam antibiotic, ampicillin, in the gut: a novel treatment modality. J Antimicrob Chemother. 51, 2(Feb 2003), 361-365.
[11]Wu HJ, Wu E. 2012. The role of gut microbiota in immune homeostasis and autoimmunity. Gut Microbes. 3, 1(Jan-Feb, 2012), 4-14.
[12]Belkaid Y, Harrison OJ. 2017. Homeostatic Immunity and the Microbiota. Immunity. 46, 4(Apr, 2017), 562-576.
[13]Arboleya S, Watkins C, Stanton C, Ross RP.2016. Gut Bifidobacteria Populations in Human Health and Aging. Front Microbiol. 7(Aug, 2016), 1204.
[14]Lv L X, Jiang H Y, Yan R, et al. 2019. Interactions Between Gut Microbiota and Hosts and Their Role in Infectious Diseases. Infectious Microbes & Diseases. 1, 1(Sep, 2019), 3-9.
姓名 :羅啟劍、性別 :男、出生年月:1978.12、籍貫(精確到市):安徽省廬江縣(現(xiàn)屬合肥市)、學(xué)歷:研究生、職稱:中級工程師、研究方向:生物醫(yī)藥
單位:上海聯(lián)合賽爾生物工程有限公司、單位郵編 :201206
2321500783254

