基于TNF-α/NF-κB信號通路探討銀萊湯治療肺炎的作用機制
胡莉 白辰 龍超君 卓麗清 朱敬儒 劉邵陽 于河 谷曉紅 劉鐵鋼
銀萊湯以肺與胃腸同治法組方,系首都名中醫谷曉紅教授治療小兒肺炎經驗方,臨床效果顯著[1]。“溫邪上受,首先犯肺”,小兒處于肺炎肺熱證時,易傳變至陽明。根據中醫“既病防變”的治未病思想,在小兒肺炎肺熱證階段時,以肺與胃腸同治立法組方的銀萊湯,除可清肺臟之邪熱,也可調暢胃腸氣機,清泄胃腸積熱,并阻斷肺經邪熱向胃腸的傳變。前期研究[2-5]發現,銀萊湯具有明確的抗炎作用,但其作用機制尚未明確。本研究以霧化吸入脂多糖(lipopolysaccharide,LPS)制備幼年大鼠肺炎模型為基礎,探討銀萊湯對本模型肺、腸組織的干預機制。
1 材料和方法
1.1 動物
SPF級雄性SD幼年大鼠40只,體質量(100±10)g,購自北京維通利華動物技術有限公司,許可證號:110011211102012854。飼養條件:室溫(25±2)℃,濕度(50±10)%,每天換氣,保持12小時/12小時光暗照明,食水不限。研究方案獲動物倫理委員會批準(批準文號:BUCM-4-2021030305-1046)。
1.2 試劑
銀萊湯藥物顆粒,由金銀花30 g、萊菔子10 g、連翹15 g、黃芩10 g、魚腥草20 g、全瓜蔞15 g、前胡10 g組成,共110 g,購自北京康仁堂藥業有限公司;醋酸潑尼松片(規格5mg/片),購自浙江仙琚制藥股份有限公司;LPS(批號:L2880),購自Sigma公司;通用型組織固定液(批號:G1101),購自武漢賽維爾生物科技有限公司;大鼠腫瘤壞死因子-α(transforming necrosis factor-α,TNF-α)、白細胞介素-6(interleukin-6,IL-6)、白細胞介素-1β(interleukin-1β,IL-1β)ELISA試劑盒(批號:E-EL-R2856c、E-EL-R0015c、E-EL-R0012c),購自武漢伊萊瑞特生物科技股份有限公司;兔多抗腫瘤壞死因子受體1(tumor necrosis factor receptor-1,TNFR1,50KD)、兔多抗TNFR1相關死亡結構域蛋白(TNFR1-associated death domain protein,TRADD,35KD)、兔單抗腫瘤壞死因子受體相關因子2(TNF receptor associated factor2,TRAF2,53KD)、鼠單抗受體相互作用蛋白1(receptor interacting protein1,RIP1,76kd)、兔單抗IκB 激酶 β(ikappaB kinaseβ,IKKβ,87KD)(批號:Ab19139、Ab223040、Ab126758、Ab72139、Ab178870),購自Abcam公司;兔多抗細胞核因子-κBp65(nuclear factor-κBp65,NF-κBp65,65KD)(批號:10745-1-AP),購自武漢三鷹生物技術有限公司。
1.3 儀器
微量移液器(Eppendorf);電泳儀電源、垂直電泳槽、電轉儀(型號:DYY-7C、DYCZ-24DN、DYCZ-40,北京六一儀器廠);磁力攪拌器(型號:T8-1,江蘇省金壇市中大儀器廠);電子天平(型號:CPA,北京賽多利斯儀器系統有限公司);離心機(型號:HI650,湖南湘儀實驗室儀器開發有限公司);酶標儀(型號:mμlISKANMK3,Thermo)。
1.4 分組、造模及給藥方法
將40只SPF級SD大鼠隨機分為正常組(normal control group,N)、肺炎組(pneumonia group,P)、銀萊湯治療組(pneumonia treatment group,PT)和醋酸潑尼松組(prednisone acetate,PRE),每組10只。肺炎組、銀萊湯治療組、醋酸潑尼松組以LPS(0.5 mg/mL)霧化造模,持續3天,2次/天,30分鐘/次,正常組以純水霧化吸入。霧化造模[6]后,銀萊湯治療組、醋酸潑尼松組分別以銀萊湯和醋酸潑尼松溶液灌胃(1 mL/100 g),正常組和肺炎組以等量純水灌胃。肺炎模型成模標準:取大鼠肺組織,多聚甲醛固定,石蠟包埋、切片后,以HE染色法檢測肺病理,鏡下觀察到炎性改變[6]。
1.5 肺、結腸組織病理切片制作
經過3天的霧化、灌胃造模后;第4天上午,大鼠腹腔注射10%水合氯醛(0.2 mL/100 g)麻醉。冰上取肺、結腸組織,組織固定液固定,室溫搖床放置24小時;蒸餾水清洗后進行梯度乙醇脫水,制作組織蠟塊;冰上預冷切片(4 μm),60℃烤片1小時。使用前將組織切片常規脫蠟復水,HE染色細胞核和細胞質,使用中性樹膠封片,顯微鏡下觀察肺、結腸組織病理變化。
1.6 肺、結腸組織炎癥因子檢測
每組取6只大鼠檢測炎癥因子。先制備組織樣品上清液:準確稱取組織重量,按重量(g)9倍的體積(mL)比例加入生理鹽水勻漿,3500 r/分鐘離心10分鐘,取上清作為待測樣品檢測。嚴格按照ELISA試劑盒說明書進行操作,于酶標儀在450 nm波長測量各孔的光密度(optical density,OD值),計算肺、結腸組織中TNF-α、IL-6、IL-1β含量。
1.7 肺、腸組織目標蛋白檢測
分別取20 mg大鼠肺、結腸組織,加入RIPA裂解液裂解,于自動勻漿機中勻漿,勻漿完成后置于冰上30分鐘充分裂解。BCA法測定蛋白濃度,等量蛋白經過SDS-聚丙烯酰胺凝膠電泳,轉移到PVDF膜上,5%脫脂奶粉室溫封閉2小時;分別加入TNFR1(1∶1000)、TRADD(1∶2000)、TRAF2(1∶1000)、RIP1(1∶500)、IKKβ(1∶1000)、NF-κBp65(1∶1000)一抗,4℃孵育過夜;TBST充分漂洗5次,每次5分鐘;滴加HRP標記二抗(1∶50000),室溫孵育2小時,TBST充分漂洗5次,每次5分鐘。將ECL試劑中增強液與穩定的過氧化物酶溶液按1∶1比例混勻,滴加工作液于PVDF膜上,置凝膠成像系統顯影。
1.8 統計學方法
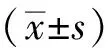
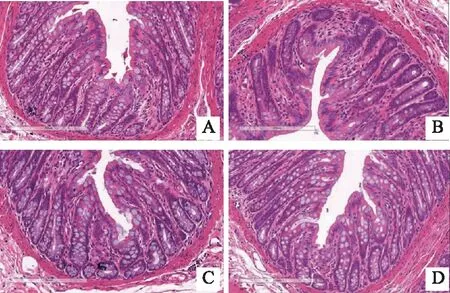
2 結果
2.1 大鼠肺、結腸組織病理變化
2.1.1 大鼠肺組織病理變化 HE染色顯示,正常組肺組織肺泡結構完整、肺泡壁薄,未見炎性細胞浸潤,細支氣管結構完整清晰。肺炎組大鼠肺組織出現損傷,肺泡壁增厚,出現大面積炎癥浸潤,部分肺泡腔結構消失。銀萊湯治療組和醋酸潑尼松組大鼠肺組織損傷較肺炎組減輕,肺泡結構完整性較好,炎性浸潤減輕(見圖1)。
注:A 正常組;B 肺炎組;C銀萊湯治療組;D醋酸潑尼松組。
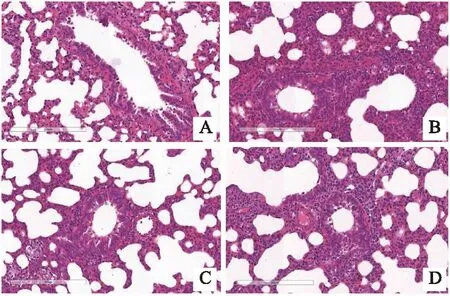
2.1.2 大鼠結腸組織病理變化 HE染色結果顯示,正常組大鼠結腸組織結構完整,隱窩較深,杯狀細胞排列整齊,未見炎性細胞浸潤,無潰瘍。肺炎組大鼠結腸組織大部分呈現黏膜完整性破壞,結腸隱窩和杯狀細胞明顯減少,炎性細胞浸潤增多。銀萊湯治療組和醋酸潑尼松組大鼠結腸組織均有明顯改善,隱窩變淺,杯狀細胞增多,炎性細胞浸潤減少(見圖2)。
2.2 大鼠肺組織、結腸組織炎癥因子表達水平
2.2.1 大鼠肺組織TNF-α、IL-6、IL-1β表達水平 與正常組比較,肺炎組大鼠肺組織中TNF-α、IL-6、IL-1β相對表達明顯升高(P<0.01),銀萊湯治療組和醋酸潑尼松組大鼠肺組織中TNF-α、IL-6、IL-1β表達也明顯升高(P<0.01)。與肺炎組比較,銀萊湯治療組和醋酸潑尼松組大鼠肺組織中TNF-α、IL-6、IL-1β相對表達明顯降低(P<0.01)。見表1。
注:A 正常組;B 肺炎組;C銀萊湯治療組;D醋酸潑尼松組。
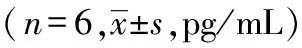
表1 各組大鼠肺組織中TNF-α、IL-6、IL-1β表達水平比較
2.2.2 大鼠結腸組織TNF-α、IL-6、IL-1β表達水平 與正常組比較,肺炎組大鼠結腸組織中TNF-α、IL-6、IL-1β相對表達明顯升高(P<0.01),銀萊湯治療組和醋酸潑尼松組大鼠結腸組織中TNF-α、IL-6、IL-1β表達也明顯升高(P<0.01)。與肺炎組比較,銀萊湯治療組和醋酸潑尼松組大鼠結腸組織中TNF-α、IL-6、IL-1β相對表達明顯降低(P<0.01。見表2。
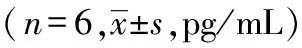
表2 各組大鼠結腸組織中TNF-α、IL-6、IL-1β表達水平比較
2.3 大鼠肺、結腸組織蛋白表達水平
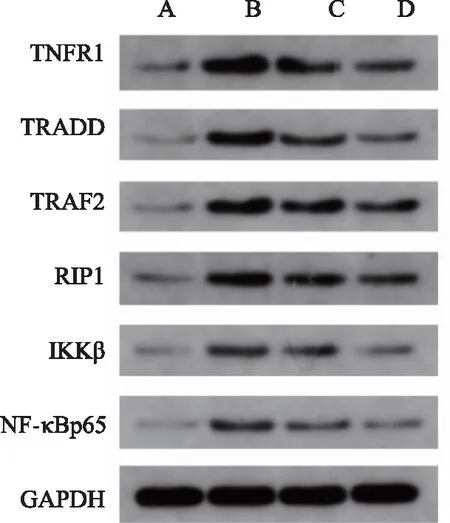
2.3.1 大鼠肺組織中TNF-α/NF-κB信號通路上TNFR1、TRADD、TRAF2、RIP1、IKKβ、NF-κBp65蛋白表達 與正常組比較,肺炎組大鼠肺組織TNFR1、TRADD、TRAF2、RIP1、IKKβ、NF-κBp65蛋白表達明顯升高(P<0.01);銀萊湯治療組和醋酸潑尼松組大鼠肺組織TNFR1、TRAF2、RIP1、IKKβ、NF-κBp65蛋白表達也明顯升高(P<0.05、P<0.01),銀萊湯治療組和醋酸潑尼松組大鼠肺組織TRADD蛋白表達呈現升高趨勢,但無統計學意義(P>0.05)。與肺炎組比較,銀萊湯治療組和醋酸潑尼松組大鼠肺組織中TNFR1、TRAF2、RIP1、IKKβ、NF-κBp65蛋白表達明顯降低(P<0.05、P<0.01),TRADD蛋白表達呈現降低趨勢,但沒有統計學差異(P>0.05)。見圖3、表3。
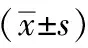
表3 各組大鼠肺組織中TNFR1、TRADD、TRAF2、RIP1、IKKβ、NF-κBp65蛋白表達水平比較
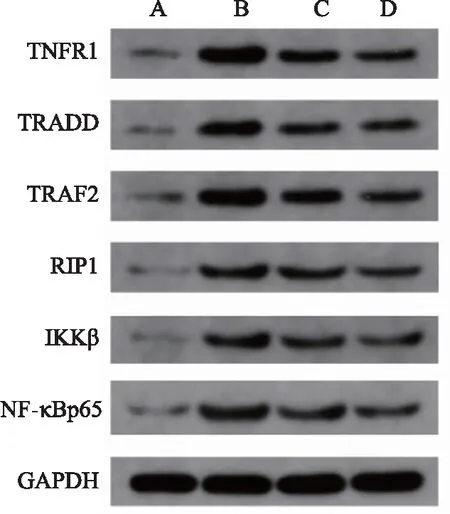
注:A 正常組;B 肺炎組;C銀萊湯治療組;D醋酸潑尼松組。
2.3.2 大鼠結腸組織中TNF-α/NF-κB信號通路上TNFR1、TRADD、TRAF2、RIP1、IKKβ、NF-κBp65蛋白表達 與正常組相比,肺炎組大鼠結腸組織TNFR1、TRADD、TRAF2、RIP1、IKKβ、NF-κBp65蛋白表達明顯升高(P<0.01);銀萊湯治療組大鼠結腸組織TNFR1、TRADD、TRAF2、RIP1、IKKβ、NF-κBp65蛋白表達明顯升高(P<0.05、P<0.01);醋酸潑尼松組大鼠結腸組織TNFR1、IKKβ、NF-κBp65蛋白表達明顯升高(P<0.05、P<0.01),TRADD、TRAF2、RIP1蛋白表達與正常組無統計學差異(P>0.05)。與肺炎組比較,銀萊湯治療組大鼠結腸組織中TNFR1、IKKβ、NF-κBp65蛋白表達明顯降低(P<0.05、P<0.01),TRADD、TRAF2、RIP1蛋白表達呈現降低趨勢但無統計學差異(P>0.05);醋酸潑尼松組大鼠結腸組織TNFR1、TRADD、TRAF2、IKKβ、NF-κBp65蛋白表達明顯降低(P<0.05、P<0.01),RIP1蛋白表達呈現降低趨勢但無統計學差異(P>0.05)。見表4、圖4。
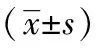
表4 各組大鼠結腸組織中TNFR1、TRADD、TRAF2、RIP1、IKKβ、NF-κBp65蛋白表達水平比較
注:A 正常組;B 肺炎組;C銀萊湯治療組;D醋酸潑尼松組。
3 討論
肺與胃腸同治是小兒外感發熱的核心治法之一。宣透衛分邪氣,可清解肺經郁熱;運化中焦氣機,消導胃腸積滯,可清泄陽明氣分熱邪,肺胃腸同治共奏解熱良效[7]。銀萊湯全方由金銀花、萊菔子、連翹、黃芩、全瓜蔞、魚腥草、前胡組成;金銀花善清肺胃之熱,萊菔子下氣化積、導滯祛邪,二者共用為君藥;連翹上可清宣肺熱,下能通利小便;黃芩彰顯清肺之功,魚腥草清熱宣肺化痰,全瓜蔞肺腸同治,前胡下氣降痰;全方諸藥入肺、胃、大腸經,共同發揮肺與胃腸同治的作用。
由于肺與腸具有相同的胚胎起源,他們除了在結構上具有相似性[8],在生理和病理狀態下還可以相互影響[9]。目前肺—腸軸的研究包括兩方面[10]:一是共同黏膜免疫反應,肺與腸之間免疫信號的傳遞以淋巴液為載體,當外來抗原被淋巴集結捕獲后[11],促使幼稚的T淋巴和B淋巴細胞致敏,通過腸系膜淋巴結進入血液,引發各個效應點的黏膜免疫。二是肺部疾病特別是感染性疾病造成的菌群紊亂可以通過免疫調節影響消化道,如注射IL-25的小鼠在其肺部發現了激活的腸道內固有淋巴細胞ILC2s,肺炎模型小鼠的肺部同樣檢測了腸道內固有淋巴細胞ILC3s,這些反應都可幫助機體抵抗感染[12];肺部的微生物可以以Toll樣受體(toll-like receptor,TLR)非依賴的方式協同激活宿主p38絲裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK),以放大促炎反應[13];腸道菌群的代謝產物會影響肺部的免疫反應,腸道菌群可以通過調節T細胞促進抗炎反應,產生促炎性細胞因子破壞黏膜屏障,也可以通過抑制核轉錄因子抑制劑α(inhibitor a of NF-κB,IκBα)下調炎癥反應,誘導產生抗菌肽、分泌性免疫球蛋白A(secretory immunoglobulin A,SIgA)防御黏膜損傷[14],故肺臟疾病治療肺的同時需增強腸道防護功能來減輕肺部的免疫反應。
肺—腸軸作為連接呼吸道與胃腸道之間的雙向通道,在疾病的發生發展上表現為“肺病及腸”和“腸病及肺”兩個方面[6,15-16],如腸黏膜有極其豐富的毛細血管,是對缺血缺氧最敏感的部位,這一代謝活躍的器官在慢阻肺患者日常活動中反復出現局部缺氧而影響其功能[17];且在團隊前期前瞻性研究的基礎上,可以發現胃腸積熱與呼吸道感染存在相關性[18];實驗研究證明,高熱量飲食已被證明會加重肺炎的病情并延遲康復,尤其是在兒童中[19]。銀萊湯可以通過調節宿主免疫炎癥反應、血管生成和血管通透性、氣道上皮細胞的屏障功能、激素釋放和細胞生長、增殖和凋亡來減輕肺炎的癥狀和體征[6]。在共同黏膜免疫和腸道菌群對呼吸道和胃腸道的聯系外,目前對肺與腸直接聯系較少,且前期通過網絡藥理學分析,得到銀萊湯相關通路中與炎癥關系最為密切的是TNF信號通路和TLRs信號通路,兩者又共同包含NF-κB信號通路,故基于TNF-α/NF-κB信號通路,探討銀萊湯治療肺炎中對肺、腸組織的干預機制具有重要意義。
TNF-α是免疫的中間調節因子[20]。TNF-α是NF-κB的主要激活因子之一[21],TNF-α能通過刺激NF-κB p65的磷酸化并幫助它轉移到細胞核,同時它又能激活許多靶基因,其中包括TNF-α自身[22],形成促炎反應的積極循環。TNF-α刺激的TNF-α受體1(tumor necrosis factor receptor-1,TNFR1)通過招募上游信號分子,如TNF受體相關因子2(TNF receptor associated factor 2,TRAF2)和IκB 激酶(IκB kinase β,IKK),觸發TNF-α/NF-κB的反應,形成TNFR1復合物[23]。在TNF-α未與TNFR1結合前,TNFR1在胞內區域和一種抑制蛋白(silencer of death domain,SODD)結合,防止TNFR1胞內區在無TNF-α的狀態下發生自聚反應引起通路的激活[24]。只有當TNF-α三聚體結合到TNFR1的胞外區后,胞內區上的SODD隨之被釋放[24],TRADD通過與TNFR1的死亡結構結合,形成TNFR1/TRADD復合體,隨后招募一系列的受體相關蛋白到復合體上,包括TRAF2、RIP,形成TNFR1復合體引發下游的信號通路[25]。
NF-κB信號傳導是一種關鍵的促炎癥途徑,NF-κB由RelA(p65)/p50異源二聚體組成[26],p65是NF-κB通路激活的主要轉錄調節劑[27],通過將p65DNA結合因子轉移到細胞核發出信號[28]。在靜息狀態下,無活性的NF-κB被一種稱為IκB的抑制性亞基保留在細胞質中[29]。含有IKKα、IKKβ的IKK和調節蛋白NF-κB必需修飾劑(NF-kappaB essential modulato,NEMO)對IκB的磷酸化是NF-κB激活對各種刺激的關鍵步驟[26,30],被磷酸化后的IκBα和p65進入核內起始轉錄。
本研究結果顯示,LPS激活幼年大鼠肺組織,使得大鼠肺組織和結腸組織TNF-α/NF-κB信號通路上TNFR1、TRADD、TRAF2、RIP1、IKKβ、NF-κBp65蛋白表達均增多,促進了IKKα和IKKβ的磷酸化,NF-κBp65表達隨之增多,促進肺組織和腸組織中的促炎因子TNF-α、IL-6、IL-1β表達增多;釋放的促炎因子TNF-α又可反饋激活TNF-α/NF-κB信號通路,形成積極的促炎反應循環,加重肺組織和結腸組織的炎癥損傷。給予銀萊湯和醋酸潑尼松后,可減輕肺組織和結腸組織的炎性損傷和病理變化,并調控TNF-α/NF-κB信號通路上TNFR1、TRADD、TRAF2、RIP1、IKKβ、NF-κBp65蛋白水平的表達,降低肺組織和結腸組織中TNF-α、IL-6、IL-1β水平。本研究結果明確了銀萊湯通過抑制IKKα、IKKβ磷酸化和p65核易位來抑制TNF-α誘導的NF-κB激活。本研究表明銀萊湯通過抑制TNF-α誘導的NF-κB調節靶基因產物,改善肺組織、腸組織的炎性損傷和病理變化。

