基于UPLC-MS/MS成分分析結合網絡藥理學預測新會陳皮黃酮類成分質量標志物
陳超 繆艷燕 李慧君 李衛崗 張文生
陳皮分“陳皮”和“廣陳皮”,為中醫藥臨床常用藥,具有理氣健脾,燥濕和胃的作用。陳皮用藥載于《廣州府志》:“入藥以廣陳皮為貴,出新會者最良。”茶枝柑是新會陳皮的品種來源[1],又名新會柑。明代劉文泰在《本草品匯精要》中提到橘皮“謹按青橘、黃橘”,“功用既殊,性味亦異”,但在采摘時間上提及黃橘“十月取實”,在《中華本草》中,規定陳皮十至十二月果實成熟時取下。《中藥大詞典》注解橘皮來源于“10月以后采摘成熟果實”,其所含的揮發油、多糖、多酚、黃酮等成分具有較強的藥理活性作用[2]。從陳皮中分離并鑒定的140種化學成分中,除揮發油外,黃酮類化合物是主要的生物活性和特征成分[3]。現代藥理研究表明,黃酮類化合物具有較強的抗氧化、抗菌、抗腫瘤及心腦血管保護作用[4],其中又以橙皮苷[5]、川陳皮素[6-7]、橘皮素[8]及多甲氧基黃酮[9]等成分的藥理研究較多。基于此,全面解析新會陳皮黃酮類成分的質量標志物(quality marker,Q-marker)[10]對提高新會陳皮的臨床應用具有重要意義。
本研究首先通過新會陳皮代謝組學鑒定出黃酮類化合物,查找主要作用靶點,構建從分子到蛋白,從蛋白到疾病的分子網絡;之后利用基因本體注釋(gene ontology,GO)[11]和京都基因與基因組百科全書(Kyoto encyclopedia of genes and genomes,KEGG)[12]等生物信息富集分析,從信息學角度探索主要黃酮類化合物與其藥用價值的關聯性;最后采用分子對接技術,以核心靶點蛋白的配體作為對照,評估黃酮化合物與靶點蛋白結合的可能性,并耦合文獻檢索證據為黃酮類化合物作為新會陳皮Q-marker提供理論依據。
1 材料與方法
1.1 儀器
超高效液相色譜(SHIMADZU Nexera X2)串聯質譜(Applied Biosystems 4500 QTRAP),美國安捷倫公司;烘箱(UF160plus),Memmert;離心機(5425 R),Eppendor;超低溫冰箱(902GP-ults),Thermo Fisher。
1.2 試藥
茶枝柑果皮經干燥后作為樣品,采樣時間為2020年11月中旬,地點為新會東甲村果園(新會站北200米)。甲醇(色譜純,Merck),乙醇(色譜純,Merck),標準品(色譜純,BioBioPha/Sigma-Aldrich)。
1.3 陳皮成分UPLC-MS/MS前處理
新會陳皮樣品干燥后用研磨儀研磨至粉末狀。精確稱取粉末0.1 g,溶于含70%甲醇的提取液1.2 mL中。渦旋6次,每次30秒,間隔時間30分鐘,并放置4°C過夜萃取。使用時,12000 r/分鐘離心10分鐘,取上清,用0.22 μm微孔濾膜過濾后,存于進樣瓶。
1.4 陳皮成分UPLC-MS/MS分析
液相色譜條件:色譜柱:AgilentSB-C18 1.8 μm,2.1 mm×100 mm;流動相:A相為0.1%的甲酸的超純水,B相為含0.1%的甲酸的乙腈;洗脫梯度為5%~95%,9分鐘。10~11分鐘時,B相比例降為5%,并以5%平衡至14分鐘;流速0.35 mL/分鐘,柱溫40°C。
質譜條件(邁特維爾生物科技有限公司,武漢):由Analyst 1.6.3軟件(AB Sciex)控制運行正負兩種離子模式。電噴霧電離源(ESI)操作參數如下:離子源,渦輪噴霧;源溫度550°C;離子噴霧電壓(IS)5500 V(正離子模式)/-4500 V(負離子模式)。離子源氣體I(GSI),氣體II(GSII)和簾氣(CUR)分別設置為50、60和25.0 psi,碰撞誘導電離參數設置為高。在三重四級桿和線性離子阱模式下分別用10 μmol/L和100 μmol/L聚丙二醇溶液進行儀器調諧和質量校準。三重四級桿掃描使用多反應檢測掃描模式,并將碰撞氣體(氮氣)設置為中等。
1.5 陳皮化學成分鑒定
質控樣本由樣本混合制備而成,在測樣時混入確保儀器檢測時的穩定性。用MultiaQuant 2.0軟件進行色譜峰的積分和校正工作(去除雜峰),用色譜峰的峰面積代表陳皮中化合物的相對含量,并通過本地數據庫鑒定所測黃酮類化合物的相對含量。
1.6 成分—靶點網絡圖構建
在中藥系統藥理學數據庫與分析平臺(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)[13]和SwissTargetPrediction數據庫[14]中檢索新會陳皮候選化合物靶點,合并數據后,規范靶點基因名,得到有美國化學文摘服務社(chemical abstracts service, CAS)登記號的化合物和靶點蛋白,用Cytoscape 3.9.0軟件構建成分—靶點網絡圖。
1.7 蛋白互作(protein-protein interaction,PPI)網絡構建
將預測的化合物靶向蛋白導入STRING數據庫[15],物種參數設置為人,互作評分參數大于0.9,去除網絡圖譜中的單一節點后,用Cytoscape重構靶向蛋白互作網絡。
1.8 GO與KEGG富集分析
運用R包clusterProfiler[16]對靶點蛋白進行GO分析,包括生物過程(biological process, BP)、細胞組成(cellular component, CC)和分子功能(molecular function, MF),用多重假設檢驗(Benjaminiand hochberg,BH)方法控制假陽性(BH<0.001)。KEGG通路富集分析時使用BH<0.001。
1.9 核心成分—靶點—通路網絡構建
將關注的陳皮重要成分、預測的重要蛋白靶點及其相應的關鍵KEGG通路在Cytoscape中構建成分—靶點—通路網絡圖。
1.10 核心靶點組織分布
從人類蛋白質圖譜(The Human Protein Atlas)數據庫[17]下載基于免疫組化的組織微陣列的人類組織蛋白質的表達譜數據,篩選核心靶點蛋白組織表達數據后,用Cytoscape整理核心靶點組織表達數據,構建核心靶點組織分布網絡圖。
1.11 分子對接分析
從蛋白質結構數據庫(protein data bank,PDB)[18]中選擇辨析度較高的晶體結構作為候選靶點蛋白的3-D結構,下載PDB格式文件后,用Autodock分離蛋白中的配體,作為對照結合化合物。配體分子結構(Mol2格式)從ZINC數據庫[19]下載。
用AutoDockTools 4.2.6對蛋白結構進行去水分子、加氫、加電荷預處理。通過AutoDockVina實現配體與受體的分子對接計算,獲得結合能。
2 結果
2.1 陳皮黃酮類化合物鑒定及其靶點互作網絡分析
2.1.1 陳皮主要黃酮類化合物鑒定 圖1中每個不同顏色的質譜峰代表一種化學物質(只展示QC的負離子模式),通過UPLC-MS/MS本地數據庫鑒定所測黃酮類化合物的相對含量,共獲得新會陳皮黃酮化合物197種,取相對含量前25%作為候選標志物。
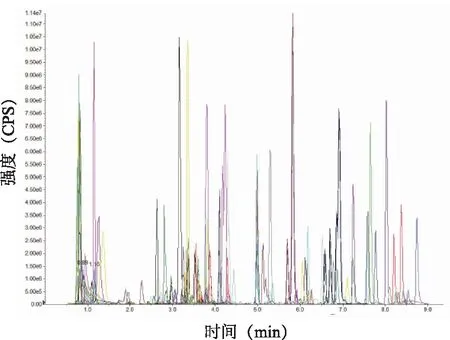
圖1 MRM代謝物檢測多峰圖(負離子模式)
2.1.2 候選化合物靶點預測 新會陳皮候選化合物中有50種相對含量較高(相對含量前25%),包括5-羥基-3,7,3′,4′-四甲氧基黃酮,7,8-二羥基-5,6,4′-三甲氧基黃酮,高車前素-7-O-葡萄糖苷,金圣草黃素-8-C-葡萄糖苷(金雀花素),山奈酚-3-O-新橙皮糖苷等。用CAS號在TCMSP和SwissTargetPrediction數據庫中檢索化合物靶點,去重合并數據后,規范靶點基因名,得到有CAS號的39個化合物及其相關蛋白492個。導入Cytoscape 3.9.0后,使用CentiScaPe 2.2插件計算網絡圖的中心“度”,見圖2。其中CAS 478-01-3(川陳皮素)、10236-47-2(柚皮素-7-O-新橙皮糖苷)、1245-15-4(5-羥基-3,7,3′,4′-四甲氧基黃酮)的度值較大分別為129、127、125。
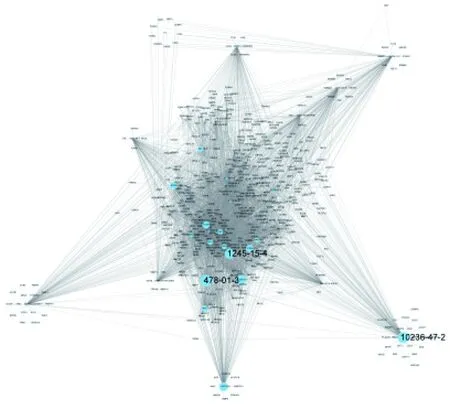
注:藍色圓形代表化合物,大小代表度值大小;其中CAS 478-01-3(川陳皮素)、10236-47-2(柚皮素-7-O-新橙皮糖苷/柚皮苷)、1245-15-4(5-羥基-3,7,3′,4′-四甲氧基黃酮)的度值分別為129、127、125。
2.1.3 候選化合物靶點蛋白互作網絡分析 將預測的化合物靶向蛋白共492個導入STRING數據庫[15],去除網絡圖譜中的單一節點后,用Cytoscape重構靶向蛋白互作網絡,結果見圖3。選取壓力中心度前10(壓力大小表明這個分子參與細胞過程的重要性)的靶點作為關鍵分子,分別為細胞腫瘤抗原(cellular tumor antigen p53,TP53,壓力144524.0)、原癌基因酪氨酸—蛋白激酶(proto-oncogene tyrosine-protein kinase,SRC,壓力126236.0)、熱休克蛋白(heat shock protein HSP90-alpha,HSP90-α,壓力113134.0)、有絲分裂原激活蛋白激酶3(mitogen-activated protein kinase 3,MAPK3,壓力80444.0)、有絲分裂原激活蛋白激酶1(MAPK1,壓力78814.0)、轉錄因子-1(transcription factor AP-1,JUN,壓力73930.0)、視黃酸受體(retinoic acid receptor RXR-alpha,RXRα,壓力72566.0)、RAC-α絲氨酸/蘇氨酸蛋白激酶(RAC-α serine/threonine-protein kinase,AKT1,壓力64714.0)、雌激素受體(estrogen receptor 1,ESR1,壓力62910.0)、細胞周期蛋白依賴性激酶1(cyclin-dependent kinase 1,CDK1,壓力58386.0)。
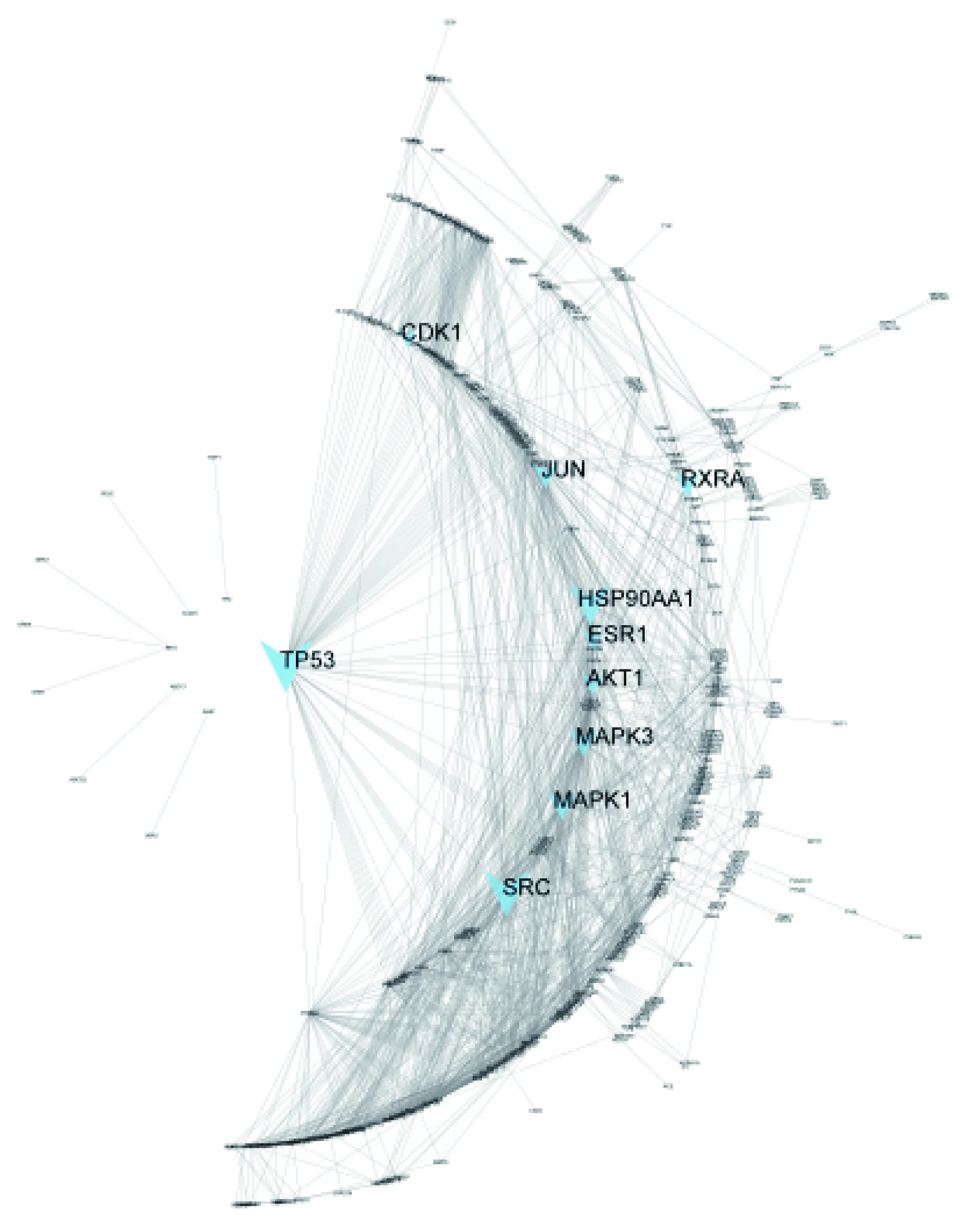
注:藍色箭頭代表在該蛋白互作網絡中壓力中心度較大的10種蛋白。
2.2 陳皮黃酮類化合物網絡藥理學分析
2.2.1 GO與KEGG富集分析 運用R包clusterProfiler對10個靶點進行GO分析,包括生物過程(biological process, BP)、細胞組成(cellular component, CC)和分子功能(molecular function, MF),用BH方法控制假陽性(BH<0.001),共獲得BP 207個,CC 4個,MF 13個,將各自的前5個條目繪制于表1。生物過程富集最顯著的是對DNA代謝過程的正調控、端粒酶活性的調節、細胞對氧化應激的反應、鎘離子反應,細胞組成為小窩、質膜筏、核染色質、偽基質,分子功能包含蛋白絲氨酸/蘇氨酸/酪氨酸激酶活性、磷酸酶結合、支架蛋白結合、磷蛋白結合、泛素蛋白連接酶結合。

表1 GO注釋功能富集分析
KEGG分析(BH<0.001)共獲得92條通路,前10條KEGG通路為內分泌抵抗、化學致癌—受體激活、脂質和動脈硬化、甲狀腺激素信號傳導途徑、雌激素信號傳導途徑、乳腺癌、催乳素信號通路、乙型肝炎、非小細胞肺癌、ErbB信號傳導途徑。說明篩選出的10個靶點蛋白可能通過這些通路發揮藥理活性,改善疾病病理變化。見表2。

表2 KEGG信號通路富集結果
2.2.2 核心成分—靶點—通路網絡構建 將3個重要成分,10個預測蛋白靶點和10個KEGG通路在Cytoscape中構建網絡關系圖,詳見圖4。
以Centiscape插件計算網絡圖的中心“度”值為參考,成分柚皮苷(Naringin)、川陳皮素 (Nobiletin)較5-羥基-3,7,3′,4′-四甲氧基黃酮(Retusin)有更高的“中心”度,AKT1、MAPK3、MAPK1、SRC 四個基因的度值均大于10(10~13),對網絡的節點聯通的貢獻度較其它基因更高。KEGG通路中化學致癌—受體激活通路(chemical carcinogenesis-receptor activation)和脂質和動脈硬化通路(lipid and atherosclerosis)的度值均為8,較其它通路高。
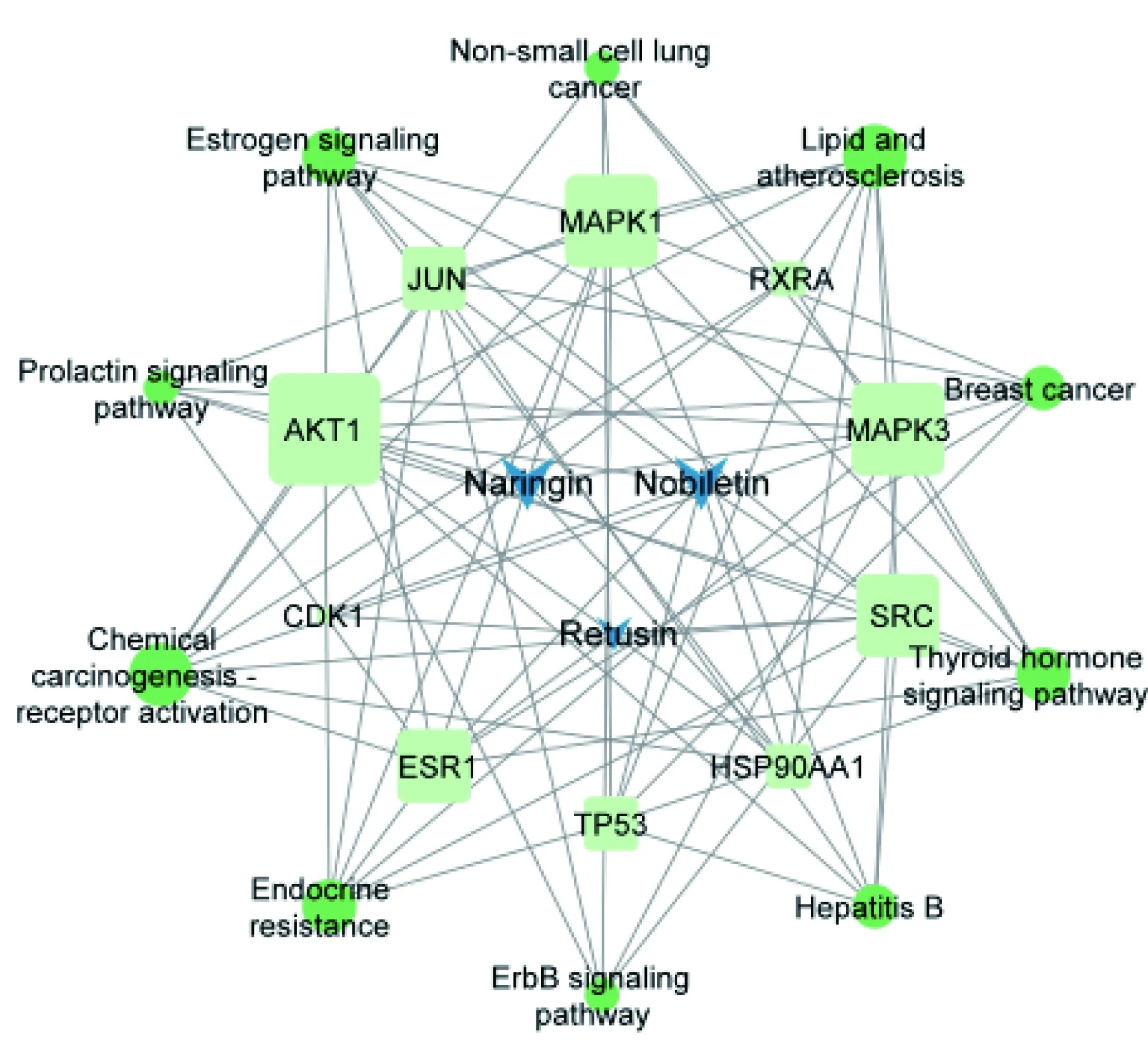
注:藍色V形代表化學成分、青色矩形代表關鍵靶點、綠色橢圓代表KEGG通路,節點大小代表度值大小。Nobiletin:川陳皮素;Naringin:柚皮苷;Retusin :5-羥基-3,7,3′,4′-四甲氧基黃酮。
2.2.3 核心靶點組織分布 從The Human Protein Atlas數據庫[17]下載基于免疫組化的組織微陣列的人類組織蛋白質的表達譜數據,篩選AKT1、MAPK3、MAPK1、SRC四種蛋白組織表達數據,共獲取277項表達數據。用Cytoscape整理核心靶點組織表達數據,見圖5。AKT1在85種組織中檢測到,MAPK3在81種組織中檢測到,MAPK1在81種組織中檢測到,SRC在30種組織中檢測到。度值最大的分別為大腦皮層(cerebral cortex)的神經膠質細胞中(glial cells)、皮膚1(skin 1)中的黑色素細胞(melanocytes)、睪丸(testis)精管中的細胞(cells in seminiferous ducts)。
2.3 陳皮黃酮類化合物分子對接靶點分析及文獻檢索
2.3.1 黃酮類化合物分子關鍵靶點及其配體結構獲取 從PDB數據庫中選擇辨析度較高的晶體結構作為AKT1、MAPK3、MAPK1、SRC四種蛋白的3-D結構,依次為1h10、4qtb、6slg、2hb8。下載PDB格式文件后,用Autodock分離蛋白中的配體,作為對照化合物,見表3。柚皮苷(Naringin)、川陳皮素(Nobiletin)的分子結構(Mol2格式)從ZINC數據庫下載。
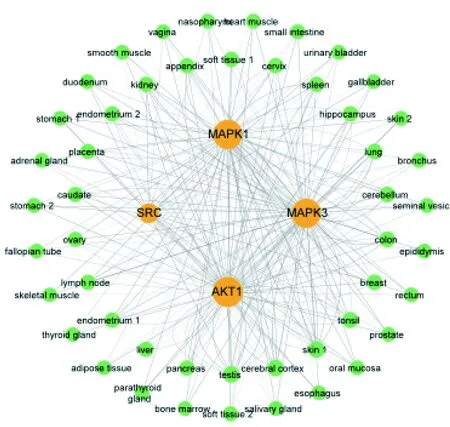
注:黃色圓形代表核心基因、綠色圓形代表人體組織或器官,節點大小代表度值大小,連線的粗細表示蛋白表達在組織中的高、中、低3個層次。AKT1:RAC-α絲氨酸/蘇氨酸蛋白激酶;MAPK3:有絲分裂原激活的蛋白激酶3;MAPK1:有絲分裂原激活的蛋白激酶1;SRC:原癌基因酪氨酸蛋白激酶。

表3 靶點—對照化合物信息
2.3.2 分子對接 用AutoDock Tools 4.2.6對蛋白結構進行去水分子、加氫、加電荷預處理。通過AutoDock Vina實現配體與受體的分子對接計算,獲得結合能后,將配體各構象與蛋白的最低結合能數據列于表4。
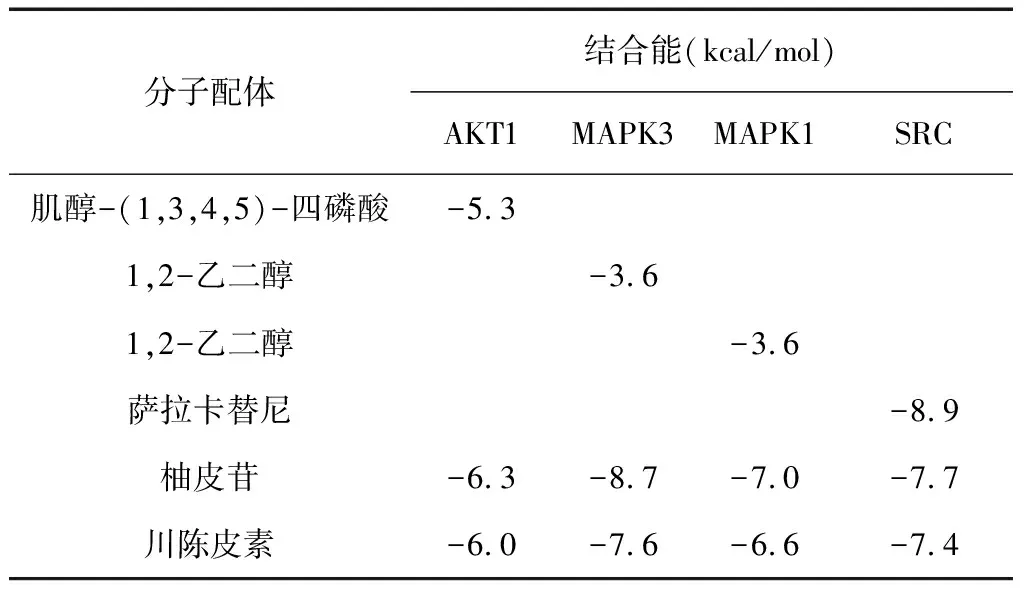
表4 受體與配體結合的吉布斯自由能
“廣陳皮”已被列入《中華人民共和國藥典(一部)》,橙皮苷、川陳皮素和橘皮素作為質量檢測物質用于控制藥材與飲片質量。因此,本文只用Pymol 2.5軟件展示柚皮苷分子對接結果,結合位點用籠型球體標注可能的氫鍵位置,見圖6。
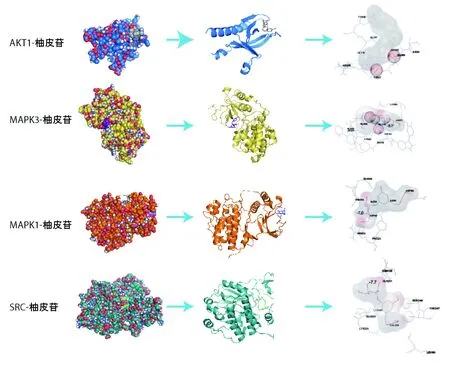
圖6 柚皮苷與靶點蛋白的結合
柚皮苷、川陳皮素與AKT1、MAPK3、MAPK1的結合能均較與蛋白相結合的原有化合物的結合能更低,而與SRC的結合能較標準物高。柚皮苷與SRC的結合能是-7.7 kcal/mol,川陳皮素與SRC的結合能是-7.4 kcal/mol。一般而言,結合能值小于-4.0 kcal/mol時,表明配體有較強的生物活性[20-21]。因此柚皮苷、川陳皮素和AKT1、MAPK3、MAPK1及SRC的結合在自由能預測上效果較好。
2.3.3 柚皮苷、川陳皮素有效性佐證 新會陳皮中黃酮類化合物的藥效作用可以通過文獻佐證(見表5)。文獻中柚皮苷在呼吸道、神經細胞、肺部、心血管、皮膚、睪丸等組織中均有發揮作用,川陳皮素在腸、卵巢、胎膜和子宮、皮膚、心臟、神經和睪丸等組織中發揮作用,與柚皮苷、川陳皮素的活性作用的4個主要靶點的組織分布相一致。
AKT1調控途徑的破壞與癌癥、糖尿病、心血管和神經系統疾病有關[38-40],其在多種細胞信號機制中發揮著關鍵作用,涉及細胞代謝、生長和分裂、細胞凋亡抑制和血管生成。MAPK3和MAPK1屬于有絲分裂原激活蛋白激酶,是調節各種細胞過程的關鍵信號通路,包括增殖、分化、凋亡和應激反應[41]。SRC家族激酶是一個非受體蛋白酪氨酸激酶家族,它們在信號轉導和調節各種細胞生物過程中至關重要,如增殖、分化和凋亡[42]。
新會陳皮中“主要”黃酮類化合物靶向的重要通路是化學致癌—受體激活通路及脂質和動脈硬化通路。非基因毒性化合物致癌過程需要細胞表面或細胞內受體的參與,通過激活信號轉導途徑,導致包括基因轉錄在內的生化反應。該通路信號的轉導與癌癥有關。而脂質和動脈硬化通路的改變與多數心血管疾病及其并發癥的發生有關,包括冠狀動脈疾病、心肌梗塞和中風等疾病。柚皮苷和川陳皮素的核心靶向通路與細胞生長、分裂、脂類代謝相關。此外,脂質代謝失調對中樞神經系統的損傷和紊亂十分重要[43],而且大量與脂質代謝有關的分子突變被認為與運動神經元退行性疾病有關[44]。因此,脂質和動脈硬化通路與柚皮苷、川陳皮素對神經的保護作用直接相關。
3 討論
陳皮在古方劑中被廣泛應用并一直沿用至今。如《本草綱目》載:“其治百病,總是取其理氣燥濕之功,同補藥則補,同瀉藥則瀉,同升藥則升,同降藥則降。”現代處方主要用于呼吸系統、消化系統、心血管疾病和婦科疾病等[45-46]。新會陳皮作為陳皮中的特殊地理品種有其獨特的藥理作用,《新會鄉土志》記載:“柑皮之獨可入藥,為他地所不及”,而清代名醫葉天士所開的“二陳湯”注明只用“新會皮”,因此有必要深入研究其化學成分的藥理作用。
本研究測得新會陳皮中黃酮類化合物共197種,由于中藥量效關系尚未形成完整的理論體系[47],本研究取相對含量前25%,共39種黃酮化合物作為研究對象,以排除可能“不夠量”的活性成分干擾,明晰可發揮藥效的化學成分。同時,本研究通過網絡藥理學共獲得39種黃酮化合物的492個靶蛋白,在核心成分與核心靶點存在互作關系的前提下,通過構建核心成分—靶點—通路網絡圖,從而辨別新會陳皮的質量標志物,這樣的思路與大部分中藥網絡藥理學研究不同。首先,依賴現有成分(化合物)靶點數據庫信息篩選靶點最多的化合物一共三個(圖2),作為成分集合A;其次,將含量前25%的黃酮成分的所有靶點構建成一個PPI網絡,由于PPI網絡的壓力中心度與該蛋白參與的細胞過程的重要性高度相關,因此我們選取壓力中心度最高的十個蛋白作為一個靶點集合B(圖3),該集合中的靶點是新會陳皮行使生物學功能的核心靶蛋白;最后,當集合A的成分和集合B的蛋白有相互作用時,才能構建出核心成分—靶點—通路網絡(圖4),該網絡的可生成預示著這些基因與抗氧化、抗腫瘤、抗炎、祛痰、平喘、促消化、降脂、保肝、心肌保護等多種藥理作用相關,其作用機制可能源于三個度值最高的化學成分(常規網絡藥理學僅依賴圖2中的度值確定質量標志物)。
此外,依據網絡中心度的概念,在核心成分—靶點—通路網絡中進一步確定陳皮素、柚皮苷和AKT1、MAPK3、MAPK1、SRC四個靶蛋白為新會陳皮關鍵成分與靶點,其富集的相應高度值通路為化學致癌—受體激活及脂質和動脈硬化通路。除SRC在30種組織中檢測到外,AKT1、MAPK3、MAPK1可以在人體80余種組織中有較高的表達量(圖5),預示柚皮苷和川陳皮素的功效較為廣泛,這一點和陳皮配伍成方劑可治療多種組織疾病一致[48],也與文獻檢索結果一致(表5)。分子對接從數據模擬上驗證了川陳皮素、柚皮苷與四個核心靶點的結合能力(圖6), 揭示了其對疾病的可能干預機制,這一點同樣與文獻檢索數據一致(表5)。但是,該研究也存在一些網絡藥理學研究存在的共性問題,例如成分與靶點的互作信息來源與數據庫有關。如果能用人工智能模擬成分與蛋白質靶點之間在三維空間上的相互作用[49],進而無約束的預測化合物的相應靶點,不僅可對未收入數據庫的成分和靶點進行分析,且可降低數據庫對成分—靶點網絡圖中的中心度值影響,這對于今后進一步闡明新會陳皮藥理作用機制,篩選其中的質量標志物具有重要意義。
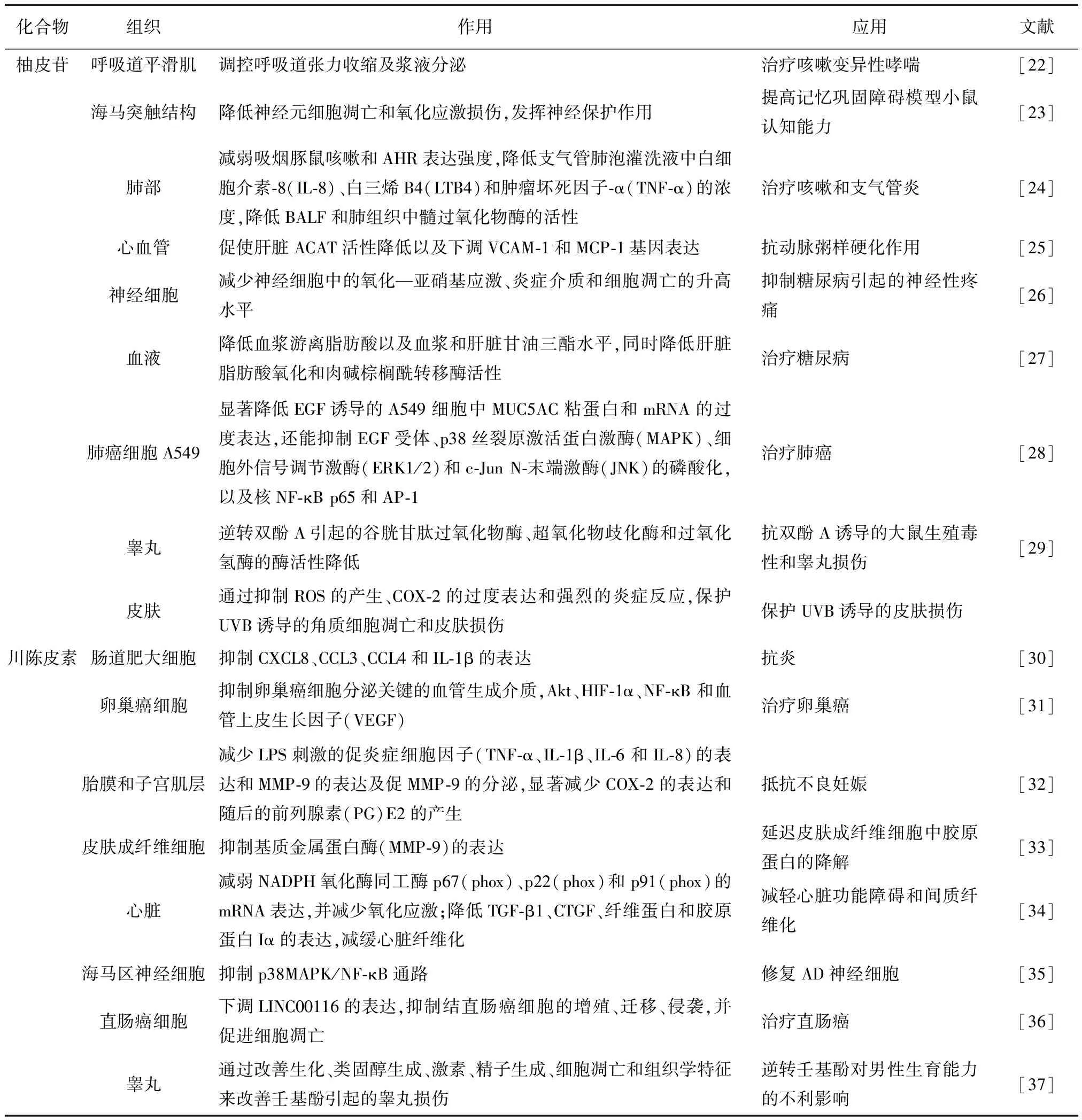
表5 質量標志物文獻信息
總之,本文預測新會陳皮黃酮類化合物質量標志物為川陳皮素和柚皮苷,通過網絡藥理學分析了川陳皮素和柚皮苷的作用機制及作用位置,同時耦合文獻檢索證據檢驗了川陳皮素和柚皮苷的生物效應,可為新會陳皮黃酮類成分質量標志物奠定工作基礎。

