cyclin B1對頭頸部鱗狀細胞癌生物學特性及細胞焦亡的影響
羅水妹,張琦,黃誼強,謝賢和,2
(1.福建醫科大學附屬第一醫院腫瘤內科,福建醫科大學分子腫瘤研究所,福州 350005;2.福建省癌癥精準醫學重點實驗室,福州 350005)
頭頸部鱗狀細胞癌(head and neck squamous cell carcinoma,HNSC) 是頭頸部癌癥中最常見的類型。其中,鼻咽癌居首位,統計顯示2020年全球鼻咽癌發病13.3萬余人,死亡達8萬人[1]。盡管鼻咽癌對放射治療(簡稱放療) 相對敏感,但中晚期鼻咽癌放療后局部復發和遠處轉移一直是治療的難點。因此,尋找新的鼻咽癌治療方法迫在眉睫。
細胞焦亡是一種新的程序性細胞死亡方式,以細胞膜孔形成、細胞腫脹、細胞溶解和炎性細胞因子釋放著稱[2],是宿主抵御感染和危險信號的關鍵,近年來已成為腫瘤領域研究熱點。cyclin B1是細胞周期G2/M期的關鍵檢查點蛋白,參與有絲分裂過程中染色體凝聚、核膜破裂和紡錘體組裝等過程[3],在胃癌[4]、肺癌[5]、食管癌[6]等多種腫瘤中高表達,且與腫瘤惡性表型相關。研究[7]顯示,cyclin B1高表達的HNSC患者放療后局部復發或淋巴結轉移風險高于低表達患者,提示cyclin B1高表達可能與HNSC放療抵抗相關,因此,cyclin B1可能是頗具潛力的腫瘤治療新靶點。本研究組前期研究[8]顯示,敲低cyclin B1可抑制Hela細胞的生長并誘導細胞產生凋亡。此外,靶向敲低鼻咽癌細胞cyclin B1表達可誘導細胞自噬[9]。cyclin B1與細胞焦亡的相關性目前尚未見報道。因此,本研究擬探討下調cyclin B1對HNSC細胞焦亡的影響,旨在發現HNSC治療的新靶點和拓寬治療思路。
1 材料與方法
1.1 數據來源
cyclin B1在HNSC與正常組織的差異表達分析數據來自GEO[10]及UALCAN數據庫[11];cyclin B1的免疫組化數據源于Human Protein Atlas(HPA) 數據庫[12];cyclin B1與HNSC的生存分析數據源于GEPIA數據庫[13];細胞焦亡基因及cyclin B1的表達譜數據來源于OncoLnc數據庫[14]。
1.2 實驗材料及方法
1.2.1 主要試劑和儀器:人鼻咽癌細胞株CNE-2由福建醫科大學附屬第一醫院中心實驗室饋贈。人鼻咽癌細胞株HONE-1購自上海中亞生物公司。cyclin B1及陰性對照(negative control,NC) 的siRNA購自廣州市銳博生物科技有限公司。GP-transfect-mate購自中國GenePharma公司。cyclin B1抗體(ab23053)、GSDMD抗體(ab215203)、GSDME抗體(ab215191)、caspase 1(CASP1) 抗體(ab207802)、caspase 3(CASP3)抗體(ab32351) 購自英國Abcam公司。內參β-actin抗體(AF7018)、GAPDH抗體(AF7021) 購自美國Affinity公司。凝膠成像儀(Biosciences AccuriC6型) 購自美國Bio-Rad公司,相差顯微鏡(IX50/70型) 購自日本Olympus公司。
1.2.2 細胞培養:用含10%胎牛血清、1%雙抗(青霉素1 000 U/mL、鏈霉素0.1 mg/mL) 的RPMI1640培養基,于37 ℃、5%CO2恒溫培養人鼻咽癌CNE-2、HONE-1細胞。
1.2.3 細胞轉染:取對數生長期細胞(1.5×105/孔) 接種于6孔板,加入無抗完全培養基,融合度為40%時進行轉染。以OPTI-MEM分別稀釋siRNA和GP-transfect-mate,室溫靜置5 min,混勻形成轉染復合物,室溫下再靜置20 min后加入至細胞培養基(siRNA終濃度100 nmol/L,GP-transfect-mate按照試劑說明書使用),轉染后4~6 h更換為新培養基。cyclin B1-siRNA序列:正義為5’-CCAUGUUUAUUGCAAGCAATT-3’,反義為5’-UUGCUUGCAAUAAACAUGGTT-3’。NC-siRNA序列:正義為5’-UUCUCCGAACGUGUCA CGUTT-3’,反 義為5’-ACGUGACACGUUCGGAG AATT-3’。
1.2.4 蛋白印跡檢測:轉染48 h后,按常規方法提取細胞總蛋白。上樣量為每泳道20 μg,行聚丙烯酰胺凝膠電泳,轉膜(0.45 μm PVDF膜),室溫封閉1 h,4 ℃孵育一抗過夜,TBST洗膜,室溫孵育二抗1h,TBST洗脫,ECL化學發光顯影。導出照片后用Adobe Photoshop軟件讀取各條帶灰度值。
1.2.5 高通量全轉錄本基因芯片檢測:將已驗證cyclin B1敲低及對照組CNE-2細胞樣本送上海市吉凱基因有限公司,進行Clariom D全轉錄本基因芯片檢測,根據檢測結果篩選差異表達基因。
1.2.6 相差顯微鏡檢測細胞焦亡形態:細胞轉染后48 h置于相差顯微鏡下,于亮場下觀察細胞形態,并拍照記錄。
1.2.7 ELISA檢測:細胞轉染后24 h更換為無血清RPMI1640培養基,再過24 h收集細胞培養上清液,于4 ℃、3 000 r/min離心20 min,取上清按照人白細胞介素(interlukin,IL) -1β ELISA kit(JL13662,江萊生物公司) 操作說明書進行檢測。
1.3 統計學分析
利用GraphPad Prism 8進行統計分析,各組間結果比較用t檢驗,P< 0.05為差異有統計學意義。各基因集交集韋恩圖通過EVenn在線可視化工具(http://www.ehbio.com/test/venn/#/)[15]實現。
2 結果
2.1 cyclin B1表達及其與臨床特征的關系
GSE12452數據集(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE12452)(圖1A)、GSE13601數據集(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE13601)(圖1B) 及UALCAN數據庫(http://ualcan.path.uab.edu) 分析(圖1C) 顯示,HNSC組織cyclin B1的表達水平分別高于正常組織的4.35倍(P< 0.000 1)、5.26倍(P< 0.000 1) 及2.42倍(P< 0.000 1)。HPA數據庫[12](https://www.proteinatlas.org/ENSG000 00134057-Cyclin B1/pathology/head+and+neck+cancer) 分析顯示,cyclin B1在頭頸正常組織中低表達,而在HNSC組織呈中等強度表達(圖1D、1F),提示cyclin B1在HNSC中蛋白及mRNA水平均為過表達。UALCAN數據庫[11]進一步分析顯示,cyclin B1表達水平與HNSC組織分級、腫瘤分期顯著相關,組織分級越高,其表達水平越高(圖2A),在2、3期患者中表達水平最高(圖2B)。
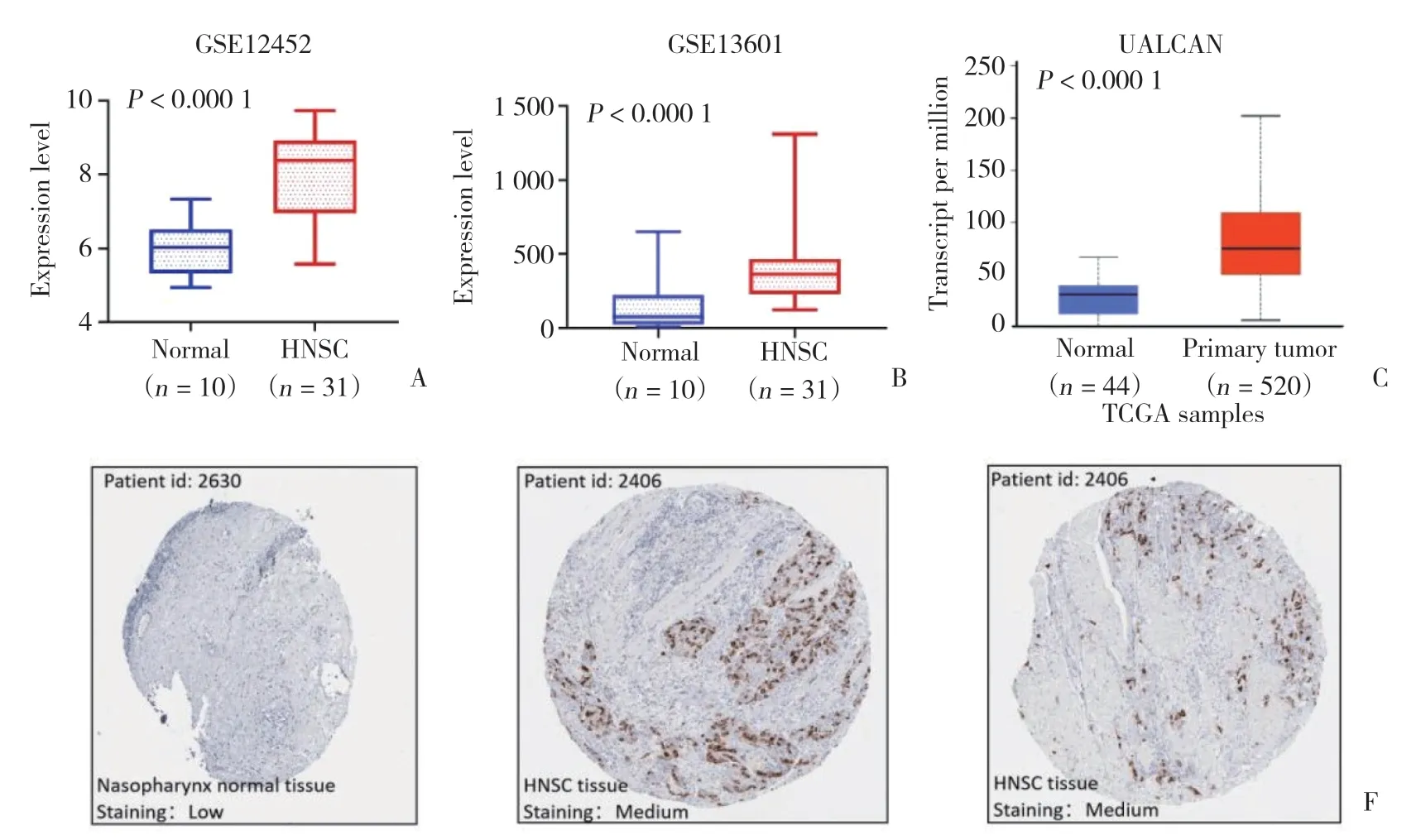
圖1 GEO、ULCAN及HPA數據庫中cyclin B1在HNSC與正常組織中的表達Fig.1 Cyclin B1 expression in HNSC and normal control group in GEO,ULCAN and HPA databases
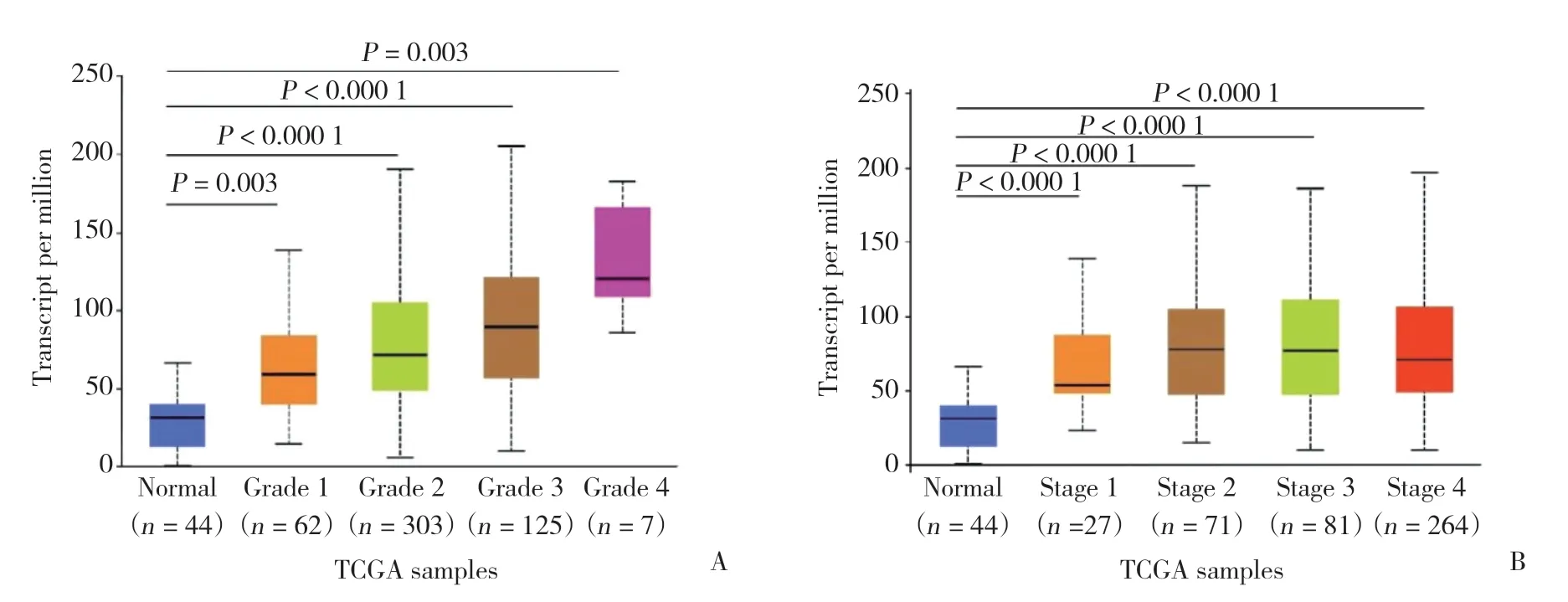
圖2 cyclin B1表達與臨床特征的關系Fig.2 Correlation between cyclin B1 expression and clinical parameters
2.2 cyclin B1表達水平與HNSC的預后顯著相關
GEPIA數據庫[13](http://gepia.cancer-pku.cn/detail.php) 分析提示,HNSC患者中cyclin B1高表達組(以中位數為分界) 的無病生存期(disease free survival,DFS) 短于低表達組(HR=1.4,P=0.043)(圖3)。
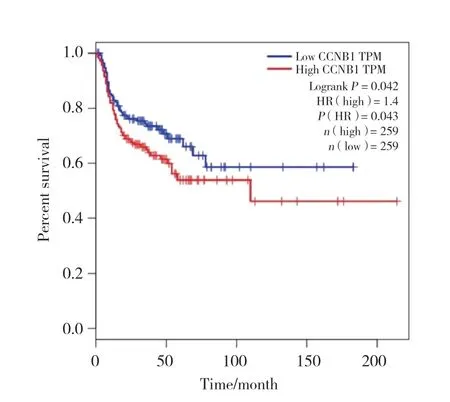
圖3 cyclin B1表達與HNSC患者DFS的相關性Fig.3 Correlation between cyclin B1 expression and disease free survival in HNSC patients
2.3 cyclin B1與細胞焦亡基因的相關性分析
33個細胞焦亡相關基因、GEPIA數據庫[13]及GSE13601數據集篩選差異表達基因取交集結果顯示,GEPIA數據庫、GSE13601數據集分別篩選出6個(GSDMB,GSDMD,NLRP1,PLCG1,AIM2,IL1B) 和4個(CASP1,CASP4,AIM2,IL1B) 具有差異表達的細胞焦亡基因(圖4A、4B)。OncoLnc數據庫[14]獲取496例HNSC患者cyclin B1及33個細胞焦亡基因表達譜數據分析顯示,27.27%(9/33) 的細胞焦亡基因(AIM2,CASP6,GSDMD,NOD2,CASP8,GSDMA,SCAF11,GSDMB,CASP3) 在cyclin B1高表達組與低表達組(以中位數為界) 存在差異表達(圖4C),提示HNSC中cyclinB1的表達可能與細胞焦亡生物學過程相關。
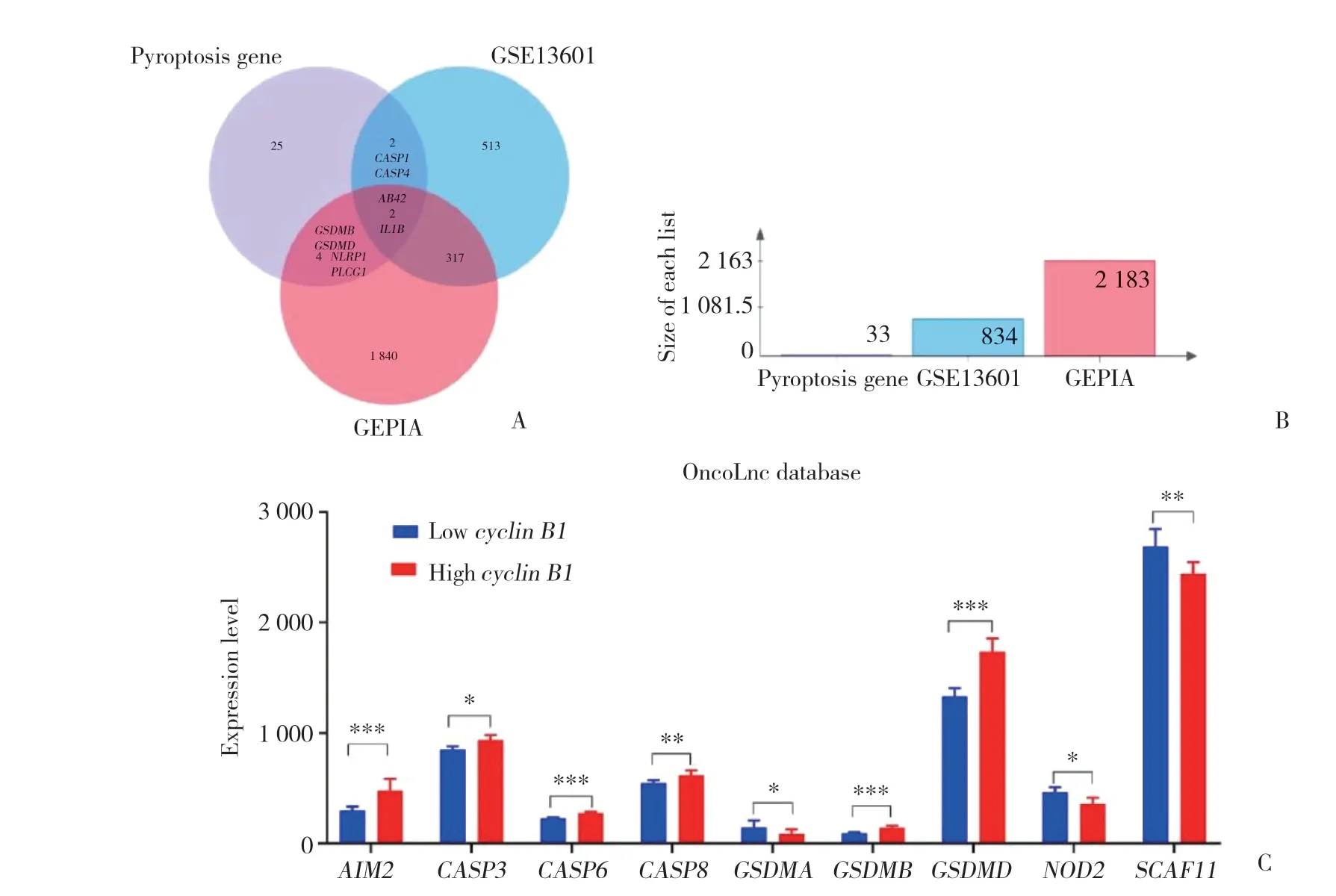
圖4 HNSC與正常組織差異表達的細胞焦亡基因及其與cyclin B1表達的相關性Fig.4 Differential expression of pyroptosis genes between HNSC and normal and its correlation with cyclin B1 expression
2.4 cyclin B1與HNSC細胞焦亡的相關性
2.4.1 HONE-1、CNE-2細胞cyclin B1敲低效率檢測:HONE-1、CNE-2細胞轉染48 h后提取蛋白進行蛋白印跡檢測,結果顯示,cyclin B1敲低組(轉染cyclin B1-siRNA,命名為KD組) 的cyclin B1蛋白表達較對照組(轉染NC-siRNA,命名為NC組) 明顯減弱,敲低效率分別為61.80%、85.99%(圖5A、5B)。
2.4.2 高通量基因芯片檢測cyclin B1敲低后差異表達基因:ClariomD全轉錄本基因芯片檢測結果篩選出cyclin B1KD組(n=3) 與NC組(n=3) 差異表達的基因1 480個,其中包括細胞焦亡關鍵基因CASP1(圖5C、5D)。
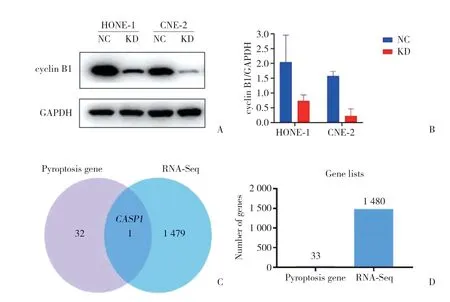
圖5 cyclin B1敲低效率檢測及轉錄組測序篩選差異表達的細胞焦亡基因Fig.5 Detection of cyclin B1 knockdown efficiency and transcriptome sequencing screening of differentially expressed pyrotopia genes
2.4.3 相差顯微鏡檢測細胞焦亡形態:細胞焦亡在光鏡下主要表現為細胞腫脹膨大、細胞膜表面可見氣泡樣突出物。CNE-2、HONE-1細胞分別轉染cyclin B1siRNA 48 h后于相差顯微鏡下觀察,可見KD組具有焦亡形態的細胞顯著多于NC組(圖6)。
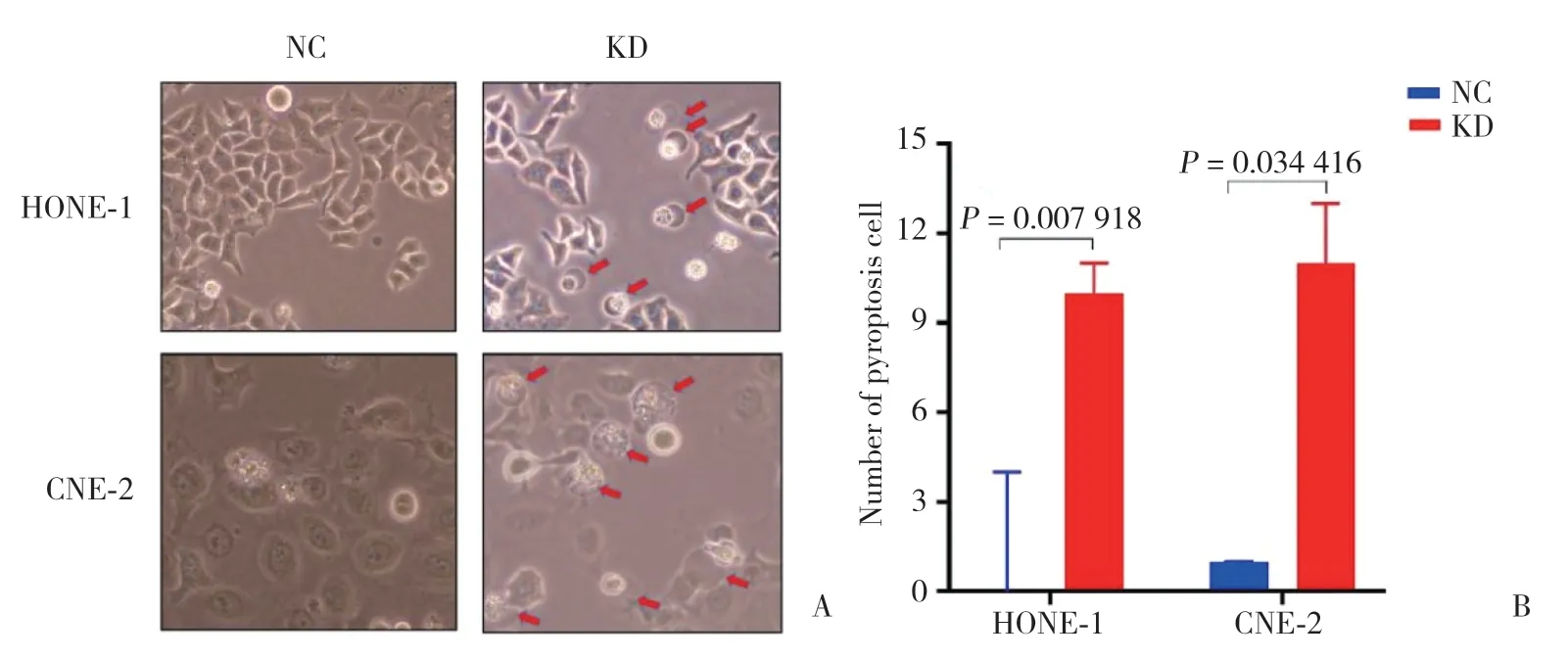
圖6 相差顯微鏡下觀察HONE-1、CNE-2細胞焦亡形態Fig.6 Pyrophosis morphology of HONE-1 and CNE-2 cells observed by phase contrast microscope
2.4.4 蛋白印跡檢測細胞焦亡關鍵蛋白:轉染后48 h,提取蛋白行蛋白印跡實驗檢測細胞焦亡執行蛋白GSDMD、GSDME前體及裂解片段以及焦亡信號通路的關鍵分子CASP1、CASP3的前體及裂解片段,結果顯示,2組均可檢測到CASP1、CASP3裂解片段(圖7A、7B),與對照組相比,cyclin B1敲低組的GSDMD、GSDME裂解片斷有增加的趨勢(圖7C、7D)。
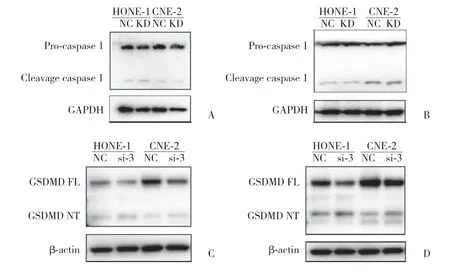
圖7 蛋白印跡檢測轉染后48 h CASP1、CASP3蛋白的前體和裂解片段以及GSDMD、GSDME蛋白全長和裂解片段Fig.7 Western blotting detection of precursors and cleavage fragments of CASP1 and CASP3 and full length and cleavage fragments of GSDMD and GSDME 48 h after transfection
2.4.5 ELISA檢測IL-1β:轉染后48 h收集細胞培養液上清,通過ELISA檢測IL-1β,結果顯示,2組無統計學差異(P> 0.05),但cyclin B1敲低組的IL-1β水平有較對照組增多的趨勢(圖8)。
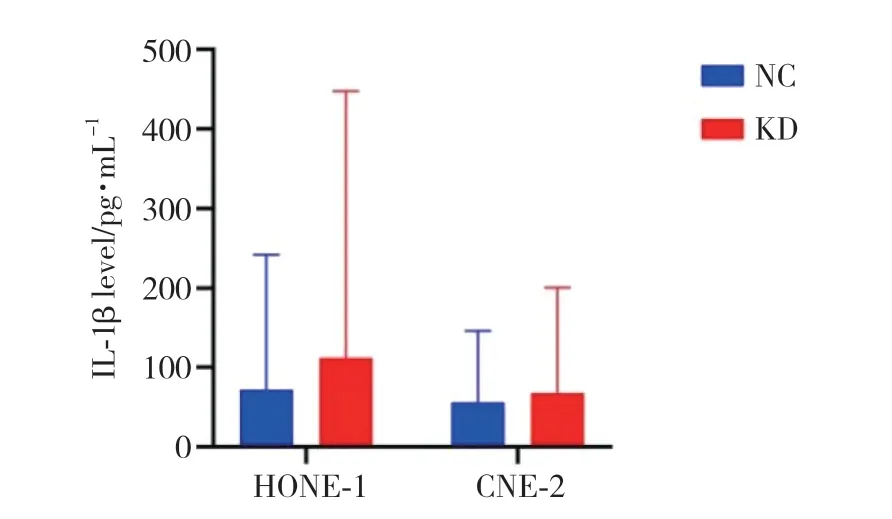
圖8 ELISA檢測轉染后48 h細胞上清中IL-1β水平Fig.8 ELISA dection of IL-1β level in cell supernatant 48 h after transfection
3 討論
cyclin B1在細胞周期G2/M期轉化過程中發揮關鍵作用,在多種癌組織中異常高表達,從而導致腫瘤細胞增殖失控[3-6]。腫瘤是以細胞增殖、分化與細胞死亡平衡失調為特征的疾病,誘導腫瘤細胞死亡是目前各種抗腫瘤治療的目的。本課題組前期研究[8]顯示,沉默cyclin B1可顯著抑制Hela細胞生長并誘導細胞凋亡,而沉默鼻咽癌CNE-2細胞的cyclin B1表達可通過AMPK-ULK1通路觸發自噬[9],提示其可能成為腫瘤治療的潛在靶標。細胞死亡形式主要分為程序性和非程序性細胞死亡兩大類。程序性細胞死亡一直是腫瘤領域的研究熱點,主要包括細胞凋亡、自噬及焦亡。細胞焦亡作為最新被證實的程序性死亡方式之一,與細胞周期關鍵檢查點分子cyclin B1的關系目前尚未見報道。因此,本研究探討了cyclin B1對HNSC細胞焦亡的影響,有助于全面揭示cyclin B1在HNSC中發揮的生物學功能,為探討cyclin B1能否成為腫瘤治療靶點提供理論依據。本研究通過大數據分析發現cyclin B1在HNSC組織中顯著高表達,且與HNSC組織分級和分期顯著相關,提示cyclin B1在HNSC的發生、發展中起著重要作用。
細胞焦亡以Gasdermin家族蛋白N端裂解片段在細胞膜上形成1~2 nm孔隙,使膜失去完整性,進而釋放出大量炎性細胞因子和炎性細胞內容物為特征[2]。本研究結合GEO、TCGA等數據庫分析發現8個細胞焦亡基因在HNSC與正常組織中存在差異表達,提示細胞焦亡可能在HNSC的發生、發展過程中發揮一定作用。此外,本研究還發現9個細胞焦亡相關基因與cyclin B1的表達水平存在相關性,提示cyclin B1表達可能參與HNSC細胞焦亡的生物學過程。據此,進一步以鼻咽癌細胞為研究對象,通過沉默CNE-2細胞的cyclin B1表達后進行轉錄組測序,結果顯示cyclin B1沉默可顯著增加細胞焦亡通路關鍵分子CASP1的表達,也進一步支持了cyclin B1與細胞焦亡存在相關性的結論。
細胞焦亡經典通路中,由NLRP3、NLRC4、AIM2、pyrin和NLRP1組裝成的典型炎癥小體負責CASP1前體的切割[16-17],而CASP1前體被處理后的裂解片段則可進一步處理GSDMD,使其釋放出N端結構域發揮膜穿孔的功能[18],可觸發焦亡及誘導炎性細胞因子(IL-1β、IL-18) 的釋放[19-20]。另有研究[21]顯示,GSDME可被CASP3特異性剪切生成GSDME-N端片段誘導細胞焦亡。本研究通過RNA干擾技術沉默HONE-1、CNE-2細胞cyclin B1后,相差顯微鏡下觀察到cyclin B1敲低組具有焦亡形態的細胞顯著多于對照組,ELISA檢測結果顯示cyclin B1敲低組細胞釋放的IL-1β較對照組升高,蛋白印跡結果顯示2組均可見CASP1、CASP3裂解片段,與對照組相比,cyclin B1敲低組的細胞焦亡執行蛋白GSDMD-N端片段及GSDME-N端片段有增加的趨勢,但2組無統計學差異,因此,cyclin B1參與細胞焦亡生物學過程是否通過經典通路CASP1/GSDMD及CASP3/GSDME途徑實現仍無定論。
綜上所述,本研究結果顯示,cyclin B1在HNSC組織中顯著高表達,cyclin B1高表達與HNSC的不良分級、分期及DFS顯著相關,且cyclin B1表達與細胞焦亡存在相關性,但其具體機制有待進一步探究。

