花生分離蛋白酶解物對雞肉肌原纖維蛋白流變性的影響
許時慧,陳金玉*,關文強*,張穎璐,張坤生,耿亞鑫,胡方洋,鄧金香,宋健臣
(1.天津商業大學生物技術與食品科學學院,天津市食品生物技術重點實驗室,天津 300134;2.天津二商迎賓肉類食品有限公司,天津 300385)
近年來雞肉產能增加,市場供應充足,而且價格低廉[1],其中雞胸肉又以高蛋白、高營養及低膽固醇等特點著稱,深受消費者喜愛。在雞胸肉中起主要作用的蛋白質是肌原纖維蛋白(myofibrillar protein,MP),MP約占肉中蛋白的55%[2],對肉的質地、脂肪、香氣及色澤有很重要的影響[3],肌原纖維蛋白的流變性及凝膠性質是影響肉質的重要原因,是影響加工性能的一個重要指標[4-6],也是決定肉制品品質的關鍵因素。
利用植物蛋白來改善肌原纖維蛋白的功能性質,從而豐富肉制品種類并提高其品質是當前的熱點。如常用的大豆分離蛋白不但能增強產品質構及持水性[7]、節約生產成本還可促進環境友好發展。花生分離蛋白(peanut protein isolate,PPI)也是常用的優質蛋白。我國的花生種植面積廣、產量高[8],是重要的經濟作物。花生含有多種生物活性[9],能用作穩定劑改善食品感官[10],將其添加到碎肉、塊肉和仿肉等肉制品中可以充當營養強化劑、抗氧化劑等,能彌補加工過程營養損失[11]。但是天然的PPI凝膠成形能力較弱,對MP的加工性質、組織結構沒有明顯的促進作用[12],而將PPI酶解,會得到由蛋白質、小分子肽、氨基酸、糖和脂肪等物質組成的酶解產物[13],這一過程會使花生蛋白分子結構展開、內部疏水基團暴露,花生蛋白分子間疏水相互作用增強,能促進其形成凝膠[14-15]。本試驗擬將PPI酶解物與MP相結合,探究PPI酶解物與MP的相互作用,以期為二者的加工利用提供理論依據。
1 材料與方法
1.1 材料與試劑
雞胸肉(冷藏):市售;花生分離蛋白:上海源葉生物科技有限公司;NaH2PO4(分析純)、NaCl(分析純)、乙二胺四乙酸[(ethylene diamine tetraacetic acid,EDTA),分析純]、無水乙醇(分析純):天津市贏達希化學試劑廠;堿性蛋白酶(200 U/g)、木瓜蛋白酶(2 000 U/g)、中性蛋白酶(4 800 U/g):丹麥諾維信有限公司;1,1-二苯基-2-三硝基苯肼[(2,2-diphenyl-1-picrylhydrazyl,DPPH),分析純]、牛血清蛋白(bovine serum albumin,BSA):美國Sigma公司;鹽酸(分析純):天津市風船化學試劑科技有限公司;MgCl2(分析純):天津市天大化工實驗廠;三聚磷酸鈉(分析純):天津市光復精細化工研究所。
1.2 試驗儀器
SMSTA TA.XT plus質構儀:英國Stable MicroSystems公司;Physica MCR301高級旋轉流變儀:奧地利安東帕公司;HW-S24型電熱恒溫水浴鍋:上海一恒科學儀器有限公司;FA2004A電子天平、FD-5N型真空冷凍干燥機:日本EYELA公司;H1650-W臺式高速離心機、H185臺式高速冷凍離心機:長沙湘儀離心機儀器有限公司;IKA T10高速組織勻漿機:德國IKA公司;KQ-250B型超聲波清洗機:昆山市超聲儀器有限公司;EL20型pH計:梅特勒-托利多儀器有限公司。
1.3 試驗方法
1.3.1 花生分離蛋白酶解物的制備方法
取一定量的花生分離蛋白,加入適量去離子水,配制3組蛋白質量濃度5%的花生蛋白液,分別加入底物濃度3%的堿性蛋白酶、中性蛋白酶及木瓜蛋白酶,于各自的最適酶解條件下酶解3 h[13],使用1 mol/L NaOH溶液和1 mol/L HCl溶液維持體系pH值穩定,待反應結束后,用沸水加熱10 min滅酶,冷卻至室溫25℃左右,以4 000 r/min離心20 min,棄沉淀收集上清液即為酶解液,進行真空冷凍干燥,最終得到酶解產物粉末。
1.3.2 酶解液的超濾分離
按1.3.1的方法制得花生蛋白酶解液,通過UF超濾膜(截留分子量為3 kDa)進行超濾,在25℃下以4 500 r/min離心30 min,收集下層濾液(截留分子量<3 kDa),確定酶解物的分子量。
1.3.3 提取MP
MP的提取參考胡方洋等[16]和Chen等[17]的方法,將雞胸肉及提取液(0.002 mol/L MgCl2、0.1 mol/L NaCl、0.001 mol/L EDTA、0.1 mol/L Na2HPO4pH=7)從 4℃冰箱取出,洗凈切成肉糜狀,用4倍體積的MP提取液[0.002 mol/L MgCl2、0.1 mol/L NaCl、0.001 mol/L EDTA、0.1 mol/L Na2HPO4(pH=7)]高速勻漿(8 000 r/min),充分混勻,在4℃、4 500 r/min條件下離心20 min,取沉淀,重復離心3次,再向所得沉淀中加入4倍體積的0.1 mol/L NaCl溶液,與上述相同的離心條件下重復離心3次,棄上清液,最后沉淀即為MP(4℃冷藏,需7 d內用完)。
1.3.4 PPI酶解物與MP共混體系的制備
將1.3.1得到的酶解產物凍干粉以不同的添加量與MP進行復配,添加量分別為0%、2%、4%、6%、8%、10%,用0.1 mol/L NaCl制備成20 mg/mL的蛋白溶液,利用勻漿機中速攪拌30 s,控制溫度不超過室溫25℃,測定其流變學特性。
1.3.5 共混凝膠的制備
分別將1.3.1制得的堿性蛋白酶、中性蛋白酶及木瓜蛋白酶酶解物的凍干粉以 0%、2%、4%、6%、8%、10%的比例與MP混合,用0.1 mol/L NaCl制備成40 mg/mL[18]的蛋白溶液,放入水浴鍋從20℃開始升溫,升溫至75℃,保持10 min,加熱結束后用碎冰快速冷卻,放入4℃冰箱12 h后取出備用。
1.3.6 流變學的測定
1.3.6.1 剪切稀化的測定
分別取不同比例的適量樣品(按1.3.4制備的PPI堿性蛋白酶酶解物、中性蛋白酶酶解物及木瓜蛋白酶酶解物與MP共混體系)置于流變儀的測定平臺上,選用PP 50(直徑為25 mm)的錐板模具,恒定溫度24℃,測定樣品的表觀黏度(η)在剪切速率(γ)從0.01 s-1~300 s-1遞增過程中的變化。
1.3.6.2 動態溫度剪切掃描
參考Chen等[19]的方法將制備好不同組分與比例的樣品取3 mL置于流變儀測定平臺上,選用P/0.5的探頭,板間距1 mm,振幅1 Pa,頻率固定為1 Hz,溫度從20℃升至90℃,再從90℃降至20℃,記錄溫度變化過程中儲能模量G′、損耗模量G″的變化,繪制曲線。
1.3.7 質構性質的測定
將1.3.5制備的共混凝膠置于質構儀測試臺面進行測定,測定參數:探頭P/0.5、測前速度1.0 mm/s、測試速度1.0 mm/s、測后速度1.0 mm/s、觸發力為5 g、壓縮比40%,測試中的最大力即為破斷強度,對應的壓縮距離為凹陷深度,凝膠強度等于二者的乘積[20],測定一次重新換一個測量位置,每個樣測3次,每組3個平行。
1.4 數據處理
采用Excel 2007、Origin 8.5對試驗數據進行處理分析及繪圖。每個試驗平行3次。
2 結果與討論
2.1 酶解物成分分析
酶解物成分分析結果見表1。
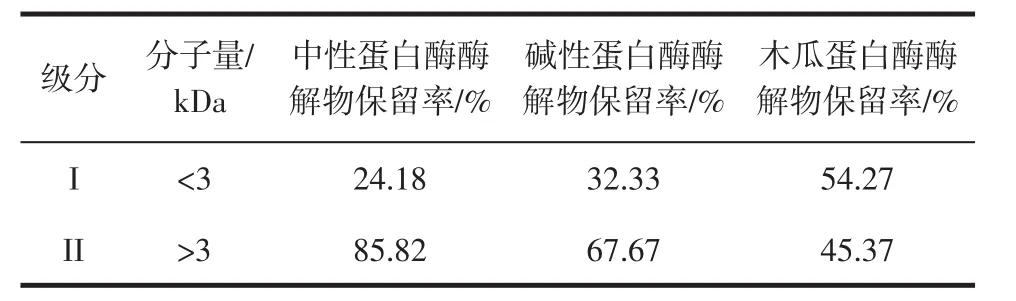
表1 PPI酶解物成分組成Table 1 Composition of PPI hydrolysate
采用超濾離心管對制備的PPI酶解物進行膜超濾分離,得到了2種分子量組成的抗氧化肽。由表1可知,中性蛋白酶酶解物的級分I占24.18%,級分II占85.82%;堿性蛋白酶酶解物的級分I占32.33%,級分II占67.67%,級分II比級分I占比多;木瓜蛋白酶酶解物的級分I占54.27%,級分II占45.37%。
2.2 不同酶解物對MP功能的影響
2.2.1 對流變學性質的影響
2.2.1.1 剪切稀化現象
混合體系的表觀黏度剪切速率的變化見圖1。

圖1 不同的花生蛋白酶解物與肌原纖維蛋白共混體系的剪切稀化現象Fig.1 Shear thinning of different peanut protein hydrolysates and myofibrillar protein blends
由圖1可知,隨著剪切速率在0~300 s-1逐漸增加,表觀黏度先快速降低而后趨于平緩,添加PPI及其不同酶解物與MP組成的溶液均隨剪切速率的增大而降低,存在剪切稀化現象,屬于非牛頓流體[21]。而添加PPI酶解物后,共混溶液的表觀黏度均增大。原因可能是因為共混體系間的分子間作用力增強,緊密連接,阻礙了其流動速度,對混合液施加剪切力后,破壞了MP分子與改性酶解物小分子之間的纏繞,分子間氫鍵斷裂,作用力越大破壞效果越明顯,從而表現出表觀黏度減小;當未施加剪切力時,中性蛋白酶解PPI/MP共混體系的表觀黏度增大梯度較明顯,當剪切力增大到一定值后,共混體系間的分子無法重新取向,此時表觀黏度維持在一個穩定范圍[22],趨近于一個常數。
還可看出,在沒有剪切速率的影響下,添加了PPI或其酶解物的表觀黏度均明顯高于未添加,而且隨著酶解PPI的添加量的增加,呈現先增大后減小的特點,其中在添加量為4%時最大,而直接加入PPI會降低體系的黏度,說明PPI酶解物在一定添加量下能增加混合體系的黏度,這可能與PPI酶解后性質改變有關。如抗氧化作用的增加可能會使MP的分子形態更加緊致,而酶解后蛋白分解成氨基酸與MP分子作用范圍更加全面,使共混體系不易流動變形;表觀黏度會隨著添加量的增加而減弱之后平緩,這可能是因為蛋白之間的結合作用已經被完全破壞,不會再出現新的變化。
2.2.1.2 溫度掃描分析
混合體系的儲能模量隨溫度的變化見圖2。
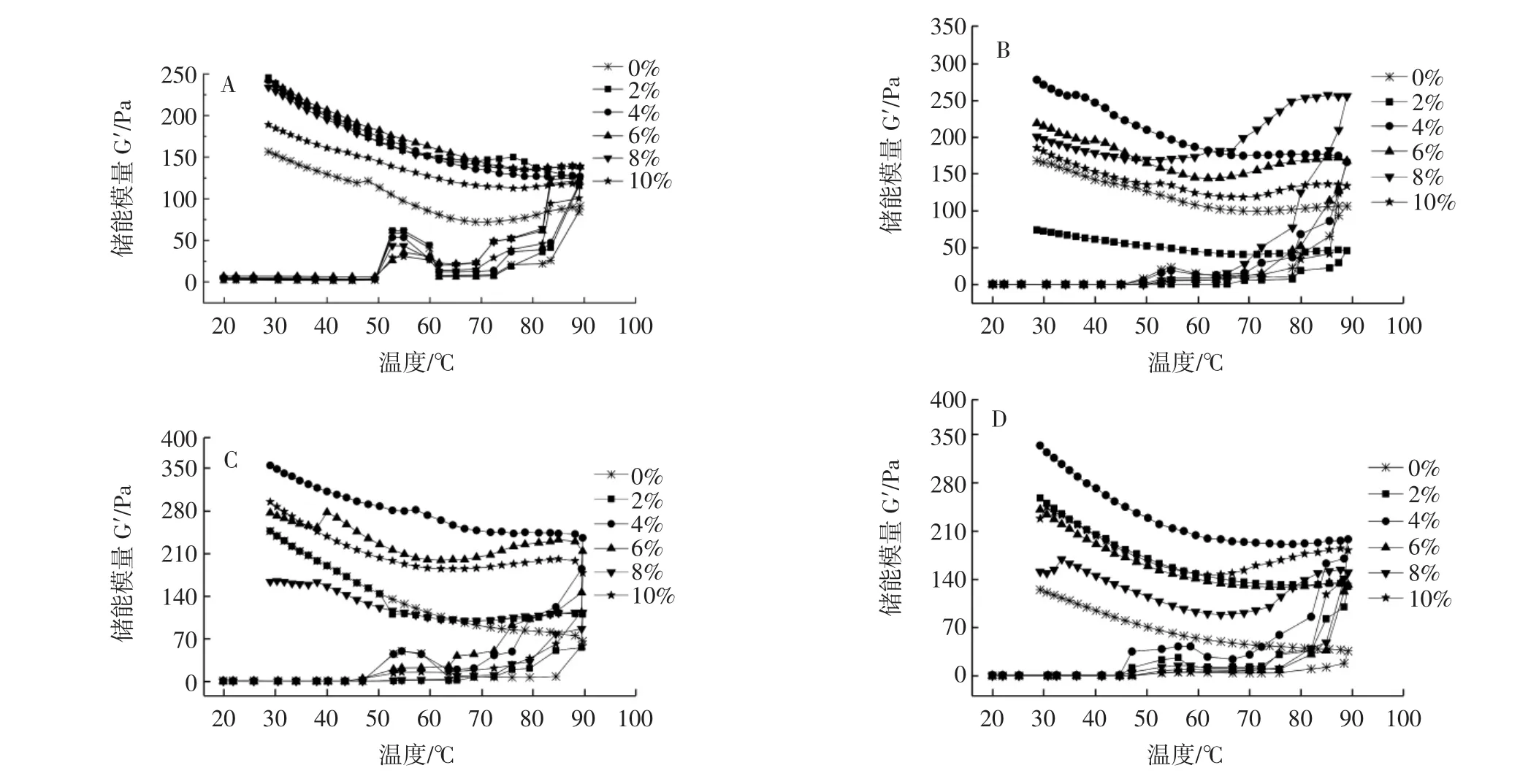
圖2 不同的花生蛋白酶解物與肌原纖維蛋白共混體系的儲能模量Fig.2 Storage modulus of the blend system of different peanut proteolysis products and myofibril protein
G′的變化用于檢測食品的凝膠化[23]。G′表示凝膠結構中由彈性變形量變化而引起的能量變化[24]。由圖2可知,測定溫度變化范圍是20℃~90℃~20℃,G′在45℃~55℃時開始緩慢增加,凝膠網絡開始初步形成,部分肌球蛋白的頭部開始變性并交聯形成松散的網狀結構[25];當溫度高于55℃后,G′開始下降,肌球蛋白尾部開始變性,尾部超螺旋結構解旋會破壞前期形成的網狀結構[26];當溫度在63℃~90℃之間,G′開始重新上升,由于共價二硫鍵和疏水相互作用而形成永久性不可逆交聯的肌球蛋白絲[27],當溫度下降時,凝膠網絡結構增強,G′急劇上升,可能是酶解物與MP會通過非共價相互作用單獨重新分配和形成凝膠。
其中在50℃~60℃之間,添加PPI酶解物的MP溶液的G′先增大后減小,可能是肌球蛋白尾部的變性被抑制,之前的網狀凝膠結構不會輕易被破壞;在降溫階段,PPI酶解物/MP共混體系相較PPI/MP共混體系的G′均有明顯增大,表明PPI酶解產物對MP的結構有促進作用,提高G′的作用優于PPI,在添加量為4%時增強效果最大。
混合體系的損耗模量隨溫度的變化見圖3。

圖3 不同的花生蛋白酶解物與肌原纖維蛋白共混體系的損耗模量Fig.3 Loss modulus of the blend system of different peanut proteolysis products and myofibril protein
G″表示加熱過程中黏性的變化,表示物質受到外力作用時的變形程度[28],可以反映MP結構的折疊和聚集[24]。圖2和圖3中G′和G″的變化趨勢相似,添加花生分離蛋白和酶解后的PPI均改變了MP原本的結構特點,酶解后的PPI改變作用更加明顯,原因可能是PPI酶解后產生的活性多肽改變了MP的氧化能力,影響其G″的變化。在升溫階段50℃~60℃出現一次最大值,然后快速下降,繼續加熱,G″緩慢上升。在降溫階段,隨著溫度的降低G″急劇增加,在相同的溫度下,PPI及其酶解物在添加量為4%時增幅最大,與G′的變化重合。在堿性蛋白酶解PPI與MP共混體系中,酶解物添加量為10%的情況下,對MP的G″的作用最小;在木瓜蛋白酶解PPI與MP共混體系與中性蛋白酶解PPI與MP共混體中,酶解物添加量從2%~4%G″逐漸增加,超過4%之后,隨著添加量的增加而逐漸降低,但3種酶解物均增加了MP分子的G″。
2.2.2 PPI酶解物對凝膠強度的影響
混合體系的凝膠強度隨PPI及其酶解物添加量的變化見圖4。
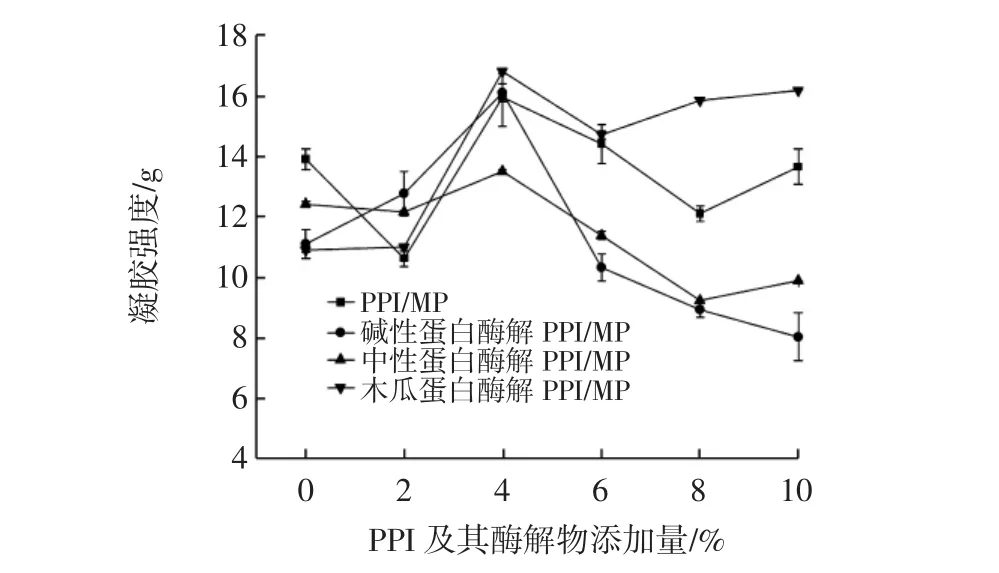
圖4 不同的花生蛋白酶解物與肌原纖維蛋白共混體系的蛋白凝膠強度Fig.4 Protein gel strength of blends of different peanut protein hydrolysates and myofibrillar proteins
蛋白的凝膠是因外界條件變化導致蛋白產生不同程度的變性開始伸展,然后蛋白質與蛋白質、蛋白質與溶劑之間相互作用,最后蛋白質之間相互聚集,形成致密的三維網狀結構分離蛋白及其酶解物與MP共混凝膠隨PPI及其酶解物添加量變化的變化趨勢。添加2%的PPI酶解物對MP凝膠強度的影響不大,而同樣的添加量下未酶解的PPI會降低MP的凝膠強度;當添加量升至4%時,共混蛋白凝膠強度明顯增加,其中PPI/MP凝膠強度增加3.80%~14.84%;堿性酶解PPI/MP凝膠強度增加15.03%~45.09%;中性酶解PPI/MP凝膠強度增加了9.70%,木瓜蛋白酶解PPI/MP凝膠強度增加了54.13%,而后又隨添加量的增加而減小,這可能是酶解導致PPI變性,球狀結構展開,埋藏在蛋白質內部的活性基團暴露[12],增強PPI與MP之間的分子相互作用,表明PPI酶解物在4%的添加量下,形成的混合蛋白結構較為緊致,形成的凝膠也比較牢固,從而增強MP的凝膠[29]。圖4反映了花生強度,其中木瓜蛋白酶酶解物與堿性蛋白酶酶解物增加MP的凝膠強度的作用較為明顯。當添加量超過4%后,可能因為兩種蛋白質的自身相互作用增強,MP分子形成凝膠網絡結構時的阻力增大[30-32],導致蛋白凝膠強度下降,當PPI及其酶解物超過一定量與MP作用會阻礙或破壞MP原有的蛋白結構,不利于其形成致密的凝膠結構。
2.2.3 不同酶解物對凝膠質構的影響
混合體系的彈性、黏結性和回復性隨PPI酶解物添加量的變化見圖5。

圖5 不同的花生蛋白酶解物與肌原纖維蛋白共混體系的蛋白凝膠質構Fig.5 Protein gel structure of blends of different peanut protein hydrolysates and myofibrillar proteins
凝膠質構是蛋白質在食品加工過程的一個重要的屬性,對食品品質有重要影響,其中彈性、黏結性及回復性等性質的改變反映了蛋白的變性情況。由圖5可知,隨著各蛋白酶所得酶解物添加量逐漸增加,蛋白的彈性、黏結性及回復性均呈現不同的變化。在堿性蛋白酶解PPI/MP共混體系中,彈性最大增加了4.55%,黏結性增加,回復性變化不大;在中性蛋白酶解PPI/MP共混體系中,在PPI酶解物添加量為4%時,彈性最大增加了27.45%;在木瓜蛋白酶解PPI/MP共混體系中,混合蛋白的凝膠彈性增加了21.86%,添加量在4%時最大,回復性和黏結性均有所增加,由此可推測,在肉類制品中添加經酶處理改性的PPI能增強食品的彈性,改善食品品質。
3 結論
MP與PPI及其酶解物復配后,在4%的添加量下,PPI酶解物對 MP 的 G′、G″、表觀黏度、凝膠強度、彈性、回復性及黏結性等均有促進作用,其中,PPI中性蛋白酶酶解物對MP的流變學性質的改善作用優于堿性蛋白酶酶解物、木瓜蛋白酶酶解物及PPI,主要體現在對G′及凝膠彈性的影響上;3種PPI酶解物均能增強MP的凝膠強度(增幅在9.7%~54.13%)及質構特性,與流變學變化相一致。說明PPI經過酶解后能有效改善MP的蛋白特性,為后續的研究奠定了基礎,對實際生產加工具有重要的實際意義。

