水曲柳CUC1 基因克隆及瞬時表達分析
崔靖弘,于 磊,梁楠松,宋婷婷,呂義品,紀欣童,徐 亮,趙福江,詹亞光*
(1.東北林業大學東北鹽堿植被恢復與重建教育部重點實驗室,黑龍江 哈爾濱 150040;2.黑龍江省頭雁創新團隊計劃(林木遺傳育種創新研究團隊),黑龍江 哈爾濱 150040;3.吉林省臨江林業局,吉林 臨江 134600)
CUCs(CUP-SHAPED COTYLEDONs)基 因在調控植物營養生長到生殖生長中發揮著核心作用,如參與植物頂端分生組織建成[1];與生長素、miRNA 等相互調控影響葉邊緣形態[2];通過調控下游LAS(LATERALSUPRESSOR)基因促進腋生分生組織起始,進而影響側枝發育[3];在擬南芥根外植體培養中,CUC1和CUC2基因表達量可與根形成不定芽的能力成正相關,可見,CUC基因可作為一個預測性標志基因,篩選根形成芽的最佳組培條件[4]。CUC1屬于植物特有的NAC 家族NAM 超家族成員[5],具有NAC 家族典型的N 端高度保守NAC-domain 和C 端高度多變序列,NACdomain 是一個包含約150 至160 個氨基酸[6],分為5 個亞結構域(A-E),其中,A、C、D 保守性高,B、E 保守性低,且D、E 是DNA 結合所必需的亞結構域[7]。CUC1基因在愈傷組織再生出芽中發揮著重要作用,Daimon 等[8]在愈傷組織中過表達CUC1基因,可促使芽的再生率從30%提高到80%。進一步研究表明,通過對CUC亞家族和ATAF1亞家族NAC-domain 互換實驗中發現,ATAF1的NAC-domain 不能誘導愈傷組織再生出芽,這是由于其自身特異的NAC-domain 所決定的[9]。Aida等[10]研究中發現,CUC1和CUC2基因雙突變體植株可呈現雄蕊、萼片和子葉愈合,很難產生SAM(頂端分生組織)。進一步研究發現,CUC1和CUC2可通過調控STM(SHOOT MERISTEMLESS對于分生組織起始和維持SAM 中心區的未分化細胞是必需的)的表達來決定分生組織中心的建立[11]。如STM首先在CUC基因表達原基的細胞環中表達,當SAM 形成時,STM將CUC基因的表達限制在SAM 的外周區,進而形成反饋調節環[12]。此外,CUC1基因的表達受到其他轉錄因子和表觀遺傳修飾調控,如PLT3(PLETHORA3)、PLT5、PLT7可以促進CUC1的表達[13],ESR1(ENHANCER OF SHOOT REGENERATION1)也可以促進CUC1的表達[14];在離體器官再生過程中,CUC1基因表達與其啟動子區和3′端的DNA 甲基化修飾水平呈明顯負相關性[15],且CUC1的表達也受到了H3K4 乙酰化水平調控[16]。目前,CUC1基因的研究大多集中于擬南芥等模式植物,而在木本植物中鮮有研究。
水曲柳(Fraxinus mandshuricaRupr.)系木犀科(Oleaceae)白蠟樹屬,是東北地區重要的珍貴用材樹種,由于地域特征水曲柳能夠耐寒、耐旱、耐鹽堿,且木材優良,用途廣泛,具有較高的經濟價值[17-19]。其作為黑龍江省主要的造林樹種,再生困難造成遺傳轉化效率低的現象一直困擾著育種工作者,而瞬時轉化是一種快速有效的遺傳轉化方法,對研究植物基因功能具有重要意義,如鄒全程等[20]利用農桿菌介導剛毛柳(Tamarix hispida)ThCBL4基因瞬時過表達可提高轉基因植株耐鹽性;Wu 等[21]證實,在桑葉中瞬時過表達MaFT基因可能促使桑樹(Morus albaL.)早熟開花等。因此,為了提高水曲柳遺傳轉化效率,解決再生難等問題,可見從分子水平研究再生相關的基因是必要的。本研究從水曲柳中克隆獲得了FmCUC1基因,對其分子特征、組織特異性、亞細胞定位進行分析,測定其在不同激素信號下的基因表達情況,同時構建了FmCUC1基因表達載體(pNC-Cam1304-SubC-FmCUC1),利用農桿菌介導水曲柳FmCUC1基因瞬時過表達72 h 后,分析比較其通路相關基因表達情況以初步鑒定FmCUC1基因功能。該研究將有助于為水曲柳轉基因工作提供新思路。
1 材料與方法
1.1 試驗材料
試驗所用材料均為水曲柳種子種植。將水曲柳種子接種于WPM 固體培養基中(pH5.8~6.0),培養于人工氣候室(濕度為60%~80%,溫度為22 ±2℃,光照15 h)。以生長30 d,長勢均一的實生幼苗為實驗材料。根、莖、葉取自30 d 組培苗,頂芽取自3 年生盆栽苗。
1.2 試驗方法
1.2.1 基因克隆 根據水曲柳CUC1基因的編碼區(CDS)設計引物(表1),以生長30 d 的水曲柳組培苗cDNA 為模板進行FmCUC1基因的PCR 擴增(反應體系:上下游引物各1.0 μL,cDNA 模板1.0 μL,2 × Es MasterMix 10 μL,ddH2O 7.0 μL。PCR 擴增程序為:94℃預變性3 min;94℃變性35 s,56℃退火30 s,72℃延伸30 s,30 個循環;72℃延伸2 min,4℃保存)。將目的片段回收純化,連接至pEASY-T5-Zero 載體上,轉化至大腸桿菌DH5α 感受態細胞中,將陽性克隆送至擎科生物科技有限公司測序。
1.2.2FmCUC1基因生物信息學分析 根據FmCUC1基因序列分析其理化性質、親疏水性、保守結構域及構建系統進化樹,具體操作步驟參考郭依萍等[22]。
1.2.3FmCUC1基因表達載體構建及亞細胞定位
根據FmCUC1基因CDS 序列設計引物(表1),以陽性克隆質粒為模板進行PCR 擴增,將擴增產物回收純化后使用Nimble Cloning MIX 試劑將其連接至pNC-Green-SubC 表達載體中,構建植物表達載體pNC-Green-SubC-FmCUC1,將陽性菌液送至擎科生物科技有限公司測序。將檢測正確的pNC-Green-SubC-FmCUC1質粒轉化農桿菌GV3101感受態細胞。利用農桿菌介導法分別將pNC-Green-SubC-FmCUC1和空載pNC-Green-SubC 轉入到洋蔥內表皮細胞中,使用熒光共聚焦顯微鏡觀察并照相。

表1 引物序列及用途Table 1 Primer sequence and Application
1.2.4FmCUC1基因組特異性表達 分別以水曲柳根、莖、葉、頂芽組織為cDNA 模板,以水曲柳微管蛋白FmTU[23]為內參基因對FmCUC1基因表達進行熒光定量PCR。
1.2.5FmCUC1基因在下胚軸芽再生與種子萌發過程中的差異表達 以水曲柳下胚軸和種子為實驗材料,分別在培養6、12、18、24、30、36 d 與接種0、3、4、5、7、8、10、14、18、21 d 進行取樣,待取樣完畢后,使用Tris-CTAB 法提取RNA,反轉錄,對水曲柳下胚軸芽再生與種子萌發過程中FmCUC1基因表達進行熒光定量PCR。
1.2.6FmCUC1基因在激素信號下的差異表達 分別對長勢均一的組培苗噴施6-BA(100 μmol·L-1)、BR(1 μmol·L-1)、IAA(100 μmol·L-1)激素處理,每個處理設3 個重復,每重復5 株水曲柳苗,于0 h、10 min、1 h、3 h、6 h、12 h、24 h、48 h進行整株取樣。對8 個取樣點FmCUC1表達進行熒光定量PCR。
1.2.7FmCUC1基因表達載體構建、瞬時侵染水曲柳及相關基因表達 以陽性克隆質粒為模板進行PCR 擴增,將擴增產物回收純化后使用Nimble Cloning MIX 試劑[24]將其連接至pNC-Cam1304-SubC 表達載體中,構建植物表達載體pNCCam1304-SubC-FmCUC1,將陽性菌液送至擎科生物科技有限公司測序。將檢測正確的pNC-Cam1304-SubC-FmCUC1質粒轉化農桿菌GV3101 感受態細胞,保存菌種備用。
利用農桿菌介導的瞬時轉化法,方法參照楊少彤等[25];將pNC-Cam1304-SubC-FmCUC1-GV3101和轉化液(對照)分別對生長30 d 的整株水曲柳組培苗進行瞬時侵染。為了檢驗FmCUC1基因及其通路 的ESR1(ENHANCER OF SHOOT REGENERATION1)、PLT3(PLETHORA3 )、PLT5(PLETHORA5)、B型ARR12(ARABIDOPSIS RESPONSE REGULATOR12)、STM(SHOOT MERISTEMLESS)基因表達情況,提取72 h 的FmCUC1瞬時過表達植株的總RNA,進行熒光定量PCR。
1.2.8 數據處理與分析 每個實驗至少3 次生物學重復;基因相對表達量使用7 500 Software v 2.0.6 軟件獲取,按照基因相對定量法(2-ΔΔCt)對基因相對表達量進行計算;利用SPSS version 22.0軟件采用Duncan’s 多重比較法進行顯著性分析。
2 結果與分析
2.1 FmCUC1 基因克隆及基因結構分析
由圖1A 可知:PCR 擴增獲得1 條約800 bp的目的基因條帶,經測序,證實得到目的基因即為FmCUC1基因(登錄號:MH060997.1),其CDS 序列為807 bp,編碼269 個氨基酸(圖1B)。

圖1 FmCUC1 基因克隆Fig.1 Cloning of FmCUC1 gene
使用ProtParam 預測FmCUC1 蛋白脂肪系數為32.71,不穩定系數值為35.02,屬于穩定蛋白。進一步使用TMHMM 對FmCUC1 蛋白的親/疏水性分析可知:該蛋白的最大親水性為-0.663、最大疏水性為2.189,有 43 個氨基酸親水數峰在0 以下,有438 個氨基酸疏水數峰在0 以上,親水性氨基酸數目明顯少于疏水性氨基酸,為疏水蛋白。通過CD-Search 對FmCUC1 蛋白保守結構域和功能域預測可知:FmCUC1 蛋白近N 端的第49-423 位氨基酸為典型的NAC-domain 結構域。
2.2 FmCUC1 編碼蛋白的同源性分析
使用NCBI 中的Blastp 對FmCUC1氨基酸進行同源序列比對表明:水曲柳CUC1(NAC92)氨基酸序列與同科的木犀欖CUC1(NAC92)氨基酸序列相似度較高,為86.17%;同時對水曲柳、木犀欖、擬南芥、水稻等16 個物種的CUC1 蛋白氨基酸序列構建系統發育樹(圖2),結果顯示進化樹聚為2 類,其中,水曲柳與木犀欖位于同一進化分支上,說明目前水曲柳CUC1與木犀欖CUC1 親緣關系較近。

圖2 FmCUC1 與其他物種的CUC1 蛋白進化分析Fig.2 Evolutionary analysis of FmCUC1 and CUC1 proteins in other species
2.3 FmCUC1 基因表達載體構建、亞細胞定位
以SFmCUC1-F 和SFmCUC1-R 為引物,測序正確的FmCUC1基因陽性克隆質粒為模板,成功構建植物表達載體pNC-Green-SubC-FmCUC1(圖3)。

圖3 pNC-Green-SubC-FmCUC1 表達載體結構圖Fig.3 Structure of pNC-Green-SubC-FmCUC1 expression vector
利用農桿菌介導法分別將pNC-Green-SubCFmCUC1-GV3101 和空載pNC-Green-SubC-GV3101轉入到洋蔥內表皮細胞中,使用熒光共聚焦顯微鏡觀察侵染后得到的洋蔥內表達細胞。實驗結果(圖4)表明:對照組在細胞核與細胞膜中均發現綠色熒光,FmCUC1-EGFP 融合蛋白只在細胞核中有明顯的綠色熒光,且與DAPI 核染色位置一致,表明FmCUC1基因定位于細胞核中。

圖4 FmCUC1 蛋白亞細胞定位Fig.4 Subcellular localization of FmCUC1 protein
2.4 FmCUC1 基因組織特異性表達分析
采用熒光定量PCR 技術對水曲柳FmCUC1基因在根、莖、葉、頂芽中的表達進行檢測。結果表明:該基因在根、莖、葉、頂芽中均有表達,以根表達量作為參考,莖表達量低于根組織,為根表達量的75%,葉片的表達量高于根,為根表達量的3.27 倍,頂芽的表達量最高,為根表達量的6.43 倍(圖5)。以上結果表明,FmCUC1基因在水曲柳頂芽中表達量最高。
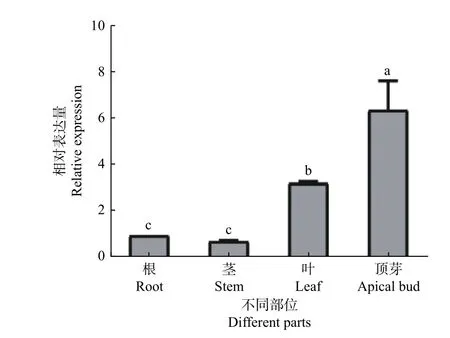
圖5 FmCUC1 基因在根、莖、葉、頂芽中的表達差異Fig.5 Expression difference of FmCUC1 gene in roots,stems,leaf and apical bud
2.5 FmCUC1 基因在下胚軸芽再生與種子萌發過程中的差異表達分析
在水曲柳下胚軸芽再生過程中發現:FmCUC1基因在6~36 d 均有表達,以第6 天表達量作為參考,培養6 d 時可發現下胚軸端部開始膨大(圖6C),生長12 d 時可以發現有芽點產生(圖6D),此時FmCUC1基因表達量為對照的1.98 倍(圖6A);進一步觀察可發現12~36 d 為叢枝形成期,待生長至36 d 時FmCUC1基因表達量達到峰值,為對照的11.33 倍(圖6A)。以上結果表明:FmCUC1基因參與水曲柳下胚軸芽再生過程,并促進不定芽的分化。同樣,在種子萌發過程中,通過定量分析得出:FmCUC1基因在第4 天和第8 天分別達到2 個峰值,分別為0 d 的8.56 倍和8.46 倍(圖6B)。結果表明,這2 個峰值與水曲柳種子芽的發生階段及伸長階段相互對應。上述結果均可推測,FmCUC1基因在水曲柳芽再生過程具有重要作用。

圖6 FmCUC1 基因在下胚軸芽再生與種子萌發過程中的表達分析Fig.6 Expression analysis of FmCUC1 gene during hypocotyl bud regeneration and seed germination
2.6 FmCUC1 基因在激素信號下的表達模式
水曲柳在激素信號處理下,隨著處理時間的延長,發生了明顯的表達變化(圖7),其中,在IAA 與BR 處理后,FmCUC1呈現升-降-升的表達模式;在處理1 h 與10 min 時顯著上調,分別為對照的27.65 倍和11.38 倍,隨后表達量逐漸下降;處理72 h 后表達量均達到峰值,分別為對照的45.72 倍和20.36 倍。在6-BA 處理后,FmCUC1的表達量亦呈現升-降-升的趨勢,其中,在處理48 h 后達到最高值,為對照的59.40 倍。以上結果說明FmCUC1基因響應了IAA、6-BA、BR 的信號刺激。

圖7 FmCUC1 基因在不同激素處理下的表達情況Fig.7 Expression of FmCUC1 gene under different hormone treatments
2.7 FmCUC1 基因表達載體構建、瞬時侵染水曲柳及相關基因表達情況分析
以SFmCUC1-F 和SFmCUC1-R 為引物,以測序正確的FmCUC1基因陽性克隆質粒為模板,成功構建植物表達載體pNC-Cam1304-SubC-FmCUC1(圖8)。

圖8 pNC-Cam1304-SubC-FmCUC1 表達載體結構圖Fig.8 Structure of pNC-Cam1304-SubC-FmCUC1 expression vector
利用農桿菌介導的瞬時轉化法,能夠快速鑒定基因功能。FmCUC1瞬時過表達72 h 后(圖9),基因表達量明顯高于對照(FmCUC1基因相對表達量 > 1),FmCUC1的過表達顯著上調了細胞分裂素信號轉導通路關鍵基因STM與B 型ARR12的表達分別為對照的2.82 倍和1.42 倍,而ESR1則下調表達;相反生長素信號轉導通路關鍵基因PLT3、PLT5基因均下調表達,可能是因為生長素與細胞分類素在植物體內的微變化才更有利于芽的分化。進一步驗證了CUC1基因通過調控下游STM基因的表達進而促進頂端分生組織的建立。

圖9 CUC1 基因通路相關基因表達情況Fig.9 Expression of genes related to CUC1 gene pathway
3 討論
近年來,由于分子技術的發展使人們對植物再生的基本過程有了新的認識,再生相關基因功能已在模式植物中逐漸被驗證[26]。本研究從水曲柳中克隆獲得FmCUC1基因,該基因與同科植物木犀欖親緣關系較近。蛋白序列分析發現,FmCUC1基因含有保守的NAC-domain 蛋白結構域與以往研究結果類似[11],這表明FmCUC1屬于NAC 基因家族。已有研究報道,擬南芥AtCUC1定位于細胞核[9],亞細胞定位結果顯示,FmCUC1基因定位于細胞核中,與上訴研究結果一致,表明FmCUC1可作為轉錄因子在細胞核中行使功能。FmCUC1基因在水曲柳3 年生盆栽苗的芽中表達量最高,這與劉超逸[27]研究結果類似;在水曲柳下胚軸芽再生過程中,進一步探究FmCUC1基因的表達模式,結果(圖6A)顯示其在芽點產生與叢枝形成期均上調表達。張佳薇等[23]關于水曲柳FmPHV基因克隆及在形成層愈傷組織中的表達分析研究中可知,芽再生過程中關鍵基因會出現2 次表達峰值的現象。本研究發現,FmCUC1基因在種子萌發的第4 天和第8 天分別達到2 個峰值,分別為第0 天的8.56 倍和8.46 倍,與上述結果類似。因此,推測FmCUC1基因在芽再生過程中發揮著重要作用。
植物的再生機制是一個復雜的調控網絡,往往依賴植物激素間的相互作用[28]。研究表明[29],生長素與細胞分裂素可直接或者間接地加速植物再生過程。因此,探究了FmCUC1基因對生長素與細胞分裂素的響應模式,結果顯示,在IAA 處理后,FmCUC1的表達水平與對照相比明顯升高。研究表明[27,30],CUC1基因表達受PIN1(生長素輸出運輸蛋白)基因調控,促進SAM 的起始,參與其形態建成,可推測FmCUC1同樣響應生長素信號,這與惠麥俠[6]在白菜中的研究結果一致。外源施加生長素與細胞分裂素可協同增強ESR1[31](芽再生中關鍵基因)表達,進而增強其下游基因CUC1的表達,促進芽再生[13]。本課題組發現,FmCUC1基因同樣響應了6-BA 信號,推測在外源施加細胞分裂素同樣可促進芽再生。此外,已有研究表明[32],低濃度BR 可誘導SAM 中CUC基因的表達,進而促進芽再生。本研究發現,在1 μmol·L-1BR 處理后,與對照相比FmCUC1的表達水平明顯升高,與上述研究結果一致。可推測在水曲柳芽再生過程中添加少量BR,有利于莖端分生組織形成,提高不定芽分化。
CUC1基因受生長素、細胞分裂素信號轉導通路中多個關鍵基因調控[29],共同促進植物的芽再生能力。生長素通路中的PLT3、PLT5和PLT7三個轉錄因子可激活下游芽再生特征因子CUC1和CUC2的表達,進而促進植物具有再生出芽能力[13]。WUS突變體可使植物喪失芽再生能力,表明WUS同樣是芽再生的關鍵調節因子,而WUS的表達又受細胞分裂素信號途徑關鍵因子B 型ARR的調控,ARR基因可直接結合到WUS啟動子區域激活其表達,進而影響植物的芽再生能力[33-35],隨著研究的深入,發現WUS與STM基因的缺失均會影響SAM的形成[34]。在擬南芥中,CUC1和CUC2基因在SAM 形成過程中冗余地發揮作用,CUC1與CUC2基因雙突變體才會導致幼苗缺失SAM,進而表現出杯狀子葉[11]。Wang 等[7]關于水稻CUC1基因研究表明,OsCUC1與OsCUC3基因對于維持SAM活性起到關鍵作用,當OsCUC1與OsCUC3基因功能缺失時,會導致水稻停止生長最終在苗期死亡。STM基因在SAM 表達較高,可調控SAM 中的干細胞活性[28],激活細胞分裂素途徑相關基因表達,進而影響植物生長[36]。研究表明[6],CUC1可促進下游STM基因在SAM 中表達,起始SAM。本研究發現,在水曲柳中過表達CUC1基因,其下游STM的表達上調,說明FmCUC1基因可能通過調控下游STM基因的表達,進而促進頂端分生組織的建立,影響芽再生能力。因此,可能正是由于生長素與細胞分類素在植物體內的這種微變化才會更有利于芽的分化。
4 結論
綜上所訴,FmCUC1基因屬于NAC 家族轉錄因子,參與水曲柳芽再生過程,響應了IAA、6-BA、BR 植物激素信號誘導,在水曲柳植株中過表達FmCUC1能促進其下游STM基因的表達顯著上調,進而促進芽再生。本研究可為進一步研究CUC1基因在水曲柳芽再生過程中的作用機制奠定基礎,但其具體分子機制及調控網絡有待進一步深入分析。

