MTHFR基因C677T多態性對進展期胃癌術后行SOX方案化療的安全性及預后的影響
鄭臨海,余春,汪珍珍
根據2020年我國國家癌癥中心的數據,胃癌的新發人數及死亡人數均位居第三,嚴重危害了我國國民的健康。近年來,雖然早期胃癌的診斷率較前有所提高,但進展期胃癌患者仍占胃癌患者的絕大多數。臨床主要以手術為主,聯合化療、放療、免疫治療等手段,從而延長患者生存期,改善生活質量。局部進展期胃癌的一線化療是以奧沙利鉑為基礎的聯合化療,如XELOX、SOX方案,但仍難以控制腫瘤的復發及轉移。隨著分子生物學的發展,腫瘤的治療已經進入了精準的個體化治療的時代,通過分子分型或二代測序來明確哪類胃癌患者通過相關治療后明顯受益是往后的研究方向。
亞甲基四氫葉酸還原酶(MTHFR)在葉酸代謝過程中起著重要作用,其基因中存在C677T多態性,包括野生型CC、雜合突變型CT及純合突變型TT,MTHFRC677T突變使得MTHFR的活性降低,抑制葉酸代謝的循環,影響嘌呤或嘧啶的合成,導致DNA合成或修復受損。近年來研究表明,MTHFRC677T多態性與肺癌[1]、胰腺癌[2]、胃癌[3]、結直腸癌[4]、乳腺癌[5]、食管癌[6]等多種腫瘤的易感性存在相關性。同時,MTHFR C677T多態性與腫瘤患者對氟尿嘧啶、鉑類藥物的毒副反應相關[7],與MTHFR C677T CC基因型攜帶者相比,CT/TT基因型攜帶者的血液學毒性風險顯著增加[8-9]。然而,MTHFRC677T多態性與SOX方案化療的安全性研究較少,且與腫瘤患者化療療效是否相關尚存在爭議。因此,本研究探討MTHFRC677T多態性對進展期胃癌術后行SOX方案化療的安全性及預后的影響,現報道如下。
1 資料與方法
1.1 納入與排除標準 納入標準:(1)經病理檢查確診為胃癌,且無遠處轉移;(2)行胃癌根治術治療,術后行SOX方案化療;(3)治療前6個月內未服用過免疫調節劑和激素類藥物。排除標準:(1)合并有嚴重肝腎功能不全者;(2)不能耐受化療或拒絕化療者;(3)沒有足夠標本用來檢測MTHFR基因遺傳變異者;(4)術后病理分期為早期胃癌或TNM分期Ⅳ期;(5)不能配合隨訪者;(6)合并有其他惡性腫瘤者。
1.2 一般資料 本研究為回顧性研究,收集2015年1月至2018年4月溫州醫科大學附屬衢州醫院(衢州市人民醫院)收治的胃癌根治術后規范化行SOX方案化療的胃癌患者,通過醫院的病歷系統收集整理患者的臨床資料,微信、電話或門診形式隨訪。共納入62例,其中男45例,女17例;年齡30~87歲,平均(64.1±12.1)歲。
1.3 方法
1.3.1 治療方案及隨訪 患者術前胃鏡病理檢查確診胃癌,完善術前檢查后行胃癌根治術。術后3~4周行一般健康狀態(PS)評分,PS評分≤2分時接受SOX方案化療。具體如下:奧沙利鉑130 mg/m2ivdrip d1,替吉奧40 mg/m2po bid d1~14,每21天重復。通過患者病歷、電話隨訪、門診隨訪或微信隨訪的方法來評價患者的預后。隨訪截止時間為2021年4月30日。腫瘤復發、失訪、到隨訪截止時間或者死亡視為研究終點。
1.3.2 MTHFRC677T多態性分型 MTHFRC677T多態性分型委托上海科醫聯創醫學檢驗所完成。用于MTHFRC677T多態性分型的標本為患者術后病理標本的石蠟片,DNA提取試劑提取總DNA。采用primer5.0進行引物設計,并利用Pub Med在線數據庫核對引物的正確性和特異度。限制性片段長度多態性聚合酶鏈反應(PCR-RFLP)技術檢測MTHFR C677T位點基因型。MTHFR C677T位點基因型引物上游序列為 5’-AGGACAGTGTGGGAGTTTGGG-3’,下 游 序 列 為 5’-GAAAAGCTGCGTGATGATGA-3’。MTHFR C677T位點基因分型為野生型CC、雜合突變型CT及純合突變型TT。主要試劑與儀器:瓊脂糖凝膠(北京賽百盛基因技術有限公司,中國),DNA提取試劑盒(康為世紀生物科技股份有限公司,中國),Taq Man SNP基因分型人類檢測試劑盒及Taq Man基因分型預混液(賽默飛,美國)。Simpli Amp PCR儀(ABI,美國),3500dx測序儀(ABI,美國),穩定DNA電泳儀(Bio Rad,美國),高速離心機(Beckman,美國)。
1.4 療效評價 患者在完成前2個化療周期后即開始通過詢問病史、體格檢查及化驗綜合評價化療的不良反應。參照常見不良反應評價標準(CTCAE)5.0版來記錄及分級(1~5級)。本研究主要評價血液系統毒性(貧血、骨髓細胞過少、發熱性中性粒細胞減少、彌漫性血管內凝血),胃腸道毒性(惡心、嘔吐、腹脹、腹水、便秘、腹瀉、消化不良),周圍神經毒性及手足綜合癥。
1.5 統計方法 采用SPSS18.0進行統計分析。符合正態分布的計量資料以均數±標準差表示,組間比較采用獨立樣本t檢驗;計數資料采用2檢驗或Fisher精確概率法。采用2檢驗考察患者各基因型頻同基因型臨床資料比較 62例中MTHFRC677T位點基因型分布分別為CC型32例(51.61%),CT型23例(37.10%),TT型7例(11.29%),其基因型分布符合Hardy-Weinberg遺傳平衡定律(2=0.806,P=0.369)。由于TT型患者少且考慮后期對比的方便,將CT型和TT型合并。不同基因型患者的臨床資料分布均衡,見表1。

表1 不同基因型臨床資料比較
2.3 進展期胃癌術后行SOX方案化療的不良反應不同分級發生率情況 57例(91.93%)患者遭受了毒性反應,其中1級不良反應發生率32.26%(20/62)、2級不良反應發生率29.03%(18/62)、3級不良反應發生率24.19%(15/62)、4級不良反應發生率6.45%(4/62)。見表2。

表2 不良反應分布 例(%)
2.4 胃癌患者MTHFRC677T位點基因型分布與各種不良反應的關聯 CT+TT基因型患者的血液系統毒性發生率為80%(24/30),高于CC基因型46.88%(15/32)(2=7.281,P=0.007),但毒性反應分級比較率是否符合Hardy-Weinberg遺傳平衡定律。等級/頻數表資料采用兩獨立樣本非參數檢驗中的Mann-Whitney U檢驗。采用Kaplan-Meier方法繪制生存曲線,用Log-Rank檢驗分析MTHFRC677T多態性與總生存期(OS)和無病生存期(DFS)之間的差異。P<0.05為差異有統計學意義。
2 結果
2.1 進展期胃癌術后行SOX方案化療的完成情況51例(82.26%)胃癌患者術后完成至少6個周期的SOX化療方案。在未完成預定化療周期的11例患者中,5例因腫瘤進展更改化療方案,4例因血液系統毒性等化療不良反應改為單藥替吉奧口服,1例因手足綜合癥減少藥物用量,1例因全身狀況較差、不能耐受而終止化療。
2.2 胃癌患者MTHFRC677T位點基因型分布及不無差異(Z=0.259,P=0.796);不同基因型在胃腸道毒性、周圍神經毒性及手足綜合癥的不良反應分布差異無統計學意義(P>0.05),見表3~4。

表3 不同基因型分布不良反應比較 例
2.5 不同基因型的DFS、OS分析 62例胃癌術后患者中位隨訪時間為59個月(95%CI:55.18~62.81),無失訪病例,其中27例患者死亡。生存分析顯示,MTHFR C677T位點CC基因型與CT+TT基因型的中位DFS分別為39個月(95%CI:32.71~45.29)和44個月(95%CI:41.05~46.95),3年的無病生存率分別為65.6%和70.0%,差異無統計學意義(2=0.496,P=0.481)。MTHFRC677T位點CC基因型與CT+TT基因型的中位OS分別為55個月(95%CI:49.85~60.15)和59個月(95%CI:56.59~61.40),3年的總生存率分別為75.0%和83.3%,差異無統計學意義(2=0.606,P=0.436),見封二彩圖5。
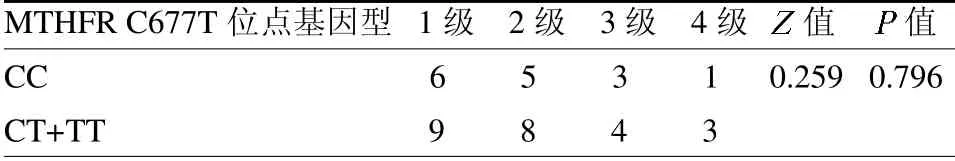
表4 不同基因型分布與血液系統毒性分級的比較 例
3 討論
胃癌已進入多模式綜合治療,針對D2根治性術后的胃癌,有多項大型III期臨床研究證實術后輔助化療的價值。目前,可切除II/III胃癌的術后輔助化療的I級推薦為鉑類為基礎的SOX或XELOX方案[10]。Park等[11]ARTIST2試驗結果顯示:與S-1單藥相比,輔助SOX或SOXRT(SOX聯合化療)可以顯著延長DFS,但相對SOX方案來看,SOXRT無額外生存獲益。對于胃癌患者的用藥應盡可能的個體化,從而保障患者的治療療效及安全性。為進一步明確哪類胃癌患者從術后輔助SOX方案化療中獲益,本研究從MTHFR C677T基因多態性方面探討了進展期胃癌術后行SOX方案化療的安全性及預后,為腫瘤患者用藥的個體化提供了一個新的切入點。
MTHFR是維持細胞內葉酸代謝平衡的關鍵酶,其能催化不可逆反應將5,10-亞甲基四氫葉酸轉變成5-甲基四氫葉酸;而5-Fu需在輔因子5,10-亞甲基四氫葉酸的存在下,和胸苷酸合成酶結合形成三聯復合物,影響胸苷酸合成酶與dUMP的結合。有研究證實在5-Fu使用之前提高腫瘤5,10-亞甲基四氫葉酸濃度可增強對胸苷酸合成酶的抑制作用,但同時也可導致5-Fu相關的細胞毒性增加。如果患者的MTHFRC677T存在TT純合子的變異,將預示療效較好,但毒副反應較強。替吉奧是一種氟尿嘧啶衍生物口服抗癌劑,其包括替加氟、吉美嘧啶及奧替拉西,其中替加氟能在體內轉化成5-Fu,吉美嘧啶能抑制5-Fu的分解代謝。目前替吉奧廣泛運用于消化道腫瘤的化療,如胃癌的SOX方案。Tang等[8]通過一項薈萃分析顯示,MTHFRC677T多態性可預測接受5-Fu化療的GC患者的嚴重血液學毒性,但不能預測效率。同時,Liu等[9]也通過薈萃分析得出,與肺癌患者MTHFR rs1801133CC基因型攜帶者相比,CT/TT基因型攜帶者的血液學毒性風險顯著增加。以上兩項研究結果與本研究的結果相對應。這一結果可能是由于TT基因型導致MTHFR活性降低,導致胸苷酸合酶的有效抑制(TS)和5-Fu效率增加,這可能對患者產生更大的毒性,因為5-Fu是一種細胞毒性劑[12]。MTHFR C677T多態性是否與化療的血液學毒性分級呈正相關尚不明確,Nahid等[13]研究發現MTHFR C677T多態性可能作為3級或4級中性粒細胞減少癥的預測因子,然而本研究提示MTHFR C677T多態性與血液毒性反應分級無相關性,受制于本研究的病例數偏少,難以進一步分層分析,后續需進一步探討。
目前,MTHFRC677T多態性與腫瘤預后的相關性爭議較大。Chen等[14]通過將5 423名結直腸癌患者納入薈萃分析,得出MTHFR C677T多態性與結直腸癌患者的預后無關。同時,Yousef等[15]進行了一項103名結直腸癌患者的前瞻性隊列研究,得出MTHFR C677T的基因多態性與接受5-FU/卡培他濱化療輔助方案的結直腸癌患者的DFS沒有顯著關聯。本研究結果顯示,MTHFRC677T多態性與進展期胃癌術后行SOX方案化療患者的DFS、OS無相關性,與Chen及Yousef等[14-15]的研究結果一致。而Meulendijks等[16]通過一項多中心2期研究調查了使用貝伐單抗聯合多西他賽、奧沙利鉑和卡培他濱作為60例晚期HER-2陰性胃癌患者的一線治療,發現MTHFR C677T多態性與DFS、OS顯著相關,其中TT基因型的患者預后較差。造成上述結果的差異可能與化療方案、腫瘤類別不同相關。
綜上所述,本研究通過MTHFR C677T基因多態性對進展期胃癌術后行SOX方案化療的安全性及預后的分析,結果顯示MTHFR C677T基因多態性與進展期胃癌術后行SOX方案化療的血液學毒性發生率相關,與血液學毒性程度及患者的預后無關。同時,本研究存在一定的局限性,如本研究只收集到7例TT基因型樣本,總樣本量相對較少,隨訪時間偏短,可能影響結果的準確性,后續將進一步擴大樣本量及延長隨訪時間進行驗證。本研究為回顧性分析,有一些偏倚難以避免。

