龍眼WOX家族基因鑒定及在體胚發生早期的表達分析
馬湘瑋,張舒婷,陳 燕,賴鐘雄,林玉玲
(福建農林大學 園藝植物生物工程研究所,福州 350002)
WUSCHEL相關的同源異型盒(WUSCHEL-related homeobox, WOX)家族是一類植物特有的轉錄因子家族,屬于同源異型盒(homeobox,HB)超家族中的一個亞家族[1]。在HB轉錄因子家族中,包含一個典型的DNA 結合螺旋-環-螺旋-轉角-螺旋基序的60~66個氨基酸殘基的同源結構域(homeodomain,HD)[1-2]。在WOX轉錄因子家族中此結構域非常的保守,證明此結構域在HD功能完整性方面起著重要的作用[3]。根據進化關系,將WOX轉錄因子家族成員分為3個分支,WUS支(WUS clade)、中間支(intermediate clade)和古老支(ancient clade)[4]。古老支演化較早,發現于藻類和被子植物中;中間支出現在蕨類植物起源之后,且不存在于藻類和苔蘚植物中;而WUS分支則僅在被子植物中發現,表明它是最先進的分支。
隨著高通量測序的發展(next generation sequencing,NGS),WOX基因家族在植物中也被廣泛鑒定[5-9],如毛果楊(PopulustrichocarpaTorr.)[10]、小立碗蘚(Physcomitrellapatens.)[5]和歐洲云杉[Piceaabies(L.) Karst.][6]等。WOX家族成員在調節植物生長發育的許多方面起著重要作用,如調控植物胚的形成、干細胞維持、調控體胚發生、側器官發育以及器官再生[11]。擬南芥(Arabidopsisthaliana)AtWOX1可能通過調節多胺的合成來調節側向器官的發育[12]。AtWOX3在葉和花器官原基的邊緣表達,促進細胞分裂與器官的橫向發展[13-14]。在胚胎發育過程中,過表達擬南芥AtWUS基因可促進陸地棉體細胞胚胎發生并誘導器官發生[15-16]。AtWOX8和AtWOX9最初在卵細胞和合子中共表達,然后通過不對稱分裂分別限制在合子胚的頂端和胚柄細胞中,并且都參與了擬南芥早期胚胎發育[17]。PaWOX2可能調節云杉中的胚胎細胞分裂和分化[18];WOX基因是葡萄體胚發生的關鍵調控因子[19]。綜合前人研究結果發現,WOX基因家族的功能涉及范圍很廣,這些功能的發揮與它們可以促進細胞分裂或阻止未成熟細胞的提前分化密不可分[20]。
龍眼(DimocarpuslonganLour.) 是無患子科(Sapindaceae)龍眼屬(Dimocarpus)的熱帶亞熱帶常綠果樹。龍眼在中國廣東、福建、廣西、云南、四川和海南等地廣泛種植,是重要的經濟作物之一。此外,龍眼還有豐富的藥理用途,富含大量的多酚,對炎癥、癌癥和心血管疾病有預防作用[21]。龍眼胚胎發育的狀態影響龍眼果實產量及品質[22]。龍眼體細胞胚胎發生(體胚發生)系統是研究龍眼胚胎發育較好的替代材料[23],也可以解決自然條件下龍眼胚胎取樣難、材料一致性差等問題。基于本實驗室建立的龍眼基因組數據庫[24]及DlWUS基因的實驗基礎[25],本研究采用生物信息學方法對WOX家族成員基本理化性質及系統進化等進行分析;基于龍眼體胚發生早期和不同組織部位的轉錄組數據庫,分析WOX家族成員在龍眼體胚發生早期胚性愈傷組織(EC)、不完全胚性緊實結構(incomplete compact pro-embryogenic cultures, ICpEC)與球形胚(globular embryos, GE)3個階段的表達(FPKM值);采用qRT-PCR技術驗證其在龍眼體胚發生早期及不同激素處理下胚性愈傷組織中的表達模式。
1 材料和方法
1.1 材 料
實驗材料采用福建農林大學園藝植物生物工程研究所培養的‘紅核子’龍眼胚性愈傷組織(EC)、不完全胚性緊實結構(ICpEC)和球形胚(GE)等體胚早期3個階段的材料,參考賴鐘雄培養方法培養[23]。取0.2 g生長狀態良好的EC,分別于0、50、100和200 μmol/L脫落酸(ABA)或茉莉酸甲酯(MeJA)的MS液體培養基中進行培養,120 r/min、(25士2)℃搖床上黑暗培養24 h后收樣,經液氮凍存后放于-80 ℃冰箱中保存備用。試驗設置3次生物學重復。
1.2 方 法
1.2.1 龍眼WOX家族成員的鑒定和系統進化分析在線網站(https://phytozome.jgi.doe. gov/pz/portal.html)下載擬南芥WOX(AtWOX)家族成員蛋白序列與CDS序列,以AtWOX蛋白序列為探針序列(E<0.001),并結合‘紅核子’龍眼基因組數據庫[24]進行篩選,初步獲得14條候選的龍眼WOX(DlWOX)家族蛋白序列。使用HMMER(https://www.ebi.ac.uk/Tools/hmmer/search/phmmer)及SMART(http://smart.embl-eidelberg.de/)在線網站進行WOX家族結構域鑒定,最終在龍眼基因組中確定13條含完整結構域的WOX蛋白序列。使用擬南芥基因組網站TAIR進行Blast比對,參考AtWOX家族成員的命名方法,對DlWOX家族成員進行命名。在線軟件Ex-pasyprotparam(https://web.expasy.org/protparam/)分析DlWOX蛋白的基本理化性質;MEGA6.1軟件基因鄰近法構建龍眼、擬南芥WOX家族成員系統發育進化樹,自展法系數(Bootstrap)設置為1000次進行重復檢驗,利用在線工具iTOL (https://itol.embl.de/upload.cgi) 對進化樹進行美化。
1.2.2 龍眼WOX家族蛋白保守基序與基因結構分析采用MEME在線軟件(http://meme-suite.org/tools/meme)分析DlWOX蛋白序列的保守基序(motif),使用Tbtools軟件進行可視化作圖。利用龍眼基因組的gff3文件,使用TBtools軟件對DlWOX家族基因結構進行分析。
1.2.3 龍眼WOX基因啟動子順式作用元件分析從龍眼基因組數據庫中提取DlWOX基因起始密碼子(ATG)上游2 000 bp序列作為DlWOX的啟動子序列,采用PlantCARE(http://bioinformatics.psb.ugent. be/webtools/plantcare/html)在線軟件分析龍眼WOX家族基因啟動子的順式作用元件,使用Excel軟件對分析所得到的順式作用元件結果進行繪圖。
1.2.4 龍眼體胚發生早期及不同組織部位中WOX基因的表達分析從龍眼體胚發生早期轉錄組數據庫(SRA050205)中,提取WOX家族成員在龍眼體胚發生早期3個階段(EC、ICpEC、GE)及9個不同組織部位(種子、根、莖、葉、花、花蕾、果肉、幼果、果皮)中的FPKM值,通過取對數(log2)轉換,并利用TBtools軟件繪制熱圖進行分析。
1.2.5 龍眼體胚發生早期及不同激素處理下WOX基因的表達分析使用Trizol up試劑盒(全式金,北京)提取龍眼體胚發生早期3個階段(EC、ICpEC、GE)的總RNA,使用SMARTTMRACE cDNA Amplification Kit TransScript RNA First-Strand cDNA Synthesis SuperMix(翊圣,上海)的說明書進行cDNA合成。以cDNA 10倍稀釋液為模板進行擴增,于羅氏LightCycler 480儀器中進行qRT-PCR檢測(表1)。以Beta-actin(ACTB)及Ubiquitin(UBQ)為龍眼不同激素處理及早期體胚發生過程qRT-PCR的內參基因,使用2-ΔΔCT方法計算DlWOX的相對表達量,將數據導入SPSS軟件分析差異顯著性,利用GraphpadPrism7制作圖表。

表1 qRT-PCR引物及相關信息
2 結果與分析
2.1 龍眼WOX家族成員鑒定及蛋白質理化性質分析
通過比對分析在龍眼中共鑒定出13個WOX家族成員,參考擬南芥WOX家族成員命名方法,分別將龍眼WOX家族成員命名為DlWUS、DlWOX1、DlWOX1.1、DlWOX1.2、DlWOX1.3、DlWOX14.1、DlWOX14.2、DlWOX2、DlWOX5B、DlWOX6、DlWOX7、DlWOX9A與DlWOX14.2(表2)。對龍眼WOX家族13個成員蛋白質理化性質進行分析發現,WOX家族分子量在10 390.99~202 745.36 Da之間,氨基酸數目在87~1 809 aa之間,不同成員之間的氨基酸數目差異較大;等電點在5.55~9.37之間,其中DlWOX6、DlWOX5B、DlWUS、DlWOX1.2、DlWOX2與DlWOX1.3為堿性蛋白,其余7個成員都為酸性蛋白;不穩定系數在55.25~89.07之間,且只有DlWOX14.2為穩定蛋白,其余12個成員均為不穩定蛋白。亞細胞定位預測結果顯示除DlWOX6定位在細胞骨架上外,其余成員均定位在細胞核上。
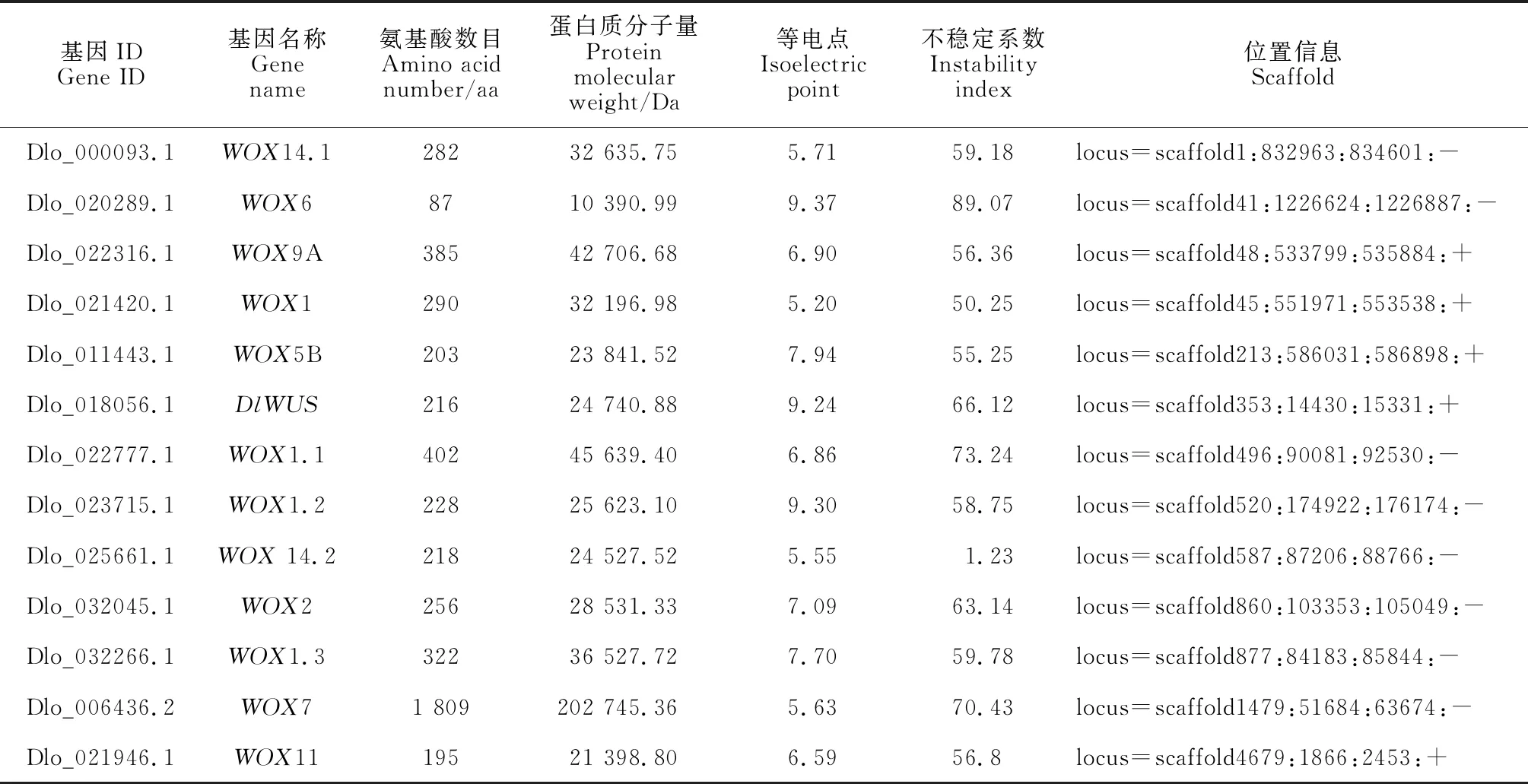
表2 龍眼WOX家族成員基本理化性質分析
2.2 龍眼WOX家族成員系統進化分析
為進一步研究龍眼WOX家族成員間的進化關系,利用MEGA6.10軟件構建擬南芥14個WOX家族基因(AtWOX1~AtWOX13、AtWUS)和龍眼13個WOX成員系統進化樹(圖1)。參考擬南芥的分類方法并結合同源比對,將龍眼WOX家族13條成員初步分成3個支系。遠古支、中間支和WUS支。遠古支包含了DlWOX1.2和DlWOX5B是樹上最小的分支,是WOX家族基因在擬南芥和龍眼中最小的類群。中間支是樹上最大的分支,包含了DlWOX7、DlWOX2、DlWOX11、DlWOX1、DlWOX1.1、DlWOX1.3。WUS支包含了DlWOX9A、DlWOX14.2、DlWOX6、DlWOX14.1、DlWUS。從進化樹的結果可以看出,所篩選的龍眼WOX家族基因并沒有出現單獨分支的情況且大多與擬南芥具有較高相似性。
2.3 龍眼WOX家族成員基因結構與蛋白基序(motif)分析
為進一步了解龍眼WOX家族成員的基因結構,對WOX家族成員的DNA序列與相對應基因組的cDNA序列進行比較(圖2,A),確定了13條基因的內含子、外顯子數量以及位置。結果表明,龍眼WOX家族基因成員外顯子數目在1-19之間,其中DlWOX7含有的外顯子數目最多有19個;DlWOX6與DlWOX11只有1個外顯子,DlWOX1、DlWOX14.2和DlWUS有3個外顯子,2個內含子;DlWOX1.1、DlWOX1.3和DlWOX9A有4個外顯子,3個內含子。分析發現龍眼WOX家族基因成員的基因長度存在比較大的跨度,DlWOX7基因最長,基因長度為12 000 bp左右;DlWOX6與DlWOX11最短。
對WOX家族成員蛋白序列進行蛋白質保守基序分析,結果(圖2,B)發現,除DlWOX14.1、DlWOX6和DlWOX7外,其他成員都含有基序motif1;除DlWOX14.1外其他成員都包含motif2。推測這2個保守基序共同組成HD保守結構域。Motif9只存在于DlWOX1.2和DlWOX7中;motif4只存在于DlWOX14.1、DlWOX6和DlWOX7中,推測DlWOX家族成員在進化的過程中出現了特有的保守結構域,功能產生了分化。DlWOX11和DlWOX14.2除了包含兩個基礎的保守基序motif1和motif2,并沒有其他基序,推測DlWOX14.1、DlWOX6和DlWOX7同其他龍眼WOX基因家族成員的功能冗余有關。
2.4 龍眼WOX家族成員啟動子順式作用元件分析
為深入了解龍眼WOX家族成員不同成員啟動子的功能之間差異,使用PlantCARE在線軟件對龍眼WOX家族起始密碼子上游2 000 bp的啟動子序列進行順式作用元件分析(表3)。龍眼WOX家族啟動子區域均含有光(Light)響應元件與生長素(Auxin)響應元件,推測WOX家族在光響應與生長素響應過程中起著重要的作用。大部分成員含有茉莉酸甲酯(MeJA)響應元件、干旱(Drought)響應元件、脫落酸(ABA)響應元件及厭氧誘導(Anoxic)響應元件。此外,DlWUS、DlWOX1.3、DlWOX2含有水楊酸(SA)響應元件;DlWOX2、DlWOX1.1、DlWOX5B、DlWUS、DlWOX14.1含有赤霉素(GA3)響應元件。以上結果表明龍眼WOX家族成員可能通過響應不同激素,參與龍眼不同生長發育過程。

表3 龍眼WOX家族基因成員啟動子順式作用元件
2.5 WOX家族成員在龍眼體胚發生早期的表達分析
為了解WOX家族基因在龍眼體胚早期的表達情況,從轉錄組數據庫中提取該家族基因的FPKM值,分析其在龍眼體胚發生早期3個階段(EC、ICpEC、GE)的表達模式(圖3)。結果發現,DlWOX6、DlWOX5B、DlWOX2、DlWOX11從EC到GE階段逐漸上調;DlWOX9A在龍眼體胚發生早期3個階段都有較高表達;DlWOX14.1、DlWOX9A、DlWOX1.2、DlWOX14.2、DlWOX7、DlWUS在EC到GE階段逐漸下調。以上結果表明,不同DlWOX基因在龍眼體胚發生早期不同階段發揮作用。
為進一步驗證DlWOX家族成員的表達模式,基于FPKM值篩選出在龍眼體胚發生早期表達趨勢差異較大的DlWOX11、DlWOX14.1、DlWOX14.2、DlWOX2、DlWOX9A、DlWOX6和DlWOX7等7個基因,采用qRT-PCR技術檢測其在EC、ICpEC、GE階段的相對表達(圖4)。結果發現,DlWOX6、DlWOX7、DlWOX11和DlWOX14.2在龍眼體胚發生早期的qRT-PCR結果與FPKM表達趨勢相似。FPKM顯示DlWOX14.1在EC階段表達量最高,GE階段表達量最低,而qRT-PCR顯示該基因在GE階段的表達量相較于EC階段和ICpEC階段顯著上升,這一結果與FPKM值完全相反;qRT-PCR顯示DlWOX9A與DlWOX2在EC至ICpEC階段的表達沒有顯著差異,與FPKM值表達趨勢不同。以上結果說明DlWOX基因具有一定的時空表達特異性。
2.6 龍眼WOX家族成員不同器官的特異表達分析
在不同器官中的表達分析發現(圖5),除DlWOX14.1、DlWOX14.2、DlWOX7、DlWOX6、DlWUS外,其余成員在不同器官中表達量低甚至不表達。DlWOX14.2在花、花蕾、莖和幼果中高表達;DlWOX14.1在花蕾和種子中高表達;DlWUS在根和莖中高表達;DlWOX7在所有的器官中都有著較高的表達量,在果肉中的表達量最高。推測DlWOX7在不同器官中特異表達。
2.7 GA3和MeJA處理下WOX家族成員在龍眼胚性愈傷組織中的表達分析
結合啟動子順式作用元件結果,采用qRT-PCR檢測不同激素處理下DlWOX基因的表達模式。GA3處理中(圖6,A),除DlWOX6以外其余成員對不同濃度GA3均有響應;DlWOX6、DlWOX11、DlWOX14.2、DlWOX7在200 μmol/L GA3時表達量最高,而DlWOX9A和DlWOX2在50 μmol/L GA3時表達量最高;DlWOX11表達量隨著GA3濃度的增加而增加;DlWOX6在100 μmol/L GA3時表達量受到了抑制。
MeJA處理中(圖6,B),除DlWOX6以外其余WOX家族成員對不同濃度MeJA均有響應,呈現先促進后抑制的表達趨勢,且在濃度為100 μmol/L時表達量最高;DlWOX6在濃度為50 μmol/L時表達量受到抑制。推測龍眼WOX家族激素MeJA處理的最適濃度為100 μmol/L。
3 討 論
3.1 龍眼WOX家族成員具有進化保守性及功能多樣性
WOX家族是一類在植物中特異存在的轉錄因子家族且廣泛作用于植物關鍵的發育過程[17]。目前,WOX家族已在多個物種中被鑒定,在龍眼中WOX家族還沒有被報道。本研究利用龍眼全基因組數據庫首次在龍眼中鑒定到了13個具有完整HD結構域的DlWOX家族成員,少于擬南芥(15個)[4]、簸箕柳(15個)[26],多于蘋果(12個)[27]。總體來講,龍眼WOX家族成員的數目與多數物種相近,推測在生物進化的過程中其并沒有發生大規模的擴增事件,這與擬南芥的研究結果一致[28]。DlWOX家族成員的外顯子數目為1~19個,多于番茄SlWOX成員的2~4個[7]和黃瓜CsWOX成員的2~5個[29]。
通過構建系統發育進化樹分析,將龍眼WOX家族分為遠古支、中間支和WUS支,位于同一分支的成員在功能上可能也具有相似性,這很有可能是由于龍眼WOX家族基因在發生進化的過程中沒有出現明顯的功能分化而導致的結果,因此使龍眼WOX家族基因與擬南芥的WOX同源性較高,值得注意的是WOX家族基因在擬南芥中最大的分支是WUS支而在龍眼中最大的分支是中間支,但是每一條基因的具體調控位置及功能還需后期進行功能驗證。在擬南芥中,AtWOX1及其同源體的主要功能是控制外側器官增殖與分化[30],而在矮牽牛中PtWOX1也同樣具有調控器官的橫向發育的功能[31]。蛋白基序分析發現幾乎所有的龍眼WOX家族成員都含有motif1和motif2,這兩個保守基序共同構成同源結構域HD,某些成員含有特異性的基序,可能造成龍眼WOX家族的功能分化。蛋白質理化性質分析發現,大部分龍眼WOX家族成員編碼的蛋白都為不穩定蛋白,均定位在細胞核。通過分析龍眼WOX家族在不同器官中的特異表達,發現龍眼WOX家族成員在花、花蕾、葉、果皮、果肉、根、種子、莖中都有表達且在葉中的表達量較高,值得注意的是DlWOX7在龍眼不同器官中高表達且在果肉中的表達量最高。研究發現,DoWOX7可能通過在鐵皮石斛合蕊柱中高表達來調控鐵皮石斛花發育[32];在擬南芥中,WOX7在根中高表達以介導糖類對側根形成的抑制作用[33];而在黃瓜中CsWOX7并無明顯的特異表達模式[29]。由此推測,WOX7的表達模式在物種間存在差異,可能由于其在不同物種中具有不同的功能。
3.2 龍眼WOX家族成員可能調控龍眼早期體胚發生過程
植物體胚發生是一個復雜的過程,基因差異表達決定了不同細胞的命運分化。WOX家族成員在促進體胚發生、維持干細胞以及細胞命運轉變等方面發揮著重要的作用[34]。PaWOX2影響云杉體胚早期表達[35],AtWOX2在胚胎頂端區域調控胚的形成[17];除此之外,AtWOX9作為擬南芥胚胎發育的調節因子調節胚胎發生的早期,其突變體還會導致體細胞胚胎發育受損、胚胎基部發育不全、下胚軸和子葉的缺陷、球形胚或更早期的發育受阻和細胞分裂頻率降低[36],PaWOX9在莖尖和根尖分生組織調節體胚早期發生并且促進細胞的增殖。在本研究中,為了進一步探究DlWOX家族在龍眼體胚發生過程中的作用,對龍眼WOX家族在龍眼體胚發生早期過程表達趨勢差異較大的7個基因進行qRT-PCR 分析,發現大部分成員(DlWOX14.2、DlWOX11、DlWOX6、DlWOX7、DlWOX14.1)都在GE階段高表達;DlWOX2在ICpEC階段表達量最高;DlWOX9A在龍眼體胚發生早期三個階段沒有顯著差異性。據前人的報道,WOX家族成員已被證明在協調參與胚胎發生早期階段的基因轉錄,芽、根和分生組織功能以及植物器官發生中發揮重要作用,且WOX2、WOX8、WOX9是體胚發生早期的重要調控因子[17];在挪威云杉中PaWOX2和PaWOX8/9在體胚發生早期GE階段的表達量最高[37];海島棉中GbWOX9在GE階段的表達量是EC階段和心形胚(heart embryo,HE)階段的2倍多[38]。本研究發現DlWOX9A轉錄組測序結果與qRT-PCR結果的表達量存在差異并且趨勢也不完全相同,還需后期的試驗進一步驗證。VvWOX5參與了葡萄的魚雷型(torpedo stage,SE1)胚早期,在EC和早期的SE1中,其表達水平顯著高于子葉期(cotyledonary stage,SE2)和體胚發芽期(somatic embryos in germination,SEG)[19]。張東敏等[25]分離克隆了龍眼WOX家族的WUS成員,發現DlWUS在整個龍眼體胚發生過程均有表達,在GE階段發揮作用,并影響體細胞胚胎發育后期的形態建成。DlWOX14.2、DlWOX11、DlWOX6、DlWOX7、DlWOX14.1在EC、ICpEC與GE三個階段高表達,在GE階段的表達量最高,這一研究結果與前人的一致。推測WOX家族在龍眼的整個體胚發生早期起著重要的作用,尤其是在GE階段。
3.3 龍眼WOX家族成員可能通過響應赤霉素和茉莉酸甲酯從而調控龍眼早期體胚發生過程
GA在植物生長發育的許多方面發揮重要作用,例如種子發育和萌發、體細胞胚萌發和再生、莖伸長、無核果實的發育和花朵發育[39-41]。在體細胞胚胎發生的后期、合子胚胎發生的早期階段、胚胎開始發育和分化,這些形態發生事件也受GA調節并且缺乏GA也會導致種子敗育[42]。本研究中,6個龍眼WOX家族成員經GA處理后除DlWOX6外均呈上調表達,而DlWOX11和DlWOX2都含有GA響應元件,進一步說明了龍眼WOX家族可以響應GA的處理;值得注意的是DlWOX6、DlWOX14.2、DlWOX7、DlWOX9A雖然不含有GA響應元件,但qRT-PCR結果顯示其也能在一定程度下響應GA處理并大部分成員呈現上調的表達趨勢,說明其他龍眼WOX家族成員可能也在一定程度上響應GA的調控。前人研究發現DlWUS含有赤霉素應答元件(P-box)且施加低濃度的GA可以促進DlWUS的表達,從而調控龍眼體胚發生過程[25]。結合qRT-PCR結果,推測龍眼WOX家族可能通過響應GA來調控龍眼體胚發生。
研究表明MeJA的應用以濃度依賴性方式抑制愈傷組織的誘導和生長、胚性懸浮液的增殖、分化以及體細胞胚的萌發和轉化[43-44]。在紫苜蓿的體細胞胚胎中,MeJA以不同的方式影響1-氨基環丙烷羧酸(ACC)積累;在愈傷組織中檢測到ACC的增加,而在球形胚中發現ACC水平降低[45];適宜濃度的MeJA能使雜交鵝掌楸的體胚發生率和成熟率升高并且降低畸形率[46];在橡膠樹中MeJA可以誘導體胚過程中的花青素積累[47]。通過分析qRT-PCR結果發現,龍眼WOX家族成員都在一定程度上響應MeJA調控,除DlWOX6外其余成員均呈上調表達。DlWOX6、DlWOX11、DlWOX9A、DlWOX2都含有MeJA響應元件,DlWOX14.2和DlWOX7不包含該響應元件,在MeJA的處理下也能呈現上調的表達趨勢,猜測龍眼WOX家族可能有復雜的激素調控關系。
本研究通過qRT-PCR檢測龍眼WOX家族在GA和MeJA處理下的表達模式,大部分DlWOX家族成員在GA和MeJA處理下表達上調。值得注意的是DlWOX9A在GA和MEJA處理下表達量顯著上調,推測該成員可能與一些激素互作,共同參與龍眼體胚發生,但是具體的過程還需要更進一步的研究。

