熱預適應延緩運動疲勞的分子機制的初步探究
曹慶雷
疲勞是一種由外周和中樞系統雙重因素影響的復雜現象,如糖原的耗竭、心血管勞損等(Neher et al.,2006)。運動性疲勞的機制存在多種假說,包括中樞神經遞質失衡、內穩態失調、氨基酸、離子代謝紊亂、自由基增多、能源衰竭和神經內分泌、免疫系統的平衡打破等(張蘊琨等,2006)。Matsui等(2011)報道,長期的低血糖運動會引起腦糖原降低,導致單胺代謝的激活引起中樞疲勞。長時間運動產生的疲勞以中樞神經系統(central nervous sys‐tem,CNS)出現的保護性抑制為主,其中CNS的神經遞質參與了疲勞的產生與發展。過去的運動性中樞疲勞研究多集中在腦和脊髓的形態結構與功能方面,而運動性中樞疲勞是如何激活、是否存在于人類運動性中樞疲勞的相關基因群中,尚不清楚。運動性中樞疲勞是機體對外界刺激做出的保護性反應,其調控機制非常復雜,且基因表達存在著時間和組織特異性。因此,采用傳統的核酸印記雜交以及RT-PCR等方法難以獲得足夠的信息,特別是無法了解基因間的相互關系(Fernstrom et al.,2006)。
熱預適應是指將實驗體短時間內多次放置在高溫條件下進行運動,從而使實驗體的表皮和體內溫度升高,為后續運動或實驗做準備,這也成為研究運動疲勞的一種實驗手段(Guy et al.,2015;Tyler et al.,2016;Weller et al.,2007)。熱預適應作為一種安全有效且操作簡便的實驗手段,可減輕實驗體在實驗過程中產生的機體損傷,比如缺血預適應后可保護腦組織、肌肉組織(劉亮等,2001;張銀環等,1995)。陳開祥等(2007)研究表明,熱預適應可減輕心肌細胞損傷,從而起到一定的保護作用。熱預適應作用的主要原理為:環境溫度的改變使得皮膚等表皮器官作為接收器,將熱應激信號傳遞至下丘腦等相關區域,下丘腦整合為熱敏元信號釋放相關激素,影響中樞神經甚至整個機體,引發中樞性疲勞或運動性疲勞。有研究顯示,當機體達到中樞性疲勞或運動性疲勞時,會提高多巴胺(dopamine,DA)、去甲腎上腺素(norepinephrine,NE)的活性來抑制中樞性疲勞,提高運動耐受力,從而延長運動時間(張念云 等 ,2012;Hasegawa et al.,2008;Takatsu et al.,2010)。此外,機體還會產生一系列的反應,例如釋放相應神經遞質、改變相應受體表達從而調整受體數量,由此進行全身性調節等以適應環境的改變(胡琰茹 等,2015;Fuller et al.,1998;Rodrigues et al.,2003;Walters et al.,2000)。機體在長時間產生此種反應調節后,必定會改變自身原有調節機制,適應環境變化,推測其原有調節機制可能與某些基因的變化相關,變化的基因可能存在于上調基因或改變的轉錄本中。
在機體維持自身穩態以適應外界環境的過程中,必然會對作為運動承受方及發出方的肌肉組織產生影響。主要的過程為:經下丘腦區域激發產生的神經遞質作用于相應效應器以刺激其釋放激素與肌肉細胞上的受體結合,影響肌肉細胞內部基因的表達,若肌肉細胞內部失衡,下丘腦分泌相關激素作用于大腦皮層,抑制神經遞質釋放,使運動能力下降、運動時間減少(盧文彪,2010)。大鼠經熱預適應運動后產生的神經和中樞疲勞的信號被大腦皮層接收從而釋放神經遞質,進行神經-體液調節,使機體逐漸適應外界環境,達到自身穩態平衡(Neher et al.,2006)。大鼠神經遞質和激素在全身性調節下趨于平衡狀態,有可能適應了實驗的熱應激條件,推遲了運動疲勞產生的時間(曹慶雷等,2019)。
實驗通過轉錄組分析獲得的差異基因與相關參考的注釋信息進行比對,對因熱預適應產生改變的轉錄組進行分析總結(竇金煥,2016),了解熱預適應所影響的相關轉錄組,該生物學方法在醫學、運動學領域的研究,今后可能廣泛應用于大鼠甚至人體。肌肉細胞作為運動的承載者,與運動及一切生命活動的關系最為緊密(謝永濤等,2011),因此本研究將大鼠肌肉細胞作為實驗對象,通過高通量測序技術,發現并分析轉錄組差異表達的基因。
1 材料與方法
1.1 實驗模型建立和樣品采集
成年雄性SD大鼠24只,體質量230~260 g(購自北京維通利華實驗動物公司),飼養于首都師范大學實驗動物中心大鼠飼養房,自由飲水、飲食,飼養房溫度18℃~24℃,空氣相對濕度40%~60%,晝夜節律正常。
1.2 實驗方法
1.2.1 熱預適應處理
大鼠隨機分為對照組和熱預適應組,每組12只。將熱預適應組大鼠置于42℃水中,使其不間斷水浴運動,使大鼠內臟器官溫度升高至肛溫42℃維持15 min,期間保持大鼠呼吸通暢。運動結束后,將大鼠移出水浴鍋,全身擦干,置于常溫下1 h,再次水浴運動至肛溫42℃維持15 min。每天進行3次,連續7天。對照組大鼠正常飼養在室溫25℃的環境中,不做任何處理。所有的實驗程序均經首都師范大學動物倫理審查委員會批準,實驗方案符合首都師范大學實驗動物管理和使用規程。
1.2.2 RNA提取
取熱預適應組大鼠和對照組大鼠的肌肉組織,利用Trizol試劑(Life Techonology公司,美國)提取總RNA,置于-80℃條件下保存備用。提取的各RNA樣品均以無DNase的DNaseI(TaKaRa公司,大連)進行處理,以消除可能存在的基因組DNA污染,然后分別等量混合3個對照組和熱預適應組的RNA樣品(30 μg)。使用Oligotex mRNA小量提取試劑盒(Qiagen公司,德國)分離和純化mRNA。通過 Agilent 2100 Bioanalyzer(Agilent RNA 6000 Nano Kitb Agilent公司,美國)檢測total RNA的濃度、RIN值、28S/18S和片段大小。純度使用紫外分光光度計NanoDrop TM進行檢測。
1.2.3 cDNA文庫構建及高通量測序
采用mRNA富集法對total RNA進行處理,用帶有Ol‐igodT的磁珠富集有polyA尾巴的mRNA以獲得片段化的RNA,隨機的N6引物進行反轉錄,合成cDNA。采用瓊脂糖凝膠電泳篩選目的片段,通過特異的引物進行PCR,擴增富集所得到的cDNA文庫。高通量測序由廣州華大基因生物科技有限公司提供測序服務,使用BGISEQ-500進行文庫的測序。
1.2.4 數據處理與分析
使用SOAPnuke軟件對測序原始數據進行過濾,將其包含的低質量、接頭污染以及未知堿基N含量過高的測序片段進行過濾篩選,經數據過濾后獲得高質量測序片段。使用Bowtie2將過濾后測序片段與參考序列進行比對,以統計基因比對率,之后再使用RSEM計算基因和轉錄本的表達水平。使用R語言軟件里的cor函數計算每兩個樣品之間的皮爾遜相關系數。根據基因本體(gene ontology,GO)注釋結果以及官方分類,將差異基因進行功能分類,根據KEGG注釋結果以及官方分類,將差異基因進行生物通路分類。使用PossionDis算法進行差異基因檢測,差異表達基因默認定義為FDR≤0.001且差異倍數在2倍以上。
2 實驗結果
2.1 RNA質量檢測和轉錄組測序數據質量檢測
用于轉錄組測序RNA先進行質量檢測,結果如表1所示。對照組和熱預適應組樣品的OD260/280值均分別為2.00和2.02;RIN值分別為8.80和8.40,28S/18S值分別為1.20和1.10。這表明本研究所用的樣品組織RNA質量較好,滿足轉錄組測序要求。
由于測序儀、試劑、樣品質量等均能影響堿基質量測序,因此原始數據包含低質量、接頭污染以及未知堿基N含量過高的reads,為保證測序reads的準確性需要確定堿基質量分布。正常情況下,reads中的前幾個堿基質量值不高,是因為反轉錄時隨機引物不能很好地結合RNA模板;測序長度的增加在一定范圍內有助于提高測序質量,但長度達到一定閾值后,由于測序試劑的消耗,高質量堿基的比例會降低。從整體上看,如果低質量(Quality<20)的堿基比例較低,說明測序質量較好(表2)。

表2 測序數據評估統計Table 2 Satistical Results of Sequencing Data
從上述結果可知,通過測序,共獲得了219.72 Mb條的reads,總堿基數為10.99 Gb,每個樣品均獲得了10 Gb以上的堿基,Q20在97%以上,Q30在90%以上。這表明轉錄組測序得到的結果質量可靠,可用于后續結果分析。得到過濾后reads之后,使用HISAT序列比對軟件將過濾后reads比對到參考基因組序列,結果如表3所示。兩個樣品分別獲得110 454 472和109 271 956個reads,以大鼠基因組為參考進行比對,結果表明,平均每個樣品的比對率達到92.53%。比對到參考基因組某一位置過濾后reads平均值為67.50%。兩個樣品的reads與參考基因組的比對效率較高,說明本次測序結果具有較強可靠性。

表3 參考基因組對比結果統計表Table 3 Statistical Table of Comparison Results of Reference Genome
2.2 基因表達量分析
2.2.1 基因比對與表達
使用Bowtie2將過濾后reads比對到參考序列,之后再使用RSEM轉錄組分析軟件計算基因和轉錄本的表達水平。以大鼠的表達基因序列為參考基因,對比及表達結果表明,reads比對到參考基因的比率平均為84.26%,reads比對到參考基因唯一位置的比例平均值為65.22%(表4)。說明兩組樣本的reads對表達基因序列的比對率較高,可以用于后期表達差異分析。從表5可以看出,在基因數、轉錄本數量上,兩組樣本間都存在明顯差異,熱預適應組樣本的基因數量較對照組多,特別是新轉錄本(新轉錄本是指在參考注釋信息中未能找到已知注釋信息的轉錄本,即新轉錄本可能屬于已知基因的新的剪接亞型,或者屬于未知基因的新轉錄本)。這些新的轉錄本預示新的蛋白編碼,這些蛋白很可能在延緩肌肉疲勞的過程中發揮重要作用。

表4 轉錄組測序數據質量檢測Table 4 Quality Testing of Transcriptome Sequencing Data
表5 基因和轉錄本統計Table 5 Statistics of Gene and Transcripts
2.2.2 差異表達基因的篩選
為了展示基因表達量的分布,對FPKM(FPKM<1、FPKM 1~10、FPKM>10)的3種情況進行了基因數目統計。通過公式計算得到熱預適應組及對照組大鼠肌肉組織FPKM值(圖1)。對照組FPKM<1的基因占36.63%,FPKM>10的基因占23.25%。熱預適應組FPKM<1的基因占34.49%,FPKM>10的基因占28.18%。同時看出,已知基因和新基因在熱預適應組中表達量高于對照組,說明大鼠經熱預適應后刺激了某些已知基因提高其表達量,或是誘導了某些新基因的表達,參與到延緩疲勞的過程中。

圖1 基因表達圖Figure 1.Gene Expression Map
2.2.3 差異表達基因檢測
為檢測大鼠經熱預適應后的基因表達差異,進一步使用IDEG6軟件,從差異倍數和顯著水平進行評估,將差異倍數在2倍以上且顯著水平為P<0.05定義為基因表達差異顯著。根據火山圖(圖2)所示,對照組和熱預適應組存在較多的差異表達基因。與對照組相比,在熱預適應后的肌肉組織中共獲得2 267個差異表達基因,其中表達下調的基因555個,表達上調的基因1 712個(圖3)。表達上調的基因數目大約是表達下調的基因數目的3倍,表明經過熱預適應處理后,跟對照組相比,更多的基因表達上調去適應這種溫度的變化。換言之,熱預適應處理過程中很多基因需要上調表達。表達量上調最多的基因是α-微管蛋白特異性1c鏈(tubulin specific 1C chain,TUBA1C),與對照組相比上調432倍,TUBA1C是組成微管的重要蛋白,微管蛋白在細胞運動中具有重要作用,熱預適應可以促進微管蛋白的表達升高,表明熱預適應也可以改變肌肉組織相關蛋白的表達進而促進對熱應激的適應。表達量下調最多的基因是乙酰輔酶A酰基轉移酶(acetyl-Co A C-acetyl‐transferase,AACT),是參與細胞營養物質代謝的重要功能酶,與對照組相比,其在熱預適應后表達量顯著降低533倍,表明熱預適應也會影響肌肉組織中相關蛋白酶的表達。這些結果顯示,熱預適應處理組和對照組差異基因表達模式相差較大。在高溫處理后,大量基因表達發生明顯的變化,上調的差異表達基因數量較多,這可能參與了大鼠高溫應答的互作通路。

圖2 差異表達基因火山圖Figure 2. Volcanic plot of Differentially Expressed Genes

圖3 差異表達基因的統計Figure 3.Statistics of Differentially Expressed Genes
2.2.4 差異表達基因GO功能分析
根據差異基因檢測結果,對其GO功能進行分類及富集分析。對GO分析的結果表明,差異表達基因按功能可以分為細胞組分、分子功能和生物過程三大類,生物學過程所占比例最多。在生物學過程中,與生物體代謝調節相關的過程(如代謝過程、生物過程的調節、刺激應答等過程)最多,表明在熱預適應后大鼠的肌肉組織中有大量的代謝調控相關基因發生應答反應,從而適應此過程。在細胞組分分類中,細胞部分和細胞器、細胞膜所占比例最多,總體而言,組分類基因變化少于生物學過程基因,通過熱預適應處理1周,該過程中肌肉細胞發生響應,但是組分變化的作用低于代謝調控類基因變化的作用。在分子功能中,上調基因發揮的主要功能是催化細胞中相關酶的活性,說明熱預適應過程中相關的催化活性蛋白或者結合蛋白發揮了重要作用,這些蛋白可能通過分子功能的改變適應外界環境的變化。此外,在GO功能分類中,與運動相關的生物學過程包括細胞過程、生物調節過程、代謝過程、刺激應答過程、分子或組織的生物合成過程、信號轉導過程等。由此可見,經熱預適應后的大鼠產生的差異轉錄組會作用到各種基因類型,共同參與細胞或者機體適應環境。
根據差異基因檢測結果,對GO功能進行分類及富集分析,GO功能對應的差異表達基因上、下調統計結果見圖4。通過“基因本體功能富集”模塊對差異基因進行富集分析,對每類基因數量進行統計,篩選出PDF≤0.01的通路。大鼠在熱預適應后整體基因都處于上調狀態,下調基因數目較少,可以看出,在生物過程中,上調基因的GO terms與細胞轉化、生物調節及代謝過程有關,主要參與細胞的生長發育,下調基因主要參與基因調控。在細胞組分中,上、下調基因主要參與生成細胞器、細胞膜等細胞結構的過程。在分子功能中,上調基因主要參與催化細胞中相關酶的活性與結合活性,下調基因參與細胞器的構成。應激反應中的差異表達基因富集較為顯著,表明大鼠肌肉在熱預適應過程中產生了大量參與調控代謝的活動,為后續延緩運動疲勞提供了可能性。
圖4 差異表達基因GO功能分類統計Figure 4.GO Function Classification Statistics of Differentially Expressed Genes
2.2.5 差異表達基因KEGG富集分析
根據差異基因檢測結果,我們對其進行KEGG生物通路分類以及富集分析。將基因根據參與的KEGG代謝通路分為6個部分:細胞過程、環境信息處理、遺傳信息處理、人類疾病(僅限動物)、代謝、有機系統(圖5)(袁姣,2015)。差異基因在細胞過程中的主要功能是運輸和分解代謝,在環境信息處理中參與信號傳導和信號分子交互過程,在遺傳信息處理中主要參與遺傳信息的折疊、排序和退化以及翻譯過程,在代謝方面主要參與脂質代謝,在有機系統中主要參與免疫系統和內分泌系統。由此可見,經熱預適應后的大鼠轉錄組發生的改變,主要體現在提高細胞的運輸和代謝、增強信號分子傳導效率、參與遺傳信息表達過程和提高脂質代謝的過程中。熱預適應對大鼠肌肉組織轉錄組的影響主要在于提高細胞代謝、增強傳導效率,從而延緩運動疲勞的產生(馬國強等,2014)。
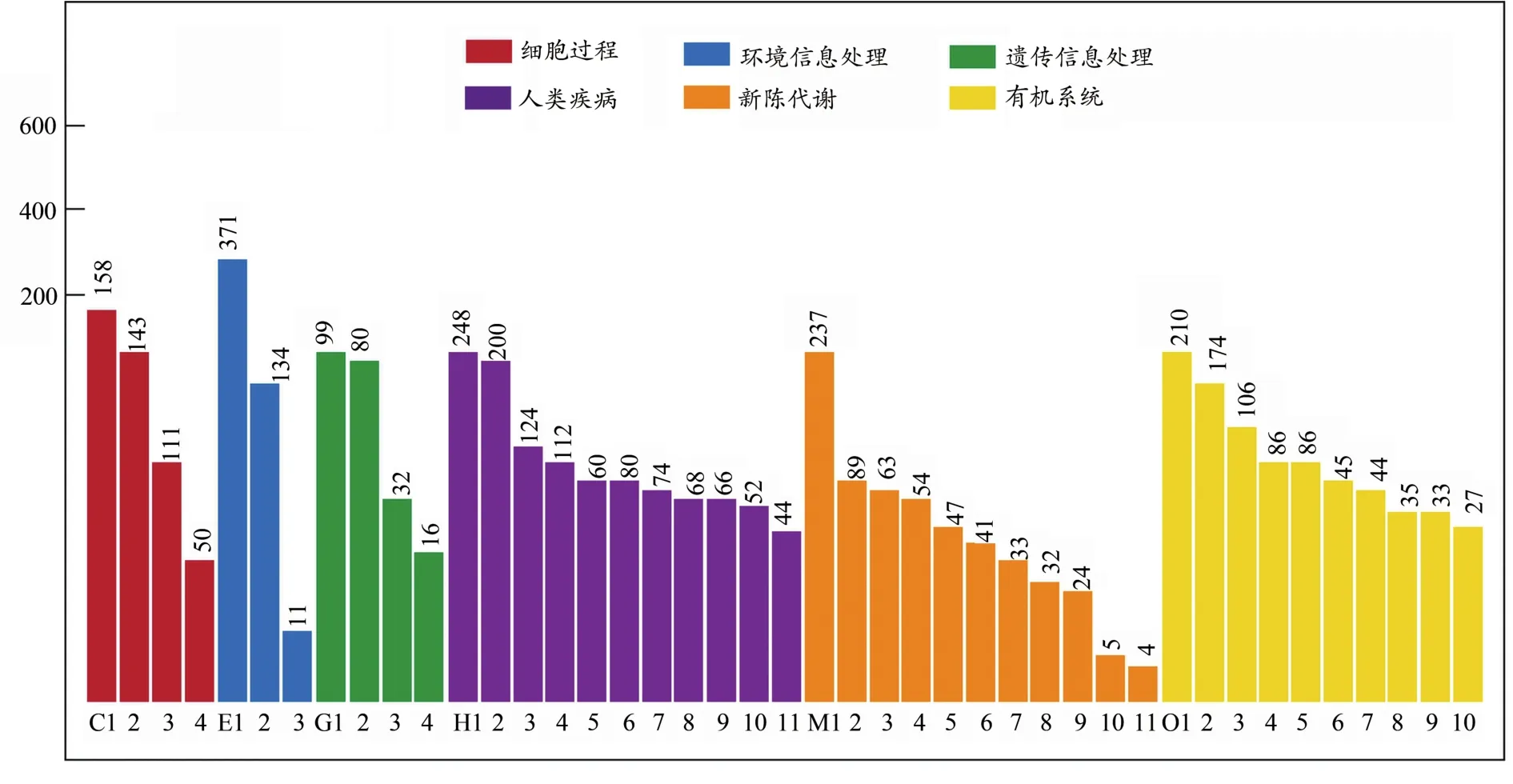
圖5 差異基因的通路分類Figure 5.Pathway Classification of Differential Genes
使用R語言軟件中的phyper函數進行富集分析,選取10條差異基因顯著的信號通路進行解釋(表6)。可以看出,大鼠經熱預適應后差異基因主要參與蛋白酶體、HIF-1信號通路、PI3K-Akt信號通路、細胞外基質(extracellular matrix,ECM)受體相互作用、膀胱癌、肝纖維化、血管重建、促進卵巢癌細胞增殖與侵襲等過程。其中,蛋白酶體富集最為顯著,其功能主要涉及細胞周期控制、細胞凋亡和應激反應等。

表6 差異表達基因通路功能富集部分結果示例Table 6 Examples of the Results of Pathway Functional Enrichment of Differentially Expressed Genes
將富集明顯的30條信號通路中基因的上、下調情況進行了統計。實驗樣本富集通路差異基因上調的基因主要存在于蛋白酶體和谷胱甘肽(glutathione,GSH)代謝過程。蛋白質是生命功能的體現者,而蛋白酶體直接影響某些蛋白質的更新,其中包括錯誤折疊蛋白和許多在生命活動中起重要作用的蛋白質,如p53、cyclin等。蛋白酶體對蛋白質的降解通過泛素介導,泛素識別要被降解的蛋白質,然后將這種蛋白質送入蛋白酶體進行降解。這就說明,參與蛋白合成和降解的基因表達都是上調的,換言之,經熱預適應后,機體在運動過程中很可能通過提高代謝率緩解疲勞。
GSH作為一種細胞內重要的調節代謝物質,既是甘油醛磷酸脫氫酶的輔基,又是乙二醛酶及丙糖脫氫酶的輔酶,參與體內三羧酸循環及糖代謝,并能激活多種酶,如巰基酶-輔酶等,從而促進糖類、脂肪和蛋白質代謝。同時,GSH通過巰基與體內的自由基結合,可直接使自由基還原成酸性物質,從而加速自由基的排泄,并對抗自由基,減輕其對重要臟器的損害。Haddad等(2002)研究發現,GSH參與了脂多糖誘導的細胞因子轉錄的調節及I-κB/NF-κB信號通路的調節。NF-κB是具有多向性調節作用的蛋白質分子,參與調控多種因子的基因表達,在免疫調控、炎癥、應激反應及細胞凋亡中起重要作用。NF-κB還可進行反饋調節,通過迅速合成I-κB終止轉錄。NF-κB表達廣泛,功能及調節較為復雜,而且能夠誘導NF-κB和DNA結合的誘導物很多,對應激反應、細胞黏附和增生均有重要的調節作用。
3 討論
本研究對熱預適應的大鼠肌肉組織轉錄組文庫進行分析,經測序得到17 951個基因,已知的基因17 616個,預測的新基因435個;同時,測序得到的9 825個新轉錄本中,8 325個屬于已知蛋白編碼基因的新的可變剪接亞型,435個屬于新的蛋白編碼基因,剩下的1 065個屬于長鏈非編碼RNA。在熱預適應后的大鼠肌肉組織中共獲得2 267個差異表達基因,其中下調基因555個,上調基因1 712個。進一步將這些差異基因進行GO功能注釋和KEGG代謝途徑注釋。GO功能注釋分類表明,肌肉組織不同生理狀態差異表達基因主要涉及細胞相關類別(細胞組分、細胞器等)、膜相關類別(包括膜、膜部分)、分子綁定、催化活性、分子傳感器活性、細胞過程、代謝過程等。這些結果表明,參與大鼠肌肉生理活動的差異基因除了集中于細胞內,還廣泛分布于生物調節和代謝過程、刺激應答過程、多生物體過程或發育過程、生物過程正反饋調節、細胞組分或生物合成信號通路等。在生物過程中,上調基因的GO terms與細胞轉化、生物調節及代謝過程有關,主要參與細胞的生長發育。下調基因主要參與基因調控。在細胞組分中,上、下調基因主要參與生成細胞器、細胞膜等細胞結構的過程。在分子功能中,上調基因主要參與催化細胞中相關酶的活性、結合活性,下調基因參與細胞器的構成。應激反應中的差異表達基因富集較為顯著,表明大鼠肌肉在熱預適應過程中存在大量的代謝調控。此外,在肌肉細胞的表達基因中,分子綁定功能類別占有較高比例,進一步證實分子綁定功能類別在肌肉中具有顯著表達,推測分子綁定在大鼠肌肉的生理活動中可能具有重要的作用。對差異基因進行通路富集分析,可以確定差異表達基因參與的主要代謝途徑和信號傳導途徑,以及與其他基因的相互作用。本研究KEGG通路分析表明,差異表達基因共涉及326個通路,其中蛋白酶體、HIF-1信號通路、PI3K-Akt信號通路和ECM受體相互作用等4個通路被顯著富集。
蛋白酶體主要參與細胞周期控制、細胞凋亡、應激反應、DNA修復、基因轉錄、抗原提呈、信號轉導、癌癥、炎癥、神經退行性疾病的發生等(Javitt et al.,2019)。低氧誘導因子(hypoxia inducible factor,HIF)由HIF-α和HIF-β兩個亞基組成,在低氧下能激活多種靶基因的轉錄,在細胞、組織生長發育和生理應激,以及某些病理過程中具有重要的作用。近年來,有關HIF-1在細胞低氧應激時的信號轉導通路,特別是HIF-α介導的基因轉錄調控的研究取得了巨大進展。HIF-1可以上調血管系統相關蛋白的基因表達,如促進血管生成的VEGF及其受體的表達,這些基因的表達能夠誘導某些血管收縮因子的產生,如一氧化氮合酶(iNOS)ET-1和血紅素氧化酶1(HO-1)等,從而增加血流(王萍萍等,2011),為肌肉運動提供更多氧氣,延緩運動疲勞。
PI3K(phosphatidylinositide 3-kinases)是一種胞內磷脂酰肌醇激酶,由調節亞基p85和催化亞基p110構成,且與癌基因的產物相關。PI3K本身具有絲氨酸/蘇氨酸(Ser/Thr)激酶的活性,也具有磷脂酰肌醇激酶的活性。AKT又稱PKB(protein kinase B),是一種絲氨酸/蘇氨酸特異性蛋白激酶,在多種細胞生長過程中發揮關鍵作用,是PI3K重要的下游分子,包括至少3種形式,分別為AKT1、AKT2和AKT3。它們對于調控細胞的生長、增殖、遷移、存活以及糖代謝起到重要的作用,而且此信號通路只存在于經刺激后的個體(黃秀蘭等,2008),這就解釋了大鼠在熱預適應后,經此信號通路既可以調控肌肉細胞生長,又可增加糖代謝為機體提供能量,從而達到延緩疲勞的作用。
細胞外基質是組成間質和上皮血管中基質的不溶性結構成分,主要有膠原蛋白、彈性蛋白、蛋白多糖和糖蛋白等。研究表明,ECM可影響細胞分化、增殖、黏附、形態發生和表型表達等生物學過程。
已有研究發現,中樞性疲勞與腦內神經遞質分泌有關(曹慶雷等,2019;楊瑾,2013),了解熱預適應產生的新轉錄本與腦內神經遞質分泌有何關系,或許可以為延緩疲勞產生、研究預防措施和治療方法有一定的推動作用。有研究顯示,熱預適應可改善神經遞質、延緩運動性疲勞出現(王峰,2008)。雖然改變神經遞質的具體機制還不清楚,但實驗已證明,熱預適應對腦內神經遞質活動網絡造成了影響,使實驗體預先進入調節機制(鄧聰穎,2007)。而本研究的實驗結果表明,熱預適應也可通過外界環境造成的體液調節影響激素分泌,甚至造成新轉錄本的出現影響實驗體本身。但研究結果都表明,外界刺激使得實驗體產生了適應環境的改變。在轉錄組測序中,可變剪接需要用到已知的參考基因組序列和已經注釋的可變剪接事件(王正志等,2006),由于注釋基因組對可變剪接注釋不夠全面,因此所得結論和研究的深度并不能完全相符,隨著科學技術的進步及實驗研究的深入,研究結果也將不斷推進。
4 結論
本研究利用高通量測序技術對大鼠經熱預適應后的肌肉組織進行轉錄組測序和分析,探討了大鼠不同生理狀態下肌肉組織差異表達基因的數量,獲得了差異表達基因的功能、分類和代謝通路,為豐富大鼠經運動處理后肌肉組織轉錄組信息、探究熱預適應對基因轉錄組的影響以及揭示神經遞質在運動疲勞過程中的作用機制奠定了基礎。

