葉用萵苣LsMYB44基因的克隆及表達分析
趙盈盈,秦曉曉,韓瑩琰,郝敬虹,劉超杰,范雙喜
(北京農學院 植物科學技術學院/農業應用新技術北京市重點實驗室,北京102206)
葉用萵苣富含礦質元素、纖維素和生物活性物質,如葉酸(維生素 B9)、β-胡蘿卜素、葉黃素和抗氧化物[1],已成為最受歡迎的蔬菜之一,可用作沙拉配料或新鮮食用[2]。與綠葉生菜相比,紫葉生菜色澤鮮艷,花青素含量較高,具有抗氧化、抗心血管病、抗癌等保健功能,越來越受到市場青睞[3-5]。
光質對植物的次生代謝物的生物合成和積累影響較大[6],花色苷作為重要的次生代謝物,對人體具有保健功能。研究發現MYB轉錄因子參與黃酮類代謝途徑,影響植物色素的合成。在MYB家族中,R2R3MYB是最重要也是成員數最多,對黃酮類化合物合成影響最大的亞家族。近年來研究表明R2R3MYB的調控受外界因子,比如光的影響,來參與植物生長發育、代謝過程,響應生物和非生物脅迫,并參與植物激素合成和信號轉導[7]。例如,Hartmann[8]等發現CHS存在光響應元件(Light regulatory unit,LRU),同時也在LRU序列中發現了MYB識別元件(MYB recognition element,MRE),而R2R3MYB轉錄因子能夠與包含MRE元件的結構基因相互作用,這表明R2R3MYB參與了光介導的黃酮類物質的合成,但具體作用尚不明確。調控花色苷合成的MYB轉錄因子在果樹中研究較多,如草莓、蘋果、葡萄等[9-11],但在蔬菜尤其是紫葉生菜中的功能機制仍不清楚。
前期課題組對白光、紅光和藍光處理下的北紫生4號進行轉錄組測序,篩選出30個差異表達的轉錄因子。本研究根據轉錄組測序結果,篩選出在藍光處理下差異表達基因LsMYB44,克隆其全長,并對其進行生物信息學分析,通過熒光定量PCR,對其表達量進行分析,本研究為進一步解析紫葉生菜在不同光質下黃酮類化合物的合成機制提供參考。
1 材料與方法
1.1 試驗材料與處理
選用自主選育的品種北紫生4號(BZ-4)為試驗材料。將種子催芽12 h后播種于穴盤中,放置于人工氣候室內,白天溫度為22 ℃,晚上溫度為17 ℃,設定光強為270 μmol/m2/s,光照時間為14 h/d,相對濕度為70 %,長到3葉1心的時候定植。緩苗后放到HP600GS-3LED三色光植物培養箱中進行光質處理,其中以白光為對照,分別給予紅光、藍光、以及在白光基礎上添加紅藍光比例為2∶1、1∶1、1∶2的處理,處理30 d后取樣,-80 ℃保存。
1.2 試驗方法
1.2.1 樣品總RNA提取和反轉錄 使用北京華越洋生物科技有限公司RNA提取試劑盒提取葉用萵苣總RNA,使用北京全式金生物技術有限公司的TransScript? One-Step gDNA Removal and cDNA Synthesis SuperMix 反轉錄試劑盒合成第一鏈cDNA。
1.2.2 葉用萵苣LsMYB44基因克隆以及qRT-PCR 以轉錄組測序中的LsMYB44序列為模板,使用Primer5.0設計qRT-PCR引物和克隆引物,選用葉用萵苣18s作為內參基因(表1)。以葉用萵苣葉片cDNA為模板,對LsMYB44基因進行克隆。反應程序為95 ℃ 3 min;95 ℃ 15 s;58 ℃ 15 s;72 ℃ 24 s;72 ℃ 5 min,共35個循環。PCR產物進行凝膠電泳并用南京諾唯贊生物科技股份有限公司的DNA凝膠回收試劑盒回收目的條帶,連接到北京全式金生物技術有限公司的Peasy?-Blunt Zero Cloning Vector載體上,并將其導入大腸桿菌DH5α感受態細胞中,搖菌液后進行測序。以不同光質處理的葉用萵苣葉片cDNA為模板,在Bio-Rad CFX96實時熒光定量PCR儀上進行qRT-PCR。反應體系為20 μL,反應程序為95 ℃ 2 min;95 ℃ 5 s;60 ℃ 30 s,共39個循環。采用2-ΔΔCt相對定量方法計算出基因的相對表達量,并用SPSS20進行分析。
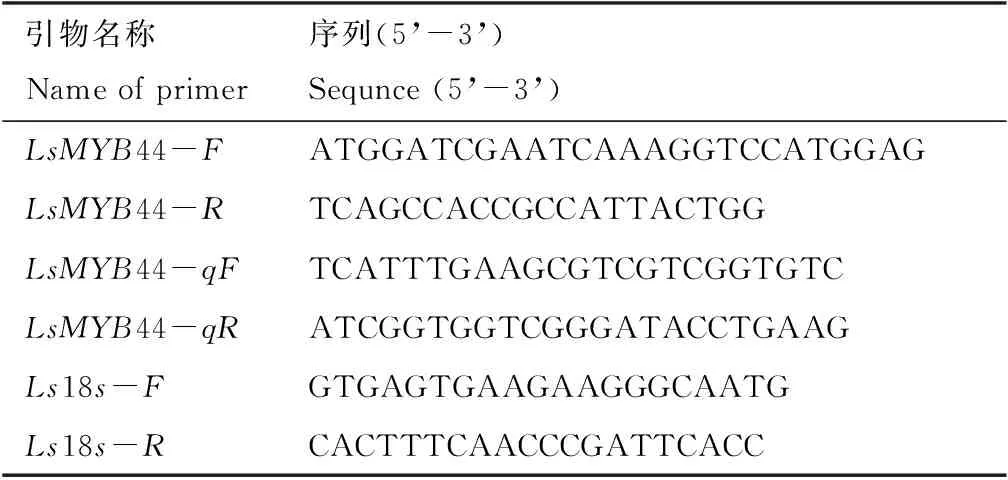
表1 引物序列Tab.1 Primer sequences
1.2.3 葉用萵苣LsMYB44序列的生物信息學分析 使用Prot Param分析LsMYB44蛋白質的各項參數;通過NCBI CD-Search分析LsMYB44蛋白的保守結構域;使用軟件MEGA7構建系統進化樹;運用SignalP 5.0進行信號肽預測;運用SOPMA對蛋白質的二級結構預測;SWISS-MODEL預測蛋白質的三維結構;利用Plant CARE軟件對LsMYB44基因啟動子序列上的順式作用元件預測分析。
2 結果與分析
2.1 葉用萵苣LsMYB44轉錄因子克隆
利用RT-PCR方法,克隆了北紫生4號中MYB44轉錄因子的編碼區(圖1),特異性擴增片段顯示在750~1 000 bp之間,片段大小符合預期,測序結果與已知參考基因組MYB44基因的序列一致性為100%,此基因的編碼區長為807 bp。運用NCBI ORFfinder 進行分析,發現該閱讀框編碼268個氨基酸,將該基因命名為LsMYB44。
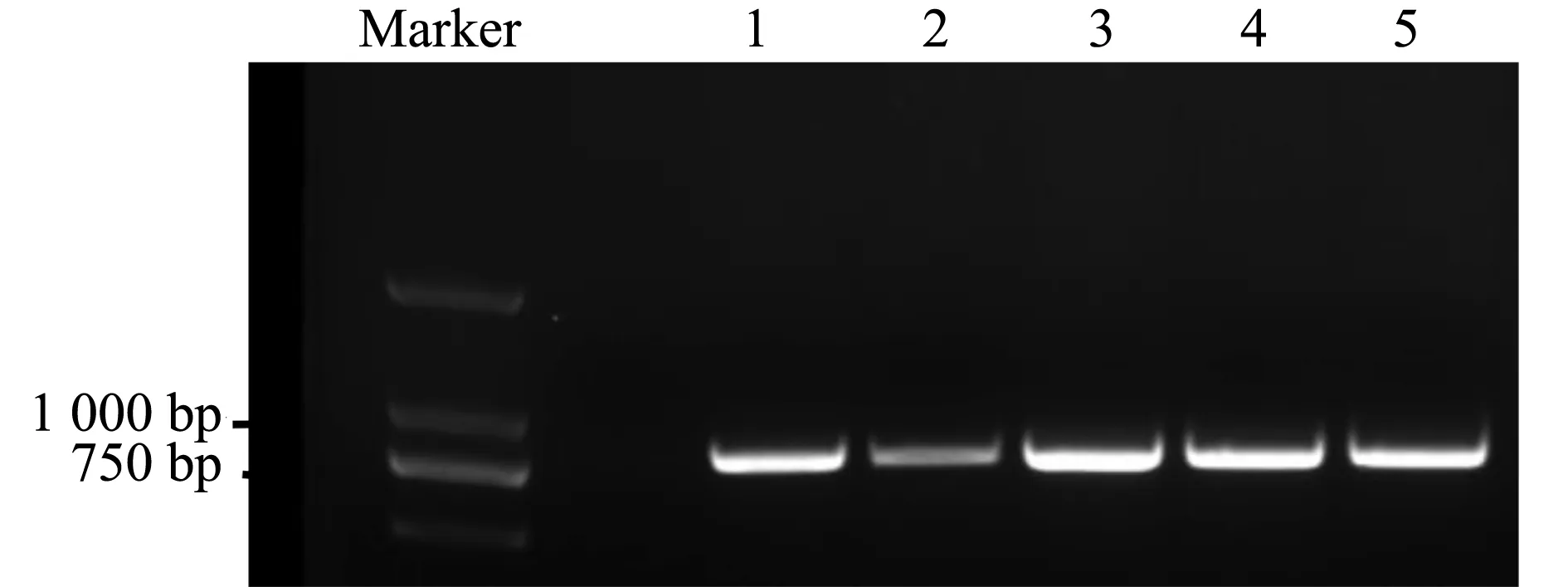
注:1、2、3、4、5分別為紅光,藍光,在白光基礎上添加比例為2∶1,1∶1和1∶2的處理Note: 1,2,3,4,5 refer to red light,blue light and white light with the addition ratio of 2∶1,1∶1 and 1∶2 respectively圖1 葉用萵苣LsMYB44基因的克隆Fig.1 Cloning ofLsMYB44 gene
2.2 葉用萵苣LsMYB44轉錄因子的生物信息學分析
2.2.1LsMYB44轉錄因子的保守結構域分析 通過NCBI在線工具Conservation Domain程序對轉錄因子進行基因保守結構域分析,結果發現生菜MYB44除了具有1個典型的MYB保守結構域,同時還含有2個SANT、1個PLN03212和REB1結構域,屬于R2R3-MYB家族成員(圖2)。
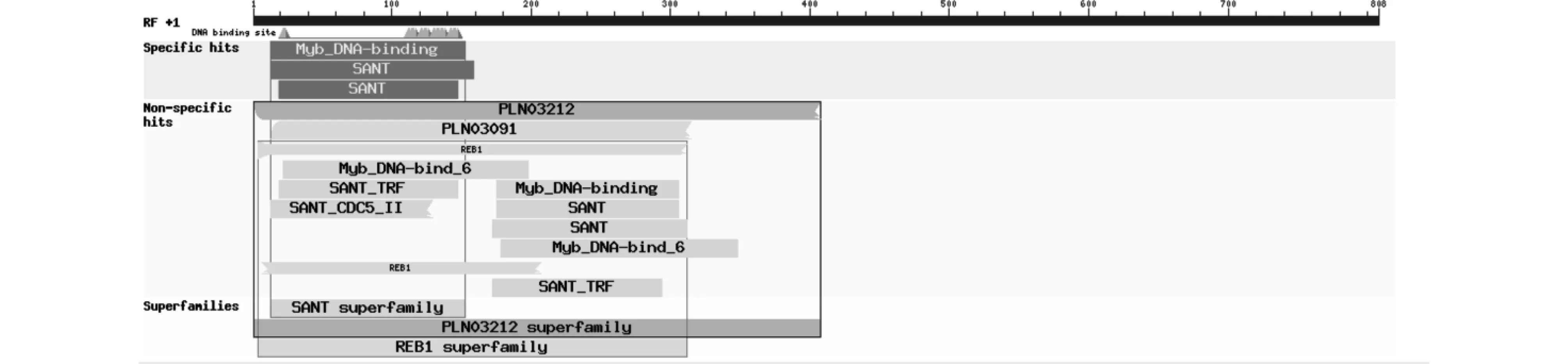
圖2 LsMYB44轉錄因子的保守結構域分析Fig.2 Conserved domain of LsMYB44 TF
2.2.2LsMYB44轉錄因子所編碼蛋白理化性質 運用ProtParam軟件對LsMYB44所編碼的氨基酸序列進行分析,結果表明LsMYB44蛋白的相對分子質量為29 341.14 Da,理論等電點為8.37。所編碼的氨基酸中,絲氨酸、脯氨酸、纈氨酸、丙氨酸和谷氨酸的含量較多,分別為13.1%、 10.4%、7.8%、7.1%、7.1%,色氨酸、半胱氨酸、酪氨酸的含量較少,分別為1.9%、1.5%和0.7%,帶負電的殘基總數(Asp+Glu)26個,帶正電的殘基總數(Arg+Lys)28個,不穩定指數為60.19,為不穩定蛋白。親水性平均值為-0.512,預測為親水性蛋白(圖3)。
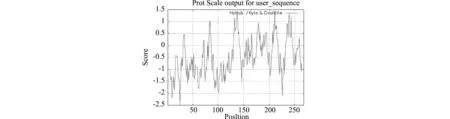
圖3 LsMYB44蛋白的理化性質Fig.3 Physical and chemical properties of LsMYB44 protein
2.2.3LsMYB44轉錄因子所編碼蛋白信號肽分析、跨膜預測及亞細胞定位 經SignalP 5.0分析,該蛋白無信號肽。所編碼的氨基酸也不在跨膜區,說明LsMYB44蛋白不含跨膜結構,不屬于分泌蛋白(圖4)。使用Psort軟件預測LsMYB44蛋白質的亞細胞定位,結果顯示該蛋白定位于細胞核。

圖4 LsMYB44蛋白的信號肽分析及跨膜預測Fig.4 Signal peptide analysis and transmembrane prediction of LsMYB44 protein
2.2.4LsMYB44轉錄因子所編碼蛋白二級及三級結構預測 二級結構預測顯示LsMYB44主要以無規則卷曲和α-螺旋為主,含少量的β折疊。其中無規則卷曲有170個氨基酸,占63.43%;有69個氨基酸組成α螺旋,占25.75%;延伸鏈有23個氨基酸,占8.58%;β折疊有6個氨基酸,占2.24%。同時利用Swiss Model 軟件對LsMYB44進行同源建模,推測該蛋白的三級結構(圖5)。
圖5 LsMYB44蛋白的二級、三級結構預測Fig.5 Secondary and tertiary structure prediction of LsMYB44 protein
2.3 葉用萵苣LsMYBB44轉錄因子的系統進化分析
將得到的LsMYB44的氨基酸序列在NCBI數據庫中進行比對,發現它與洋薊(XM_025121970 )、向日葵(XM_022159869)、薇甘菊( KAD0377770.1)等植物中的MYB44具有同源性。利用MEGA
7.0軟件來構建系統進化樹,發現葉用萵苣同洋薊的親緣關系最近,二者同為菊科屬植物,其次為向日葵。雷蒙德氏棉和木槿花為一類(圖6)。
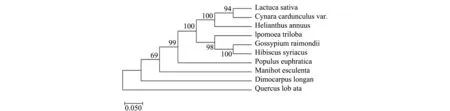
圖6 LsMYB44轉錄因子的系統進化樹Fig.6 Phylogenetic analysis of LsMYB44
2.4 葉用萵苣LsMYB44轉錄因子啟動子順式作用元件分析
利用Plant CARE軟件對轉錄組測序得到的LsMYB44基因啟動子序列上的順式作用元件預測分析,篩選保留有一定查看目的元件,發現了參與光反應的GT1-motif、I-box元件,參與MeJA反應的CGTCA-motif、TGACG-motif元件,參與生長素反應的TGA-element、AuxRR-core元件以及參與低溫反應的LTR元件等(表2)。結果表明LsMYB44與光響應、逆境脅迫以及激素響應等有關。

表2 LsMYB44基因啟動子順式作用元件分析Tab.2 Analysis of cis acting elements of LsMYB44 gene promoter
2.5 葉用萵苣LsMYB44基因表達分析
與對照組白光相比,單色光和復色光處理下LsMYB44基因的表達量均有所下降,但在藍光處理條件下下調了將近3倍(圖7),而前期研究表明在藍光處理下花色苷化合物是明顯增加的,這表明不同光質處理對LsMYB44基因的表達有影響,從而影響花色苷的合成,由此推測LsMYB44基因在不同光質處理下葉用萵苣花色苷合成中發揮負調節作用。
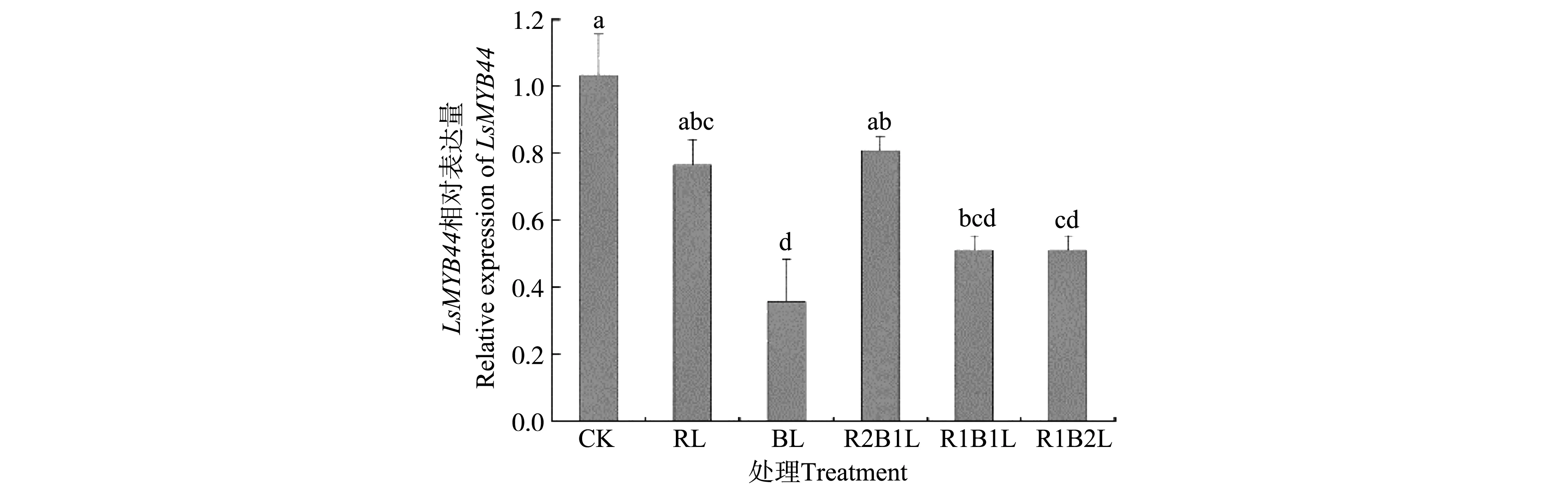
注:CK,RL,BL,R2B1L,R1B1L,R1B2L分別表示白光,紅光,藍光,紅光和藍光的比分別為2∶1,1∶1,1∶2Note:CK,RL,BL,R2B1L,R1B1L,R1B2L represent white light、red light、blue light、red light and blue:light is 2∶1,1∶1 and 1∶2 respectively圖7 LsMYB44基因在不同光質處理下的表達量分析Fig.7 Expression analysis of LsMYB44 gene under different light quality treatments
3 結論和討論
光質對次生代謝物的產生具有重要影響,而次生代謝物的含量影響食物的品質特性。MYB轉錄因子是植物中最大的轉錄因子家族之一,研究表明MYB轉錄因子在苯丙烷類次生代謝過程中發揮著重要作用[12]。根據MYB轉錄因子的MYB-DNA結合域的特點可分為1R-MYB,R2R3-MYB,3R-MYB和4R-MYB四個亞族,而R2R3-MYB轉錄因子作為數量最多的MYB家族之一,在調控次生代謝和逆境脅迫等方面發揮著重要作用[13-14]。MYB44是典型的R2R3-MYB家族轉錄因子,具有保守的結構基因,現研究表明,MYB44廣泛參與植物激素信號傳導途徑、病蟲害防御、機械損傷和環境脅迫的響應,具有重要的生物學意義[15]。
本研究通過轉錄組數據,篩選出MYB44基因,克隆得到cDNA序列807bp,編碼268個氨基酸,命名為LsMYB44。LsMYB44蛋白的相對分子量為29.341kDa,等電點為8.37,偏堿性。平均親水數-0.512,不穩定系數為60.19,屬于不穩定蛋白。具有1個典型的MYB保守結構域,同時還含有2個SANT、1個PLN03212和REB1結構域。將LsMYB44的氨基酸序列在NCBI數據庫中進行比對,發現它與洋薊、向日葵、薇甘菊等植物中的MYB44具有同源性。對LsMYB44基因啟動子上的順式作用元件分析表明與光響應、激素和逆境脅迫有關。實時熒光定量PCR分析顯示,LsMYB44基因在藍光處理下明顯下調,而我們前期的研究表明藍光處理下紫葉生菜花色苷是明顯增加的。在馬鈴薯中也發現了類似的結果,高溫通過增強MYB44的表達顯著降低了塊莖花青素色素含量[16]。表明LsMYB44可能在不同光質(包括藍光)處理下負調控紫葉花色苷的生成,但具體作用機制還有待研究。

