血清TGF-β1、Apelin、CYP19A1水平與PCOS內分泌異常間的關系分析
蔡玉,刁海丹
(大連市第三人民醫院婦科,大連 116033)
多囊卵巢綜合征(PCOS)是造成育齡女性不孕的常見臨床病因[1-2]。目前PCOS尚無特異性治療方式,疾病致病機制也尚不清楚[3-4]。有研究數據表示,PCOS患者血清炎癥因子水平異常升高,推測炎癥反應可能推動PCOS發展[5-6]。轉化生長因子-β1(TGF-β1)是常見的炎癥因子,同時參與了卵泡的生長發育[7]。Apelin是一種多肽物質,廣泛分布在人體多種組織及器官內,能抑制胰島素分泌[8]。雄性激素分泌水平過高是PCOS的主要病理特征之一,而細胞色素P450 19A1(aromatase,CYP19A1)參與了雄性激素的分泌及代謝過程[9]。研究PCOS患者血清CYP19A1水平與內分泌之間的關系,有助于疾病機制的探究。本文就血清TGF-β1、Apelin、CYP19A1與PCOS的關系進行研究,以期為PCOS的診斷、發病機制提供參考依據。
資料與方法
一、研究對象
將大連市第三人民醫院婦科2018年1月至2021年1月期間收治的育齡期PCOS患者納為PCOS組。
PCOS患者符合中華醫學會婦產科學分會內分泌學組《多囊卵巢綜合征的診斷和治療專家共識》[10]中相關診斷標準,即:(1)無排卵或稀發排卵;(2)雄激素水平升高或(和)高雄激素血癥;(3)B超下檢測提示卵巢多囊性改變。符合以上三條中任意兩條,并排除合并分泌雄性激素腫瘤等其他因素所致的雄性激素升高者,即可確診。
篩選同期健康體檢合格的同齡、月經周期規律、卵巢儲備功能正常、無內分泌疾病及自身免疫性疾病的健康育齡女性為對照組。
兩組排除標準:排除子宮及卵巢器質性病變者、卵巢儲備功能下降或卵巢早衰者、輸卵管積水者、合并其他急慢性疾病者。
本研究經醫院倫理委員會批準,參與者知情且同意(倫理批號:201706257)。
二、方法
1.內分泌及代謝指標檢測:包括血清基礎性激素指標[基礎促黃體生成素(bLH),基礎促卵泡激素(bFSH),基礎睪酮(bT),基礎泌乳素(bPRL)和基礎雌二醇(bE2)],空腹血糖(FPG)、空腹胰島素水平(FINS),胰島素抵抗指數(HOMA-IR)、血脂[膽固醇(TG)、三脂甘油(TC)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)]。測量患者身高體重,計算體質量指數(BMI)。對于月經規律以及月經稀發者,血清基礎性激素檢查時間為孕激素撤退出血第2~5天,閉經者可在任意時間檢查。采集被研究者清晨空腹靜脈血,采用化學發光法檢測基礎性激素水平。FPG及FINS水平檢測分別采用口服葡萄糖耐量試驗(OGTT)以及胰島素釋放試驗(IRT)檢驗。HOMA-IR=FPG(mmol/L)×FINS(mIU/L)/22.5。脂質代謝指標于月經周期任意時間進行,采用化學免疫分析儀進行檢測。
2.血清TGF-β1、Apelin、CYP19A1水平檢測:采集外周靜脈血6 ml,3 000 r/min快速離心15 min,分離上層血清,均分為3份,分別用于檢測血清TGF-β1、Apelin、CYP19A1水平。TGF-β1采用酶聯免疫吸附法(ELISA)檢測,試劑盒購自武漢純度生物科技有限公司。Apelin采用發射免疫法檢測,試劑盒購自美國Phoneix Pharmaceutical公司。CYP19A1采用ELISA法檢測,試劑盒購自武漢華聯科生物技術有限公司。
3.分組:根據PCOS組患者是否滿足血清T水平≥2.64 nmol/L,或滿足雄激素性脫發、痤瘡、多毛中任何一項分為高雄激素/非高雄激素亞組;根據2007年中國成人血脂代謝異常防控指南[11]中相關標準,滿足以下4項中任意一項既可診斷為血脂代謝異常:TG≥6.22 mol/L、TC≥2.27 mmol/L、LDL-C≥4.14 mmol/L、HDL-C<1.04 mmol/L,將PCOS組患者分為脂質代謝正常/異常亞組;根據是否滿足BMI≥25 kg/m2,將PCOS組患者分為肥胖/非肥胖亞組;根據是否滿足HOMA-IR≥2.69,將PCOS組患者分為胰島素抵抗(IR)/非胰島素抵抗(NIR)亞組。
三、統計學方法

結 果
一、PCOS組與對照組一般情況、基礎內分泌及代謝情況比較
PCOS組患者年齡為(28.41±3.15)歲,BMI為(22.69±4.03)kg/m2;對照組年齡為(29.11±3.36)歲,BMI為(22.41±3.37)kg/m2;兩組間年齡及BMI無顯著性差異(P>0.05)。
但PCOS組的bLH、bLH/FSH、bT、FINS、HOMA-IR、TC、TG、LDL-C均顯著高于對照組(P<0.05),bFSH水平顯著低于對照組(P<0.05),兩組間bPRL、bE2、FPG以及HDL-C水平無顯著性差異(P>0.05)(表1)。
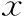
表1 PCOS組與對照組基礎內分泌及代謝情況比較(-±s)
二、PCOS組與對照組血清TGF-β1、Apelin、CYP19A1水平比較
PCOS組血清TGF-β1、Apelin、CYP19A1水平均顯著高于對照組(P<0.05)(表2)。
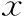
表2 PCOS組與對照組血清TGF-β1、Apelin、CYP19A1水平比較(-±s)
三、PCOS患者各亞組間血清TGF-β1、Apelin、CYP19A1水平比較
1.高雄激素與非高雄激素亞組:高雄激素亞組血清CYP19A1水平顯著高于非高雄激素亞組(P<0.05);兩組間血清TGF-β1、Apelin水平無顯著性差異(P>0.05)(表3)。
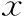
表3 高雄激素與非高雄激素亞組血清TGF-β1、Apelin、CYP19A1水平比較(-±s)
2.脂質代謝正常與異常亞組:脂質代謝異常亞組血清TGF-β1水平顯著高于脂質代謝正常亞組(P<0.05);兩組間血清Apelin、CYP19A1水平無顯著性差異(P>0.05)(表4)。
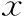
表4 脂質代謝正常與脂質代謝異常亞組血清TGF-β1、Apelin、CYP19A1水平比較(-±s)
3.肥胖與非肥胖亞組:肥胖亞組血清TGF-β1、Apelin水平均顯著高于非肥胖亞組(P<0.05);兩組血清CYP19A1水平無顯著性差異(P>0.05)(表5)。
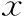
表5 肥胖與非肥胖亞組血清TGF-β1、Apelin、CYP19A1水平比較(-±s)
4.IR與NIR亞組:IR亞組血清TGF-β1、Apelin水平均顯著高于NIR亞組(P<0.05);兩組間血清CYP19A1水平無顯著性差異(P>0.05)(表6)。
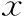
表6 IR與NIR亞組血清TGF-β1、Apelin、CYP19A1水平比較(-±s)
四、PCOS患者血清TGF-β1、Apelin、CYP19A1水平之間的相關性分析
Pearson相關性分析提示,PCOS患者血清CYP19A1與TGF-β1、Apelin均呈弱正相關(P<0.05),但TGF-β1與Apelin之間無顯著相關性(P>0.05)(表7)。

表7 PCOS患者血清TGF-β1、Apelin、CYP19A1水平之間的相關性分析
討 論
PCOS不僅會引起排卵障礙、月經不調等生殖問題,患者所存在的內分泌障礙也逐漸獲得臨床關注。本研究將80例PCOS患者與70例健康同齡孕齡女性進行對比,結果發現,PCOS組bLH、bLH/FSH、bT、FINS、HOMA-OR、TC、TG、LDL-C水平均顯著高于對照組,bFSH水平顯著低于健康對照組。提示PCOS患者在性激素、糖代謝、脂代謝、IR等多個方面呈現異常。有研究表示,PCOS患者出現肥胖、IR、脂代謝紊亂等內分泌異常問題的概率遠高于正常同齡女性[12]。PCOS不僅僅影響到患者的生殖健康,還影響到患者內分泌。
TGF-β1主要表達在初級卵泡卵母細胞、顆粒細胞等,Ewens等[13]研究發現,TGF-β1等位基因的表達情況與PCOS伴IR患者間存在相關性。同時TGF-β1也是常見的炎癥因子,參與各種急慢性炎癥疾病的發展。本文研究發現,PCOS組患者血清TGF-β1水平顯著高于健康對照組,且在脂質代謝異常、肥胖以及存在IR的PCOS患者中的水平均高于其對照亞組,提示血清TGF-β1與PCOS患者肥胖、脂質代謝紊亂以及IR等內分泌紊亂情況具有相關性。
Apelin是孤獨G蛋白偶聯受體APJ受體的內源性配體,能調節免疫與胰島素分泌,參與了高血壓、心臟病等心血管疾病的發生與發展。有研究表示,Apelin與脂聯素的性質相似,能參與脂質代謝,并證實Apelin可通過PKC以及PI3K途徑直接調節胰島素[14]。本研究發現,PCOS組患者血清Apelin水平顯著高于健康對照組,且伴有肥胖以及IR的PCOS患者血清Apelin水平也顯著高于其對照亞組,提示血清Apelin可能參與PCOS患者肥胖以及IR進程。
臨床數據顯示,大概有50%~70%的PCOS患者存在高雄激素血癥,高雄激素血癥與IR之間關系緊密,IR可通過多種途徑促進高雄激素血癥,而高雄激素血癥又能通過正反饋作用,增加血清T水平含量,提高雙氫睪酮釋放量,提高LH/FSH比值,加重激素代謝紊亂[15-16]。CYP19A1基因參與雄激素代謝,其多態性與高雄激素血癥間存在密切聯系。本研究發現,PCOS患者血清CYP19A1水平顯著高于健康對照組,且存在高雄激素血癥的PCOS患者血清CYP19A1含量顯著高于其對照亞組,提示CYP19A1參與了PCOS高雄激素血癥;但未發現血清CYP19A1與肥胖、脂質代謝紊亂以及IR之間的關系。
此外,本研究進行Pearson相關性分析發現,PCOS患者血清CYP19A1與TGF-β1及Apelin均呈弱正相關,提示CYP19A1與TGF-β1及Apelin之間可能還存在相互作用機制,共同參與PCOS發生及進展。
綜上所述,我們的研究發現,血清TGF-β1與PCOS患者肥胖、脂質代謝紊亂以及IR之間存在相關性,血清Apelin與PCOS患者肥胖以及IR之間存在相關性,血清CYP19A1與PCOS患者高雄激素血癥間存在相關性。這些結果表明,血清TGF-β1、Apelin、CYP19A1與PCOS內分泌紊亂間存在密切聯系。限于研究條件,本研究并未對各指標在引起PCOS內分泌紊亂中的具體機制進行研究,但可作為下一步研究的方向。

