發(fā)酵小米工藝優(yōu)化及其體外抗氧化活性研究
葛迎港,趙博凱,王曉聞
(山西農(nóng)業(yè)大學(xué) 食品科學(xué)與工程學(xué)院,山西 晉中 030801)
0 引言
納豆是一種源于中國的天然發(fā)酵食品,是大豆經(jīng)過納豆芽孢桿菌發(fā)酵而成的健康食品,許多研究表明,在發(fā)酵的納豆中具有很多生理調(diào)節(jié)功能[1],如溶血栓、降血壓、抗菌、預(yù)防骨質(zhì)疏松、調(diào)節(jié)腸道菌群平衡等。在發(fā)酵過程中產(chǎn)生的納豆激酶,具有凝血、激活人體血栓溶解系統(tǒng)的功能[2],有研究表明其提取物能顯著緩解高果糖誘導(dǎo)的葡萄糖不耐受癥、高胰島素血癥和血脂障礙等生理疾病[3]。
小米是一種優(yōu)質(zhì)的雜糧資源,其蛋白質(zhì)含量在11.43%~13.72%,氨基酸含量豐富[4];因其高膳食纖維、低血糖生成指數(shù)(GI) 的特性被廣泛應(yīng)用于健康食品的開發(fā)中[5-6];又因其抗干旱、產(chǎn)量高、容易管理的特性被廣泛種植。在國外有食用發(fā)酵的習(xí)慣,如小米稠粥、塞拉米,這些都是通過微生物發(fā)酵小米來達(dá)到改善小米的口感和風(fēng)味的目的[7]。在國內(nèi),通過對發(fā)酵小米糠[8-9]和酶解小米分離蛋白[10]來獲得的抗氧化多肽;同時(shí),也有依托地區(qū)特色食品為藍(lán)本利用乳酸菌來發(fā)酵小米,分離具有抗菌活性的多肽[7]。在食品加工中氧化是一個(gè)影響食品品質(zhì)的重要過程,其對食品的營養(yǎng)、風(fēng)味、結(jié)構(gòu)、安全都有重要影響[11-12],在氧化過程中產(chǎn)生的自由基與人體細(xì)胞損傷密切相關(guān)[13]。體外評價(jià)抗氧化能力化學(xué)指標(biāo)法和細(xì)胞試驗(yàn)法,化學(xué)指標(biāo)法因具有快速方便、成本低的特征,被廣泛應(yīng)用于初期的抗氧化研究。測試方法有自由基清除法、氧化還原法和脂質(zhì)過氧化抑制法。通過對不同條件下發(fā)酵小米中抗氧化活性和蛋白質(zhì)含量變化,為發(fā)酵小米的提取抗氧化物質(zhì)提取提供理論依據(jù)。
1 材料與方法
1.1 材料與設(shè)備
1.1.1 材料
東方亮1 號小米,山西東方亮生命科技股份公司提供;黑豆,忻州市匯豐糧業(yè)有限公司提供;小米分離蛋白,實(shí)驗(yàn)室堿溶酸沉自提。
1.1.2 試劑
牛血清白蛋白(BR)、考馬斯亮藍(lán)G-250(BR)、大豆分離蛋白(BR)、22 - 二- 1 - 苦肼基自由基(BR)、SDS(BR)、ABTS(BR),北京索萊寶科技有限公司提供;其他試劑為分析純。
1.1.3 試驗(yàn)設(shè)備及儀器
UV-1100 型紫外分光光度計(jì)、SW-CJ-2FD 型雙人單面凈化工作臺、SB25-12DTDN 型超聲波清洗機(jī)、HH·B11·420-BY 型恒溫培養(yǎng)箱、DGL-50GL 型立式蒸汽滅菌器、迷你離心機(jī)、ST-3100 型pH 計(jì)。
1.2 試驗(yàn)方法
1.2.1 發(fā)酵劑制作
將15 g 黑豆用80 mL 蒸餾水浸泡12 h,煮沸20 min,在超凈工作臺中,用滅菌的紗布過濾,將黑豆置于100 mL 滅菌的燒杯中用8 層紗布和1 層扎孔的牛皮紙密封,在常溫下避光發(fā)酵,每8 h 補(bǔ)充2 mL 的無菌水并搖動通氣,待大豆表面生成大量乳白色黏稠物質(zhì)時(shí)停止培養(yǎng)。
1.2.2 菌懸液的制備
將1.5 g 小米分離蛋白、0.05 g 氯化鈉、0.25 g 葡萄糖和50 mL 蒸餾水混勻加入200 mL 錐形瓶中,6 層紗布密封。于121 ℃下滅菌15 min,再經(jīng)超聲處理10 min,向上述發(fā)酵黑豆中加入10 mL 無菌水,搖勻轉(zhuǎn)移到小米蛋白培養(yǎng)基,于37.6 ℃下以轉(zhuǎn)速180 r/min培養(yǎng)24 h,冷藏保存,每15 d 傳代培養(yǎng)1 次[14]。
1.2.3 固態(tài)發(fā)酵
將5.0 g 小米浸泡12 h,然后與0.01 g 磷酸氫二鉀、0.3 g 大豆分離蛋白、5 mL 蒸餾水混勻,高壓滅菌完成的固態(tài)培養(yǎng)基置于超凈工作臺,先加入適量無菌水,保持基質(zhì)含水量在60%左右,用無菌玻璃棒把結(jié)塊的小米充分?jǐn)囁椋瑩u勻接入菌懸液。接種時(shí)保證菌懸液與無菌水共3 mL,然后在恒溫培養(yǎng)箱中培養(yǎng),每12 h 用2 mL 無菌水潤濕紗布并搖動錐形瓶通氣。
1.2.4 小米發(fā)酵單因素試驗(yàn)
在溫度37 ℃,接種量6%,pH 值7 條件下發(fā)酵24 h,以提取液中蛋白和清除自由基能力作為指標(biāo),研究最佳發(fā)酵條件。分別研究發(fā)酵時(shí)間為0,12,24,36,48 h;發(fā)酵溫度為31,33,35,37,39 ℃;基質(zhì)pH 值為5,6,7,8,9;接種量為0,3%,6%,9%,12%對發(fā)酵的影響。每組試驗(yàn)重復(fù)3 次,取平均值。
1.2.5 正交試驗(yàn)
在單因素試驗(yàn)的基礎(chǔ)上以發(fā)酵溫度、發(fā)酵時(shí)間、初始pH 值和接種量4 個(gè)因素,進(jìn)行四因素三水平正交試驗(yàn),利用綜合平衡法對2 個(gè)指標(biāo)進(jìn)行分析篩選最佳發(fā)酵條件。
1.2.6 不同時(shí)間下發(fā)酵對照試驗(yàn)
在最優(yōu)解的基礎(chǔ)上測試不同時(shí)間0,12,24,36,48 h 下接種與未接種小米基質(zhì)抗氧化能力變化。
1.2.7 蛋白含量的計(jì)算
(1) 標(biāo)準(zhǔn)曲線制作。參照文獻(xiàn)[15-16]的方法,稍作改進(jìn)。取6 支試管分別加入0,0.2,0.4,0.6,0.8,1.0 mL 的0.1 mg/mL 牛血清蛋白,用鹽酸-氯化鈉緩沖液補(bǔ)足2 mL,加入用95%乙醇溶解的考馬斯亮藍(lán)緩沖液3 mL,搖勻在遮光處靜置5 min,用紫外分光光度計(jì)在波長595 nm 處測定吸光度,以質(zhì)量濃度為橫坐標(biāo)、吸光度為縱坐標(biāo)繪制標(biāo)準(zhǔn)曲線。
(2) 上清液中蛋白含量測定。隨機(jī)多次取樣1.000 g 的發(fā)酵基質(zhì)于研缽中加入4 ℃下保存的緩沖液(鹽酸—氯化鈉) 8 mL,充分研磨,在低速離心機(jī)中以轉(zhuǎn)速5 000 r/mim 離心20 min,取上清液用0.22 μm 濾膜(天津·津騰) 過濾得提取液α。在離心管中分別加入0.5 mL 提取液α,1.5 mL 的緩沖液,3 mL 考馬斯亮藍(lán)溶液充分搖勻,避光反應(yīng)5 min,以不含提取液α 的混合液調(diào)零,在波長595 nm 處快速測定其吸光度,以相關(guān)變量為橫坐標(biāo)、基質(zhì)中蛋白含量為縱坐標(biāo)作圖。
1.2.8 抗氧化能力的測定
(1) DPPH 自由基清除能力測定。隨機(jī)多次取樣1.000 g 發(fā)酵基質(zhì),加入蒸餾水8 mL 充分研磨,在100 ℃下滅酶10 min,低速離心機(jī)以轉(zhuǎn)速5 000 r/mim離心20 min,取上清液用0.22 μm 濾膜過濾得提取液β。參照文獻(xiàn)[17]中方法稍作修改,將提取液β 0.4 mL 和濃度為0.2 mmol/L 的DPPH 溶液0.6 mL 加入離心管,然后在振蕩器上快速振蕩搖勻,以轉(zhuǎn)速為7 000 r/mim 離心1 min,在37 ℃下恒溫、避光反應(yīng)30 min,將反應(yīng)完成的混合液加入石英狹縫比色皿中,用紫外分光光度計(jì)于波長517 nm 處測定各吸光度。以變量為橫坐標(biāo)、清除率為縱坐標(biāo)作圖。計(jì)算公式如下:
式中:A樣——加入樣品吸光度;
A對——用等量蒸餾水代替提取液β 的吸光度;
A空——用無水乙醇取代DPPH 溶液。

(2) ABTS 自由基清除能力測定。參照Lin Zheng 等人[18]的方法,稍作修改。將7 mmol ABTS 溶解在蒸餾水中并于2.45 mmol 的過硫酸鉀混合。使混合物在黑暗中靜置16 h 產(chǎn)生ABTS 自由基。然后用50 mmol/L,pH 值7.4 的PBS 溶液進(jìn)行稀釋,稀釋到吸光值為0.70±0.02,蒸餾水調(diào)零。然后取提取液β 0.1 mL與ABTS 稀釋液1.9 mL,混合搖勻在黑暗中反應(yīng)30 min,反應(yīng)完成后加入石英狹縫比色皿在波長734 nm 處測定吸光度。

式中:A樣——加入樣品吸光度;
A對——用等量蒸餾水代替提取液β 的吸光度;
A空——用PBS 溶液取代ABTS 稀釋液。
(3) 總還原力的測定。參照Kadriye I B 等人[19]改良后的鐵氰化鉀法測定總還原力稍作修改。依次向試管中加入提取液β 0.5 mL,H2O 0.5 mL,1 mol/L HCl 0.75 mL,鐵氰化物溶液(1%,M/V) 0.75 mL,SDS(1%,M/V) 0.25 mL,F(xiàn)eCl3·6H2O 溶液(0.2%,M/V) 0.25 mL 混合搖勻,將混合物在50 ℃水浴20 min,冷卻至室溫,反應(yīng)完成后加入普通比色皿中,于波長750 nm 處測定吸光度,用蒸餾水取代提取液調(diào)零。
1.2.9 感官分析
分別從顏色、黏連性、顆粒完整程度、氣味、硬度方面對不同時(shí)間下接種與未接種的小米進(jìn)行感官分析。
1.2.10 數(shù)據(jù)處理
使用SPSS 25 進(jìn)行顯著性差異分析,使用Excel 2019 整合試驗(yàn)數(shù)據(jù)和作圖。
2 結(jié)果與分析
2.1 標(biāo)準(zhǔn)曲線制作
牛血清蛋白標(biāo)準(zhǔn)曲線見圖1。

圖1 牛血清蛋白標(biāo)準(zhǔn)曲線
由圖1 可知,其線性曲線為Y=0.5959X+0.010 6,R2=0.995 2 在一定質(zhì)量濃度范圍內(nèi)有較好的線性關(guān)系。
2.2 小米發(fā)酵單因素結(jié)果分析
2.2.1 發(fā)酵時(shí)間對小米發(fā)酵的影響
發(fā)酵時(shí)間對蛋白含量與DPPH 自由基清除率的影響見圖2。

圖2 發(fā)酵時(shí)間對蛋白含量與DPPH 自由基清除率的影響
由圖2 可知,隨著發(fā)酵時(shí)間的延長,蛋白含量與DPPH 自由基清除率呈現(xiàn)先上升后下降的趨勢,其原因可能是細(xì)菌分泌胞外酶破壞了小米的細(xì)胞壁,使一部分蛋白被釋放出來,同時(shí)分泌的蛋白酶水解大分子的蛋白質(zhì)和改善蛋白質(zhì)疏水特性。Shuang Yang 等人[20]在利用蛹蟲草發(fā)酵玉米醇溶蛋白發(fā)現(xiàn)發(fā)酵能顯著改善醇溶蛋白的溶解特性。在Haicheng Yin 等人[21]的研究中納豆菌在0~8 h 內(nèi)釋放蛋白酶,其后以羧基肽酶為主。在延莎等人[22],B.R.Veenashri 等人[23]的研究中小米本身的酚類和多糖具有較好的抗氧化能力。發(fā)酵米糠[8]、板栗[24]、豆粕[25]的研究中表明,時(shí)間是影響發(fā)酵產(chǎn)物的關(guān)鍵因素。在培養(yǎng)12 h 時(shí)其蛋白含量與其他組具有顯著差異(p<0.05),但是其抗氧化水平顯著低于24 h(p<0.05),表明其在短時(shí)間內(nèi)其分泌的胞外酶不能徹底水解大分子物質(zhì)。因此,認(rèn)為發(fā)酵時(shí)間為24 h 比較合適的發(fā)酵時(shí)間。
2.2.2 接種量對發(fā)酵小米的影響
接種量對蛋白含量與DPPH 自由基清除率的影響見圖3。
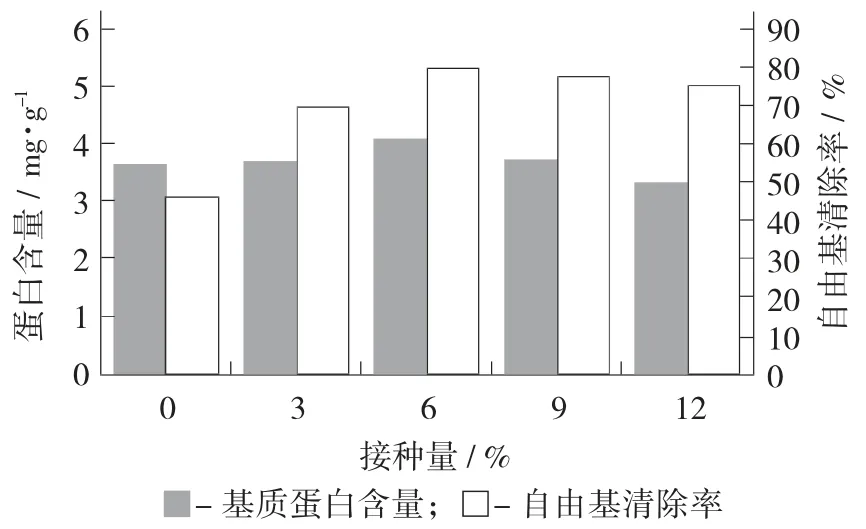
圖3 接種量對蛋白含量與DPPH 自由基清除率的影響
接種量主要是在前期影響發(fā)酵進(jìn)程,在細(xì)菌的對數(shù)生長期,過多接種會導(dǎo)致容器氧氣量供應(yīng)不足,影響細(xì)菌生長。接種量過少使基質(zhì)中的酶過少不能有效地水解其中大分子物質(zhì),改善基質(zhì)的抗氧化能力。由圖3 可知,在接種量為6%時(shí)其蛋白含量與其他組有顯著差異(p<0.05),DPPH 自由基清除能力也顯著(p<0.05) 高于接種量為0%,3%的基質(zhì)提取液,表明在24 h 內(nèi)發(fā)酵接種量對基質(zhì)中大分子物質(zhì)分解有較大影響,這與鄺嘉華等人[26]、王鑾[27]報(bào)道結(jié)果一致。因此,接種量6%為適宜的發(fā)酵條件。
2.2.3 基質(zhì)pH 值對發(fā)酵小米的影響
基質(zhì)pH 值對蛋白含量與DPPH 自由基清除率的影響見圖4。
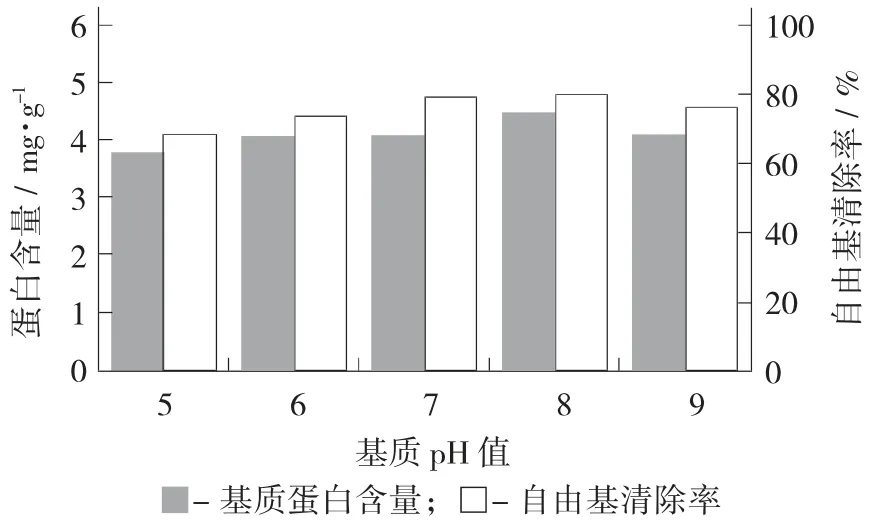
圖4 基質(zhì)pH 值對蛋白含量與DPPH 自由基清除率的影響
由圖4 可知,在基質(zhì)pH 值8 時(shí),其蛋白含量和抗氧化能力要高于中性條件,可能的原因是在微堿性的條件下,有利于蛋白溶出,方便細(xì)菌借助基質(zhì)中氮源快速生長;當(dāng)基質(zhì)pH 值>8 時(shí),其堿性環(huán)境開始抑制細(xì)菌的生長,使其生長和酶的分泌受到抑制。在基質(zhì)pH 值5 時(shí)基質(zhì)蛋白含量顯著(p<0.05)低于弱堿性下蛋白含量。在酸性的條件下,H+會與蛋白質(zhì)表面電子結(jié)合,降低其溶解特性。一些研究表明,培養(yǎng)基pH 值會影響營養(yǎng)成分的運(yùn)輸,如葡萄糖和氮源[25]。在張建萍等人[28]的研究中,pH 值4.5 即可沉淀獲取小米蛋白。因此,認(rèn)為基質(zhì)pH 值8 是最佳發(fā)酵條件。
2.2.4 發(fā)酵溫度發(fā)酵小米的影響
發(fā)酵溫度對蛋白含量與DPPH 自由基清除率的影響圖5。

圖5 發(fā)酵溫度對蛋白含量與DPPH 自由基清除率的影響
在微生物的生長發(fā)育中,主要依靠酶和其相關(guān)的催化反應(yīng)進(jìn)行新陳代謝,而酶的催化活性由溫度決定[20]。由圖5 可知,隨著發(fā)酵溫度上升,基質(zhì)抗氧化能力呈現(xiàn)先上升后下降的趨勢,在低溫和高溫的條件下細(xì)菌的生長受到抑制,同時(shí)低溫也會抑制胞外酶的活性,高溫會影響酶的結(jié)構(gòu)和改變基因的表達(dá)。在37 ℃培養(yǎng)條件下蛋白含量和自由基清除能力顯著(p<0.05) 高于低溫條件培養(yǎng)。在39 ℃條件培養(yǎng)與37 ℃并無顯著(p>0.05) 差異。因此,選用37 ℃為最佳發(fā)酵條件。
2.3 發(fā)酵正交結(jié)果分析
在單因素試驗(yàn)最佳結(jié)果的基礎(chǔ)對發(fā)酵溫度、發(fā)酵時(shí)間、基質(zhì)pH 值和接種量進(jìn)行四因素三水平正交試驗(yàn),進(jìn)一步探究這些因素對抗氧化活性物質(zhì)的影響。
固態(tài)發(fā)酵正交因素水平見表1,固態(tài)發(fā)酵正交試驗(yàn)設(shè)計(jì)與結(jié)果見表2,固態(tài)發(fā)酵正交試驗(yàn)設(shè)計(jì)方差分析見表3。

表1 固態(tài)發(fā)酵正交因素水平

表2 固態(tài)發(fā)酵正交試驗(yàn)設(shè)計(jì)與結(jié)果
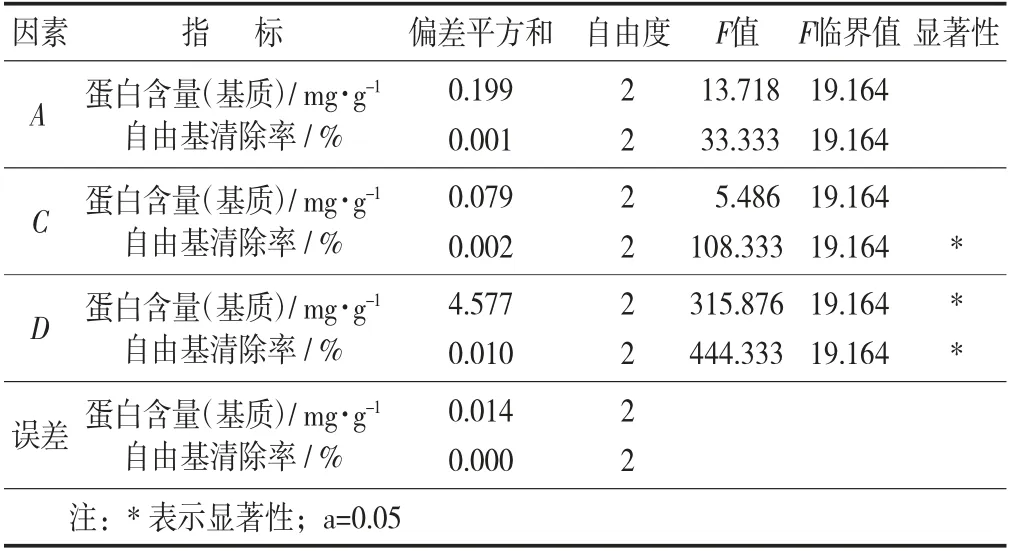
表3 固態(tài)發(fā)酵正交試驗(yàn)設(shè)計(jì)方差分析
由表2 可知,發(fā)酵時(shí)間對基質(zhì)蛋白含量與自由基清除能力影響最大。對基質(zhì)蛋白含量影響因素依次為發(fā)酵時(shí)間、發(fā)酵溫度、接種量、基質(zhì)pH 值,即D>A>C>B。其均值的最大項(xiàng)為其最優(yōu)解。對于基質(zhì)清除自由基能力影響依次因素為發(fā)酵時(shí)間、接種量、發(fā)酵溫度、基質(zhì)pH 值,即D>C>A>B。
由表3 可知,F(xiàn)值判斷可知影響基質(zhì)中蛋白含量因素的依次順序?yàn)榘l(fā)酵時(shí)間、發(fā)酵溫度、接種量。對于DPPH 自由基清除能力影響因素依次為發(fā)酵時(shí)間、接種量,發(fā)酵溫度。其結(jié)果與直觀分析結(jié)果相符合。
固態(tài)發(fā)酵極差與因素最優(yōu)解水平見表4。

表4 固態(tài)發(fā)酵極差與因素最優(yōu)解水平
發(fā)酵時(shí)間D對兩指標(biāo)的影響:表4 顯示發(fā)酵時(shí)間對兩指標(biāo)來講極差均是最大,對于基質(zhì)蛋白含量來講D3水平為最優(yōu),對于自由基清除率來講D1水平為最優(yōu)。由單因素結(jié)果分析可知在D3水平下其大分子物質(zhì)水解程度較低,不適合提取抗氧化活性物質(zhì)。基于兩指標(biāo)在不同時(shí)間下多重比較結(jié)果分析D2水平適合最優(yōu)水平。
發(fā)酵溫度A對于兩指標(biāo)的影響:表4 顯示發(fā)酵溫度對兩指標(biāo)來講都是第二關(guān)鍵因素,溫度低時(shí)微生物繁殖和酶分解速度下降,溫度過高會破壞微生物和酶的結(jié)構(gòu)不利于活性物質(zhì)的生成。因此,選擇抗氧化水平較高A2為最優(yōu)發(fā)酵條件。
基質(zhì)pH 值B對兩指標(biāo)的影響:表4 對于兩指標(biāo)來講因素B都是最弱的影響因素,多重比較結(jié)果顯示其3 水平下的兩指標(biāo)都沒有顯著性(p>0.05) 差異。因此,選用B1水平為最佳條件。
通過各因素對基質(zhì)蛋白含量與DPPH 自由基清除率的綜合分析得出最優(yōu)方案為發(fā)酵時(shí)間24 h,接種量9%,發(fā)酵溫度37 ℃,基質(zhì)pH 值8。
由于正交試驗(yàn)結(jié)果不在正交試驗(yàn)設(shè)計(jì)表中,因此利用最佳參數(shù)進(jìn)行發(fā)酵驗(yàn)證,結(jié)果為DPPH 自由基清除率80%,基質(zhì)蛋白含量3.84 mg/g,其中自由基清除率高于所有正交試驗(yàn)結(jié)果,基質(zhì)蛋白含量高于多少結(jié)果。因此,認(rèn)為此發(fā)酵組合是合理的。
2.4 發(fā)酵產(chǎn)物抗氧化活性探究與感官分析
2.4.1 不同時(shí)間下DPPH 自由基清除能力的變化
DPPH 自由基清除能力測定見圖6。
由圖6 可知,在接種細(xì)菌開始發(fā)酵后,其基質(zhì)的抗氧化能力顯著提高。未接種的小米固態(tài)培養(yǎng)基,隨著發(fā)酵時(shí)間延長其抗氧化能力在不斷下降,其中的黃酮、多酚、脂質(zhì)不斷被氧化,使小米的品質(zhì)不斷下降。接種發(fā)酵24 h 后其抗氧化能力顯著(p<0.05) 高于其他時(shí)間。

圖6 DPPH 自由基清除能力測定
2.4.2 不同時(shí)間ABTS+自由基清除能力變化
ABTS+自由基清除能力測定見圖7。
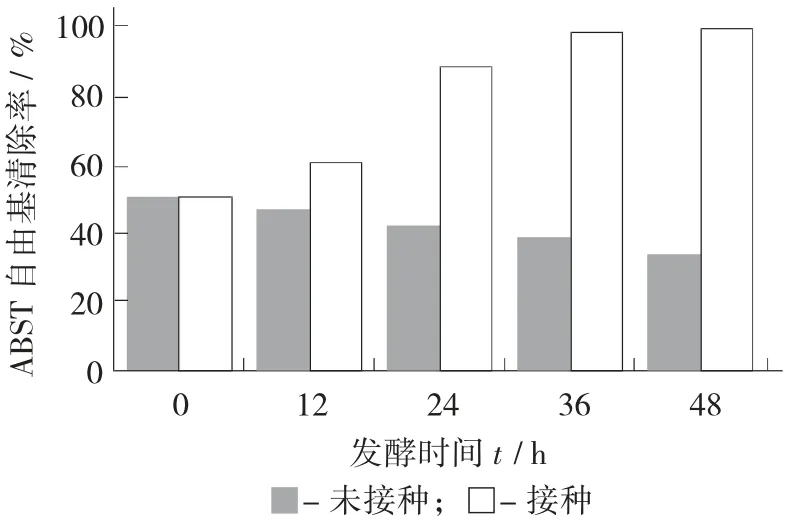
圖7 ABTS+自由基清除能力測定
由圖7 可知,隨著發(fā)酵時(shí)間延長,接種后其清除ABTS 自由基的能力顯著增強(qiáng)(p<0.05)。其在后期自由基清除能力不斷增加,表明有其他還原性物質(zhì)生成,如多糖、多酚。利用發(fā)酵獲取多糖已經(jīng)有較多研究[29-30]。通過發(fā)酵米糠[9]、桑葚[31]、橙子皮[32]來獲取多酚也有報(bào)道。
2.4.3 不同時(shí)間總還原力的變化
總還原力測定見圖8。

圖8 總還原力測定
鐵氰化鉀法測定總還原力可以直接通過吸光度來判斷總還原力的大小,吸光度與還原力呈正相關(guān)。由圖8 可知,隨著發(fā)酵時(shí)間延長,接種與未接種還原力差距越來越明顯。相對于用乙醇溶解DPPH 自由基測定抗氧化能力的大小,總還原力能更好地反映基質(zhì)的整體還原性。后期在基質(zhì)蛋白含量顯著下降的條件下依然保持較高的抗氧化活性,其原因可能是大分子物質(zhì)分解為更小的活性物質(zhì)或者存在發(fā)酵產(chǎn)物的協(xié)同作用[33]。Liang Zhishan 等人[34]在研究葡萄提取物中發(fā)現(xiàn),其中多酚類化合物存在協(xié)同抗氧化作用。在饒勝其等人[35]的研究中,通過純化的雞蛋清蛋白酶解肽和大豆蛋白酶解肽具有明顯的協(xié)同效應(yīng)。
2.4.4 不同發(fā)酵時(shí)間的感官評價(jià)
感官評價(jià)見表5。

表5 感官評價(jià)
由表5 可知,經(jīng)過滅菌后小米其品質(zhì)在12 h 內(nèi)不會發(fā)生顯著(p>0.05) 變化;在24 h 后其開始快速地腐敗變質(zhì);在培養(yǎng)箱中保存48 h 后,其有刺鼻的氨氣味,其中腐敗菌已經(jīng)開始大量繁殖失去可食用性。接種后的小米基質(zhì)培養(yǎng)12 h 后其硬度明顯變軟,證明納豆菌不止分泌蛋白酶,也會分泌淀粉酶來獲取外界多糖為自身生長發(fā)育提供碳源。在發(fā)酵24 h 后其基質(zhì)會明顯發(fā)黏,在對納豆菌的研究中表明是由于聚谷氨酸的生成[36],在小米的氨基酸組成中谷氨酸含量最為豐富[37],其在發(fā)酵過程中作為聚谷氨酸合成的來源有利于聚谷氨酸快速生成,幫助基質(zhì)更好地保留水分,使細(xì)菌能更好地生長發(fā)育。
3 結(jié)論
試驗(yàn)結(jié)果表明,利用納豆中細(xì)來發(fā)酵小米具有良好的可行性。以基質(zhì)中蛋白含量與提取液DPPH自由基率為指標(biāo),通過單因素試驗(yàn)優(yōu)化和正交綜合平衡法分析,得出發(fā)酵最佳條件為發(fā)酵時(shí)間24 h,接種量9%,發(fā)酵溫度37 ℃,基質(zhì)pH 值8,發(fā)酵后基質(zhì)蛋白含量3.84 mg/g,DPPH 自由基清除能力提高36%,ABTS 自由基清除能力提高38%。同時(shí),在發(fā)酵過程中產(chǎn)生的其他產(chǎn)物,如多糖、聚谷氨酸,也為其相關(guān)產(chǎn)品生產(chǎn)提供了新的視角。
- 農(nóng)產(chǎn)品加工的其它文章
- 大學(xué)生創(chuàng)新創(chuàng)業(yè)訓(xùn)練項(xiàng)目探索
——以“羽毛畫”為例 - 中加食品專業(yè)本科教育比較與思考
——以兩所普通高校為例 - 新工科背景下“焙烤工藝學(xué)”蒙漢雙語課程體系改革初探
- 食品科學(xué)與工程專業(yè)“4+0”應(yīng)用型本科專科與普通本科課程標(biāo)準(zhǔn)比較研究
——以“飲料生產(chǎn)技術(shù)”課程為例 - “食品安全與毒理學(xué)概論”線上線下混合教學(xué)模式的實(shí)踐與探索
- 基于OBE 理念的應(yīng)用型本科“食品新產(chǎn)品開發(fā)”課程的教學(xué)改革與實(shí)踐

