沉默miR-20a-5p 的肝癌細胞惡性生物學行為及Zbed3、Axin蛋白表達情況觀察
胡煒,邵安靜,李春霞,楊洋
1 重慶市九龍坡區人民醫院消化內科,重慶 400051;2 重慶市萬州上海醫院消化內科;3 重慶市陸軍特色醫學中心消化內科
肝癌發病隱匿、早期診斷困難、惡性程度高,臨床治療主要以手術切除腫瘤、放化療、血管腫瘤介入綜合治療等方法為主,但治療效果并不理想,患者年生存率為8%~10%[1]。目前人類肝癌早期發生發展的分子機制尚不明了,對肝癌發病機制進行探索對于尋求新的治療方法及靶標有著重要意義。微小RNA(miRNA)在腫瘤細胞生物學行為中具有一定的調控作用,可與上游其他基因、長鏈非編碼RNA及下游靶基因結合,參與調控靶基因轉錄,從而影響腫瘤進程。研究發現,miRNA 在原發性肝癌及慢性肝病進程的早期即存在異常表達,如肝炎、肝硬化等[2]。miR-20a-5p是miRNA 中的一員,其在胃癌、胰腺癌等組織中異常高表達,抑制其表達后可抑制腫瘤細胞增殖、轉移并促進凋亡[3-4]。三結構域蛋白家族樣1(TRIML1)是一種與TRMI 家族高度相似的蛋白,區別在于TRIML1 缺少B-box 域,TRIML1 最初發現于小鼠胚胎中,可與相關蛋白相互作用而促進腫瘤 的 發 生 發 展[5-7]。研 究 顯 示,TRIML 家 族 中TRIM65、TRIM52和TRIM59均可以促進肝癌的發生發展,而TRIM3、TRIM7 參與抑制肝癌的發展[8-9]。目前關于miR-20a-5p 與TRIML1 關系的研究比較少。鋅指蛋白3(Zbed3)可與Wnt號通路中的Axin結合,抑制Axin/GSK3β 復合體的功能,從而促進腫瘤細胞增殖[10]。2021 年5 月—12 月,本研究觀察了miR-20a-5p 與TRIML1 的靶向關系,并觀察其對肝癌細胞生物學行為及Zbed3、Axin 表達的影響。現報告如下。
1 材料與方法
1.1 材料 細胞:人正常肝細胞7701及人肝癌細胞株huh-7、HepG2、SMMC7721、QGY均購自上海中喬新舟生物科技公司,用含1×105U/L 青霉素、0.1 g/L 鏈霉素、5μmol/L PTX 的培養液常規培養,細胞融合度為80%~90%時胰酶消化,1 250 r/min離心5 min,重懸后傳代,取第四代細胞進行實驗。主要試劑:TRIML、miR-20a-5p引物序列由上海聯邁生物工程有限公司設計合成,PCR試劑盒購自北京百奧萊博生物科技有限公司,流式細胞儀購自上海三崴醫療設備公司,基質膠購自上海賓智生物科技有限公司,Zbed3、Axin一抗購自上海群己生物科技有限公司,辣根過氧化物酶二抗購自北京博爾希科技有限公司。
1.2 miR-20a-5p 與TRIML1 的靶向作用觀察 采用雙熒光素酶報告基因實驗。在線數據庫TargetScan(http://www. targetscan. org/vert_71/)預 測miR-20a-5p 的直接靶基因,結果顯示TRIML1 存在與miR-20a-5p 結合的潛在靶點,見圖1。將融合至80%的huh-7 細胞以2×105/孔接種于6 孔板中,分為四部分,使用LipofectamineTM2000 轉染試劑共轉染TRIML1-WT、TRIML1-MUT 質粒和miR-20a-5p-NC、miR-20a-5p siRNA,嚴格按照說明書操作,檢測熒光素酶相對活性。結果顯示,共轉染TRIML1-WT 和miR-20a-5p-NC 的細胞熒光素酶相對活性為1.12 ±0.09,共轉染TRIML1-WT 和miR-20a-5p siRNA 的細胞熒光素酶相對活性為0.69 ± 0.08,二者比較P<0.01;共轉染TRIML1-MUT 和miR-20a-5p-NC 的細胞熒光素酶相對活性為1.09 ± 0.12,共轉染TRIML1-MUT 和miR-20a-5p siRNA 的細胞熒光素酶相對活性為1.05±0.16,二者比較P均>0.05;提示TRIML1是miR-20a-5p的靶基因。
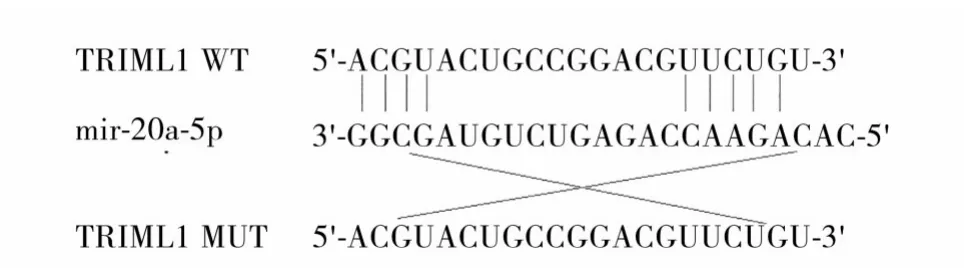
圖1 在線數據庫TargetScan預測結果
1.3 miR-20a-5p、TRIML1 高表達肝癌細胞的篩選 采用實時熒光定量PCR 法。取第四代人正常肝細胞7701 及人肝癌細胞株huh-7、HepG2、SMMC7721、QGY,使用TRIzol 試劑提取總RNA,根據cDNA 第一鏈合成試劑盒說明,逆轉錄合成cDNA;利用熒光實時定量PCR 儀進行擴增,使用PCR試劑盒檢測TRIML1、miR-20a-5p表達。PCR 反應過程:95 ℃、10 min,1 個循環;95 ℃、10 s,60 ℃、30 s,72 ℃、20 s,40個循環。miR-20a-5p、TRIML1及內參U6 引物序列見表1,采用2-ΔΔCt法計算TRIML1、miR-20a-5p 相對表達量。結果顯示,人正常肝細胞7701及人肝癌細胞株huh-7、HepG2、SMMC7721、QGY 中miR-20a-5p 相 對 表 達 量 分 別 為1.00 ± 0.04、1.73± 0.21、1.51 ± 0.13、1.53 ± 0.14、1.54 ± 0.12,TRIML1相對表達量分別為1.00±0.02、1.85±0.24、1.56±0.12、1.54±0.13、1.53±0.15;各肝癌細胞中miR-20a-5p、TRIML1 表達均高于人正常肝細胞7701,以huh-7 細胞升高最明顯(P均<0.05);因此選用huh-7 細胞進行后續實驗。

表1 miR-20a-5p、TRIML1及內參U6引物序列
1.4 細胞分組處理 將huh-7 細胞以3×103/孔接種于6 孔板中,待胞融合度至75%左右時分為7 組。模型組細胞正常培養,miR-20a-5p-NC 組轉染miR-20a-5p 陰 性 對 照,miR-20a-5p siRNA 組 轉 染miR-20a-5p siRNA,TRIML1-NC 組轉染TRIML1 陰性對照,TRIML1 siRNA 組轉染TRIML1 siRNA,TRIML1-NC+miR-20a-5p-NC 組轉染TRIML1 陰性對照+miR-20a-5p陰性對照,TRIML1 siRNA+miR-20a-5p siRNA組轉染TRIML1 siRNA+miR-20a-5p siRNA,均嚴格按照LipofectamineTM2000 試劑盒說明書進行操作。轉染6~8 h 后更換培養液,48 h 后收集細胞并保存備用。
1.5 細胞TRIML1、miR-20a-5p 表達檢測 參照1.2 采用實時熒光定量PCR 法檢測各組細胞TRIML1、miR-20a-5p表達。
1.6 細胞惡性生物學行為觀察
1.6.1 細胞凋亡能力 采用流式細胞術。取各組細胞,以2×105/孔接種于96 孔板中,常規培養24 h后棄培養液,含乙二胺四乙酸的胰酶消化細胞,2 000 r/min 離心5 min,棄上清液,PBS 清洗。加入500 μL 結合緩沖液,10 μL PI 及5 μL AnnexinVFITC,混勻,無光孵育5 min,上流式細胞儀檢測細胞凋亡率。
1.6.2 細胞侵襲能力 采用Transwell 小室實驗。在小室內進行鋪膠,待基質膠凝固后取各組轉染后細胞進行常規消化、洗滌,500 r/min離心5 min,棄掉上清液后重懸細胞,將其接種于小室上室;將小室置于24孔板孔內進行常規培養,24 h后取出小室,PBS洗滌后,5%多聚甲醛固定15 min。用棉簽擦掉小室內面基質膠和未穿過膜的細胞,行結晶紫染色,10 min后倒置顯微鏡下對侵襲細胞進行計數。
1.6.3 細胞遷移能力 采用Transwell 小室實驗。取各組饑餓12 h 后的細胞,用無血清培養基調整細胞密度為5×105/mL,Transwell 下室加入600 μL 含10%胎牛血清的培養基,Transwell 小室上室加入100 μL 無血清的細胞懸液,將Transwell 小室置于37 ℃、5%CO2培養箱中培養16 h;4%甲醛固定小室,0.1%結晶紫溶液染色,用棉簽擦去膜的上室面細胞后觀察、拍照,對遷移細胞進行計數。
1.7 細胞Zbed3、Axin蛋白表達檢測 采用Western blotting法。取各組細胞,加入裂解液裂解并提取總蛋白,對蛋白濃度進行定量。將提取出的蛋白溶液和緩沖溶液進行混均,然后將其煮沸、變性。取50μg蛋白樣品進行SDS-PAGE 分離蛋白質,將蛋白質轉移至PVDF 膜上,5%脫脂奶粉封閉1 h。加入一抗Zbed3(1∶200)、Axin(1∶500)及內參GAPDH(1∶2 000),4 ℃孵育過夜。PBS 漂洗,加入辣根過氧化物酶二抗(1∶5 000),室溫封閉1 h。取出PVDF 膜,PBS 漂洗、DAB顯色后照相。采用Image J圖像分析軟件定量分析條帶灰度值,計算Zbed3、Axin蛋白相對表達量。
1.8 統計學方法 采用GraphPad Prism 8.0統計軟件。計量資料采用Shapiro-Wilktest 正態性檢驗方法,呈正態分布以-x±s表示,多組間比較采用方差分析,兩組間比較采用t檢驗和SNK 法;非正態分布以M(P25,P75)表示,組間比較采用秩和檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 各組細胞TRIML1、miR-20a-5p表達比較 模型組、miR-20a-5p-NC 組、TRIML1-NC 組、TRIML1-NC+miR-20a-5p-NC 組細胞TRIML1、miR-20a-5p 相對表達量比較P均>0.05。與模型組、miR-20a-5p-NC 組、TRIML1-NC組、TRIML1-NC+miR-20a-5p-NC組比較,miR-20a-5p siRNA 組、TRIML1 siRNA 組、TRIML1siRNA+miR-20a-5p siRNA 組細胞TRIML1、miR-20a-5p 相對表達量均降低,且TRIML1 siRNA+miR-20a-5p siRNA組降低更明顯(P均<0.05)。見表2。
表2 各組細胞TRIML1、miR-20a-5p相對表達量比較(±s)
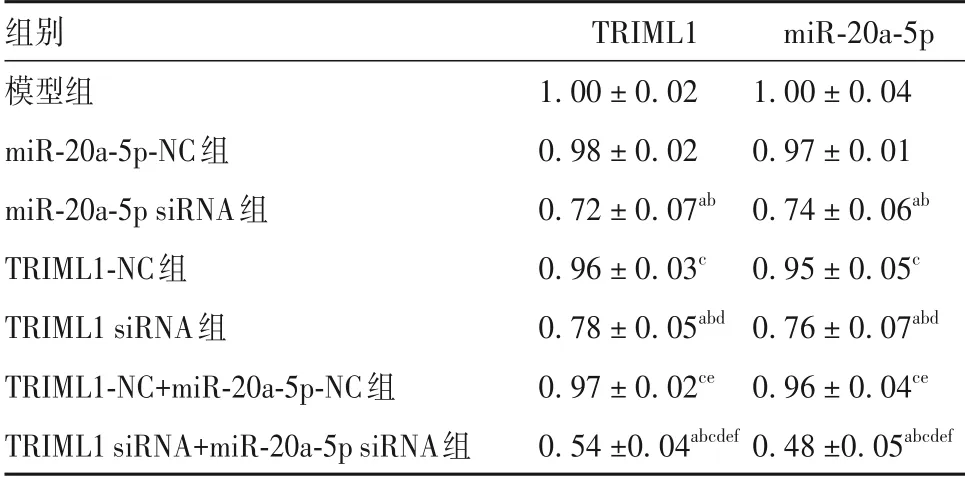
表2 各組細胞TRIML1、miR-20a-5p相對表達量比較(±s)
注:與模型組比較,aP<0.05;與miR-20a-5p-NC 組比較,bP<0.05;與miR-20a-5p siRNA 組比較,cP<0.05;與TRIML1-NC 組比較,dP<0.05;與TRIML1 siRNA 組比較,eP<0.05;與TRIML1-NC+miR-20a-5p-NC組比較,fP<0.05。
組別模型組miR-20a-5p-NC組miR-20a-5p siRNA組TRIML1-NC組TRIML1 siRNA組TRIML1-NC+miR-20a-5p-NC組TRIML1 siRNA+miR-20a-5p siRNA組TRIML1 1.00±0.02 0.98±0.02 0.72±0.07ab 0.96±0.03c 0.78±0.05abd 0.97±0.02ce 0.54±0.04abcdef miR-20a-5p 1.00±0.04 0.97±0.01 0.74±0.06ab 0.95±0.05c 0.76±0.07abd 0.96±0.04ce 0.48±0.05abcdef
2.2 各組細胞凋亡率、遷移細胞數、侵襲細胞數比較 模型組、miR-20a-5p-NC 組、TRIML1-NC 組、TRIML1-NC+miR-20a-5p-NC 組細胞凋亡率、遷移細胞數、侵襲細胞數比較P均>0.05。與模型組、miR-20a-5p-NC組、TRIML1-NC組、TRIML1-NC+miR-20a-5p-NC 組比較,miR-20a-5p siRNA 組、TRIML1 siRNA組、TRIML1 siRNA+miR-20a-5p siRNA 組細胞凋亡率均升高、遷移細胞數及侵襲細胞數均降低,且TRIML1 siRNA+miR-20a-5p siRNA 組變化更明顯(P均<0.05)。見表3及OSID碼圖1、2。
表3 各組細胞凋亡率、遷移細胞數、侵襲細胞數比較(±s)

表3 各組細胞凋亡率、遷移細胞數、侵襲細胞數比較(±s)
注:與模型組比較,aP<0.05;與miR-20a-5p-NC 組比較,bP<0.05;與miR-20a-5p siRNA 組比較,cP<0.05;與TRIML1-NC 組比較,dP<0.05;與TRIML1 siRNA 組比較,eP<0.05;與TRIML1-NC+miR-20a-5p-NC組比較,fP<0.05。
組別模型組miR-20a-5p-NC組miR-20a-5p siRNA組TRIML1-NC組TRIML1 siRNA組TRIML1-NC+miR-20a-5p-NC組TRIML1siRNA+miR-20a-5p siRNA組細胞凋亡率(%)3.18±0.34 3.48±0.31 13.84±2.37ab 3.56±0.28c 13.45±2.16abd 3.43±0.17ce 22.48±2.37abcdef侵襲細胞數(個)84.23±7.65 83.86±7.82 52.37±4.63ab 83.91±7.74c 51.25±4.82abd 82.69±8.14ce 30.14±2.85abcdef遷移細胞數(個)95.34±8.26 94.85±8.62 45.86±4.84ab 94.92±8.41c 46.32±4.39abd 93.62±9.87ce 28.46±2.30abcdef
2.3 各組細胞Zbed3、Axin 蛋白表達比較 模型組、miR-20a-5p-NC 組、TRIML1-NC 組、TRIML1-NC+miR-20a-5p-NC 組細胞Zbed3、Axin 蛋白相對表達量比 較P均>0.05。與 模 型 組、miR-20a-5p-NC 組、TRIML1-NC 組、TRIML1-NC+miR-20a-5p-NC 組 比較,miR-20a-5p siRNA 組、TRIML1 siRNA 組、TRIML1 siRNA+miR-20a-5p siRNA 組 細 胞Zbed3 蛋白相對表達量均降低、Axin 蛋白相對表達量均升高,且TRIML1 siRNA+miR-20a-5p siRNA 組變化更明顯(P均<0.05)。見表4、OSID碼圖3。
表4 各組細胞Zbed3、Axin蛋白相對表達量比較(±s)
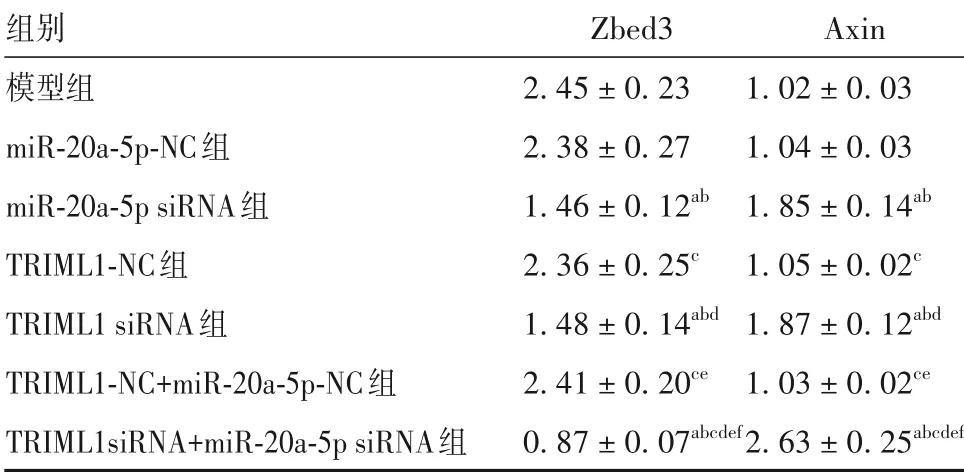
表4 各組細胞Zbed3、Axin蛋白相對表達量比較(±s)
注:與模型組比較,aP<0.05;與miR-20a-5p-NC 組比較,bP<0.05;與miR-20a-5p siRNA 組比較,cP<0.05;與TRIML1-NC 組比較,dP<0.05;與TRIML1 siRNA 組比較,eP<0.05;與TRIML1-NC+miR-20a-5p-NC組比較,fP<0.05。
組別模型組miR-20a-5p-NC組miR-20a-5p siRNA組TRIML1-NC組TRIML1 siRNA組TRIML1-NC+miR-20a-5p-NC組TRIML1siRNA+miR-20a-5p siRNA組Zbed3 2.45±0.23 2.38±0.27 1.46±0.12ab 2.36±0.25c 1.48±0.14abd 2.41±0.20ce 0.87±0.07abcdef Axin 1.02±0.03 1.04±0.03 1.85±0.14ab 1.05±0.02c 1.87±0.12abd 1.03±0.02ce 2.63±0.25abcdef
3 討論
肝癌的發生發展受外部環境影響,在我國肝炎病毒感染是導致肝癌發生的重要因素之一,同時也與患者的遺傳背景、DNA 損傷、免疫調節等因素有關。化學藥物治療是中、晚期肝癌的一個重要治療手段,盡管新的抗癌藥物及化療方案不斷推出,但療效仍不盡人意。miRNA 作為重要的調控分子,對腫瘤細胞的異常增殖、轉移等惡性生物學行為起著重要的調節作用[11]。羅和生等[12]研究顯示,miR-20a-5p 低表達可促進胰腺癌細胞凋亡。陳杰等[13]研究顯示,miR-20a-5p在結腸癌細胞中異常高表達,降低其表達后可通過靶向抑制β-catenin 表達,從而抑制細胞增殖并促進細胞凋亡。本研究結果顯示,肝癌細胞中miR-20a-5p 高表達,轉染miR-20a-5p siRNA后miR-20a-5p 表達降低,同時肝癌細胞凋亡增加,侵襲、遷移數量減少,提示沉默miR-20a-5p 可抑制huh-7細胞的惡性生物學行為。
隨著對腫瘤認識的不斷加深,學者對腫瘤相關因子的研究逐漸從單一分子向家族分子或序貫式關聯分子群轉變。腫瘤的發生發展過程并非由單一分子發揮作用,大部分是由眾多分子相互作用進而傳遞分子信號,從而產生相應的細胞或生物學行為。已有報道提示,miRNA 可通過調控相關蛋白因子表達參與調控細胞生物學行為[14-15]。TRIML1 在天然免疫應答、細胞分化、轉錄調節、細胞骨架重塑、細胞發育、細胞周期和凋亡、DNA 損傷修復等生理過程中起著重要作用,可通過調節基因表達、細胞增殖、DNA 損傷修復和凋亡等信號通路在腫瘤的發生發展中發揮作用,還可通過調控相關信號通路在炎癥向腫瘤的發展過程中發揮作用[16]。郭瑛等[17]研究顯示,沉默miR-20a-5p 可促進肝癌細胞凋亡,抑制細胞增殖。本研究雙熒光素酶報告基因實驗結果顯示,TRIML1 是miR-20a-5p 的靶基因,受miR-20a-5p的正向調控;本研究PCR結果顯示,miR-20a-5p在肝癌細胞中的表達明顯升高,在轉染miR-20a-5p siRNA 后肝癌細胞miR-20a-5p 及TRIML1 表達均降低,此時肝癌細胞凋亡率升高、遷移和轉移能力降低,這提示沉默miR-20a-5p 抑制肝癌細胞的惡性生物學行為的機制可能與降低TRIML1表達有關。
Zbed3 可與Wnt 通路中的Axin 結合,從而發揮抑制Axin/CSK3β 復合體功能的作用[18]。Wnt 通路異常激活與腫瘤的發生發展密切相關,Axin 是該通路的重要分子[19]。研究證實,體外轉染Zbed3 siRNA后,可通過調控Axin/CSK3β復合體的功能,抑制肺癌細胞的增殖和侵襲能力[20]。本研究結果顯示沉默TRIML1、miR-20a-5p 表達后,肝癌細胞Zbed3 表達均明顯降低,而Axin 表達明顯升高,結合沉默TRIML1、miR-20a-5p 表達后肝癌細胞惡性生物學行為的改變,提示Zbed3 及Axin 表達改變可能是與其調節癌細胞凋亡、侵襲及遷移的相關機制。
綜上所述,沉默miR-20a-5p 表達可抑制肝癌huh-7 細胞的侵襲、轉移及Zbed3 表達,并促進細胞凋亡及Axin 蛋白表達,其機制可能與正向調控TRIML1表達有關。

