環狀RNA與氧化應激互作機制的研究進展
趙久紅,童佳婷,沈郅珺,呂葉輝
上海健康醫學院基礎醫學院,上海 201318
環狀RNA(circular RNA,circRNA)是一類共價閉環非編碼RNA,是由mRNA 前體通過特殊的可變剪切連接而成的內源性RNA[1]。circRNA 在哺乳動物細胞中廣泛表達, 可通過充當微RNA(miRNA)海綿、與RNA 結合蛋白相互作用、調節mRNA 穩定性、作為競爭性內源RNA(competing endogenous RNA,ceRNA)等機制在多個水平參與基因調控,廣泛參與缺血、缺氧、損傷修復、腫瘤發生等多種病理生理過程[1-3]。氧化應激是指機體在衰老或者遭受有害刺激時,機體內活性氧(reactive oxygen species,ROS)的產生與清除(抗氧化)失衡的狀態,進而導致損傷,與多種疾病的發生、發展密切相關。隨著研究深入,已有證據表明多種circRNA 在氧化應激狀態下表達異常。分析circRNA 的表達改變及其對氧化應激相關分子指標的作用機制具有重要意義,不僅有助于揭示發病機制,也可為相關疾病的防治提供理論基礎。本文在梳理現有研究的基礎上,以器官系統疾病為主線,就氧化應激過程中的circRNA 的表達變化及調控作用機制做一綜述。
1 氧化應激概述
氧化應激即體內ROS 的產生與ROS 清除失衡的一種狀態。ROS 是生物體有氧代謝過程中的正常副產物,在機體內被不斷地產生,包括超氧陰離子、羥基自由基、氧自由基衍生的單線態氧、過氧化氫(H2O2)、過氧亞硝酸鹽、一氧化氮(NO)等,并通過信號轉導和表達調控參與各項生命過程[4]。生理狀態下,代謝產生的ROS 能被體內抗氧化系統清除,而ROS 和抗氧化系統之間的良好平衡對于細胞的正常功能至關重要[5]。在機體衰老或病理狀態下,都有可能導致ROS 產生和清除失衡,導致各類分子受到氧化損傷,如DNA 斷裂、蛋白質變性和脂質過氧化等,細胞表現為衰老、凋亡或壞死[6]。上述氧化應激改變可出現在中樞神經系統,如阿爾茨海默病和帕金森病[7-8];也可出現在心血管系統疾病,如氧自由基攻擊心肌細胞和動脈粥樣硬化等[9-10];也有研究表明氧化應激在腎臟損傷、肺損傷等疾病的發生、 發展過程中發揮著重要作用[11-12]。
氧化應激標志物是指能反映機體內氧化應激水平的一系列生化分子。在氧化應激過程中,清除氧化產物的蛋白酶減少,大量氧化中間產物蓄積,從而導致分子、細胞和機體的一系列損傷。而目前常用的氧化應激標志物也是從蛋白酶、中間產物及損傷產物3 個層面進行選取,詳見表1。氧化應激發生時,超氧化物歧化酶(superoxide dismutase,SOD)表達下降,活性降低,產生過多的脂質過氧化產物丙二醛(malondialdehyde,MDA);谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px) 也是體內重要的過氧化物分解酶,可使MDA 還原,從而保護細胞免受氧化損傷;因此SOD、MDA 和GSH-Px 常被作為判斷氧化應激程度的指標[13-14]。過量表達的誘導型一氧化氮合酶(inducible nitric oxide synthase,iNOS) 是NO 異常增多的主要原因,過氧化氫酶(catalase,CAT)也是重要的H2O2清除酶,這些酶亦可用來評估氧化應激狀態。氧化應激本就表現為ROS 升高,所以ROS 本身也是氧化應激標志物。在機體處于氧化應激狀態下,增多的ROS 可使體內的生物大分子等出現不同程度的氧化:谷胱甘肽大量轉化成氧化型谷胱甘肽(oxidized glutathione, GSSG); 3- 硝基酪氨酸(3-nitrotyrosine,3-NT)為蛋白硝基化終產物,能不斷積累活性氮和活性氧,影響細胞內線粒體生物功 能 ; 8- 羥 基 脫 氧 鳥 苷 (8-hydroxy-2-deoxyguanosine,8-OHdG)是ROS 攻擊DNA 分子中鳥嘌呤堿基的第8 位碳原子形成的氧化加合物;故而GSSG、3-NT 和8-OHdG 也可作為氧化應激標志物。此外,亦有研究表明鐵、汞等金屬處理可造成機體內的氧化與抗氧化的不平衡,也有學者推薦將微量金屬元素作為標志物來檢測機體的氧化應激狀態[15]。
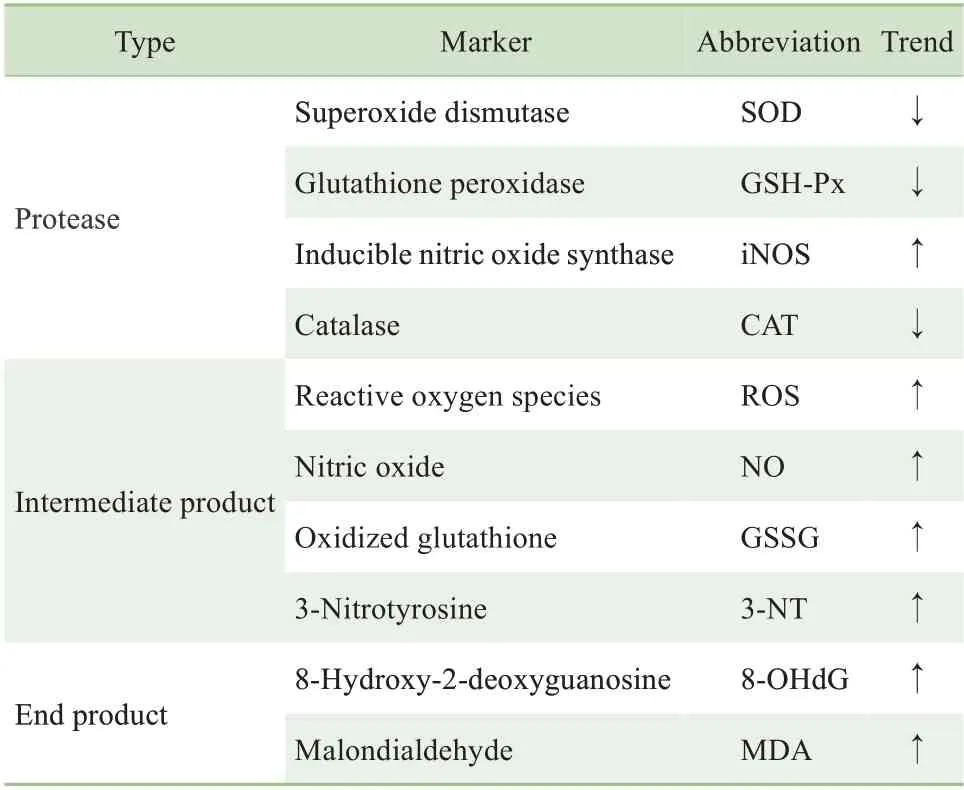
表1 研究常用的氧化應激標志物Tab 1 Commonly used oxidative stress markers in present studies
標志物含量的變化既可以明確氧化應激狀態,也是分析疾病發生、發展與氧化應激相關性的前提,無論是蛋白酶、中間產物,還是終產物,相關的表達調控主要在3 個水平上進行,即miRNA-mRNA-蛋白質作用網絡。circRNA 作為近年來生物醫學領域的熱點分子,其轉錄或轉錄后的調控作用主要表現為以下幾點[16-18]:轉錄時與mRNA 前體發生剪接競爭,起到ceRNA 作用;充當miRNA 海綿,與mRNA 競爭miRNA 位點;少數circRNA 包含核糖體進入位點,具有翻譯能力;在翻譯后水平與蛋白結合,調節蛋白的活性。鑒于上述調控機制和相關研究基礎,circRNA 可能是氧化應激過程中的關鍵分子,對于氧化應激標志物的表達調控和下游改變具有重要作用。在氧化應激狀態下特異性表達的circRNA,可通過多種機制進行調控,特別是通過miRNA 影響下游基因表達,參與氧化應激造成的損傷,亦可上調相關抗氧化因子,降低氧化應激的影響。根據在氧化應激過程中不同的調控作用(促進或抑制),本文將相關circRNA 大致分為促氧化應激損傷和抗氧化應激損傷2類。
2 circRNA 在心血管疾病氧化應激中的作用
心血管疾病在世界范圍內都有著極高的發病率和死亡率,越來越多的證據表明氧化應激參與了多種心血管疾病的發生、發展。已有研究表明circRNA 是高血壓、心肌梗死、動脈粥樣硬化等心血管疾病中的重要調控因子,而且與氧化應激損傷有關[9]。系列研究表明差異性表達的circRNA 可通過多種作用機制對氧化應激誘發的炎癥反應或細胞損傷發揮調控作用,詳見表2。
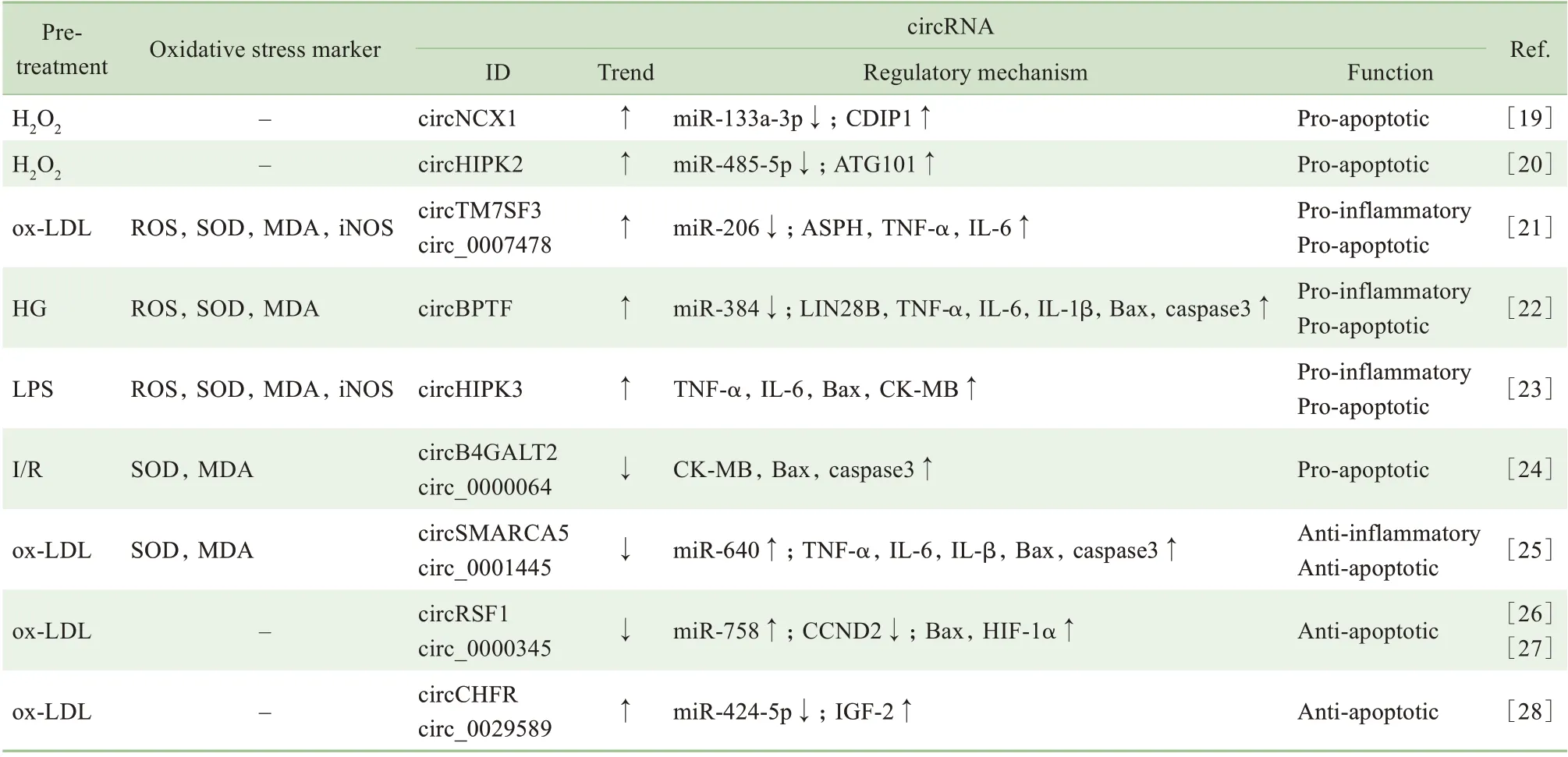
表2 circRNA在心血管疾病氧化應激中的表達調控機制Tab 2 Regulatory mechanism of circRNA expression under oxidative stress in cardiovascular diseases
2.1 促氧化應激circRNA
H2O2或缺血再灌注損傷(ischemia/reperfution,Ⅰ/R)處理的心肌細胞可誘導circNCX1 高表達,miR-133a-3p 與circNCX1 競爭性結合,以致前者對促凋亡因子細胞死亡誘導蛋白(cell death-inducing p53 target protein 1,CDⅠP1)的翻譯抑制作用喪失,最終導致心肌細胞死亡[19]。circHⅠPK2 在H2O2處理新生小鼠心肌細胞中表達上調,并通過miR-485-5p/ATG101 通路促進自噬,加速氧化應激中的細胞凋亡和死亡[20]。在氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL) 誘導的細胞模型中,hsa_circ_0007478 (circTM7SF3) 通過miR-206 的介導上調天冬酰胺β 羥化酶(aspartyl β-hydroxylase,ASPH)、TNF-α、ⅠL-6 表達,起到促炎、促凋亡的作用[21]。在高葡萄糖(high glucose,HG)或脂多糖(lipopolysaccharide,LPS)處理的氧化應激細胞模型中,高表達的circBPTF 和circHⅠPK3 可通過上調TNF-α、ⅠL-6、Bax、caspase3、CK-MB 等起到促炎、促凋亡的作用[22-23]。在LPS 誘導的心肌炎小鼠模型中,敲除circHⅠPK3 可有效降低ROS、MDA 等氧化應激標志物的含量,抑制心肌細胞凋亡,減輕心肌組織損傷[23]。
2.2 抗氧化應激circRNA
2.2.1 氧化應激條件下表達下調 Ⅰ/R 后心肌細胞內hsa_circ_0000064(circB4GALT2) 表達降低,上調的CK-MB、Bax和caspase3參與氧化應激狀態下的細胞損傷;如損傷前采用紅景天苷預處理,細胞內的hsa_circ_0000064 顯著上調,上述凋亡相關蛋白表達下降,減輕氧化應激對心肌細胞的損傷[24]。在ox-LDL 誘導的細胞模型中, hsa_circ_0001445(circSMARCA5)和hsa_circ_0000345(circRSF1)的表達顯著下調:前者與miR-640 的介導有關,下調后引起TNF-α、ⅠL-6、ⅠL-β、Bax 和caspase3 等炎癥因子及凋亡相關蛋白的上調;后者與細胞周期素D2(cyclin D2,CCND2)競爭性結合miR-758,下調后CCND2 表達下降,Bax 和HⅠF-1α 的表達升高;兩者的低表達均起到促炎、促凋亡的作用。值得注意的是,將過表達的circSMARCA5或circRSF15的質粒轉染到細胞后,再行氧化應激時,高水平的circRNA 可通過下調相關炎癥因子及凋亡相關蛋白的表達,起到抗氧化應激的作用[25-27]。
2.2.2 氧化應激條件下表達上調 在ox-LDL 誘導的血管平滑肌細胞中,circ_0029589(circCHFR)表達上調,通過miRNA 海綿吸附miR-424-5p 使胰島素樣生長因子2 (insulin-like growth factor 2,ⅠGF2)表達增加,減少細胞凋亡,起到抗氧化應激的作用;沉默circ_0029589 或過表達miR-424-5p,可使細胞在氧化應激時增殖下降且凋亡增加[28]。該研究也提示機體在氧化應激下,會通過高表達部分circRNA 來應對過氧化狀態、減輕損傷,這是一種自我保護機制。
3 circRNA 在神經系統疾病及肺部疾病氧化應激中的作用
在神經系統疾病,特別是神經退行性病變中,ROS增多、脂質過氧化、細胞色素C釋放等因素是氧化應激損傷的重要機制,可導致神經元凋亡或死亡的發生,是病變的重要基礎[7]。肺也是氧化應激暴露的常見受累器官,特別是在慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD) 中,氧化應激是重要的致病機制[12,29]。隨著研究深入,已有證據表明circRNA 可能是連接氧化應激與神經系統疾病或肺部疾病之間的關鍵環節[30-31],詳見表3。
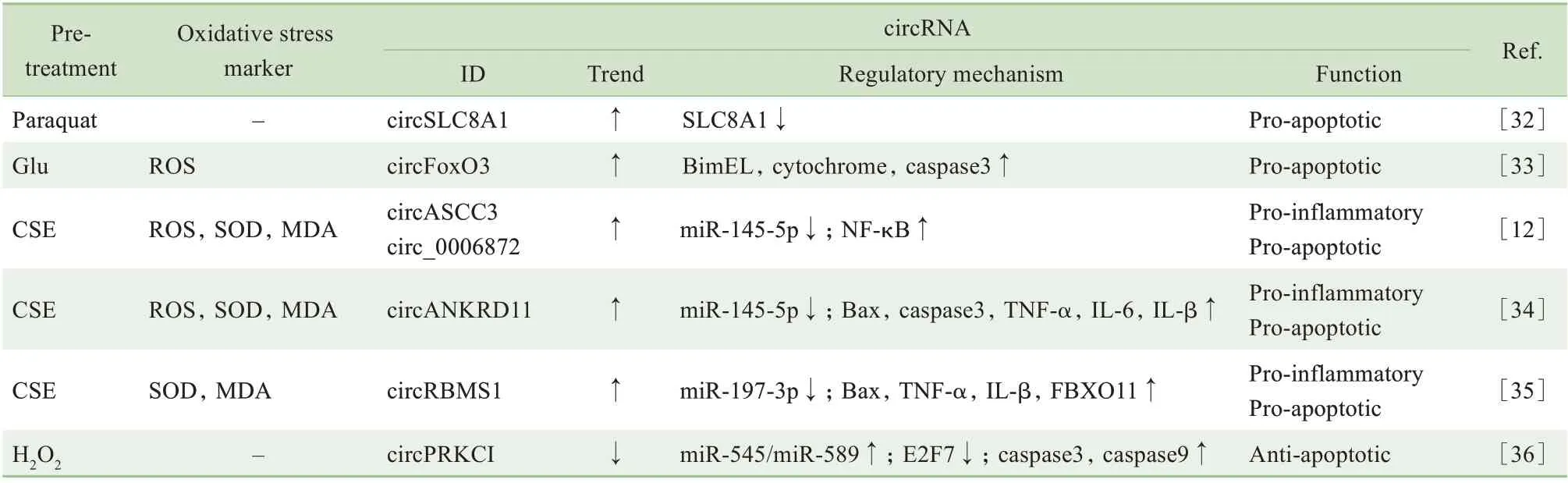
表3 circRNA在神經系統及肺疾病氧化應激中的表達調控機制Tab 3 Regulatory mechanism of circRNA expression under oxidative stress in neurological disorders and lung diseases
3.1 促氧化應激circRNA
百草枯處理神經母細胞瘤細胞系制作氧化應激模型,發現circSLC8A1 顯著升高,與線性mRNA 競爭導致SLC8A1表達下調;circSLC8A1 還具有miR-128和Ago2 蛋白結合位點,使miR-128 的靶基因表達上調,參與氧化應激所致的帕金森病[32]。在谷氨酸誘導的HT22 細胞(小鼠海馬神經元細胞系)氧化應激模型中,circFoxO3 表達升高,介導凋亡相關蛋白BimEL、cytochrome 及caspase 上調,從而減弱細胞活力、促進細胞凋亡;敲除circFoxO3 后BimEL 下調,間接抑制HT22 細胞的線粒體凋亡,減輕氧化應激損傷[33]。
香煙煙霧被公認為COPD 的危險因素,香煙煙霧所致的氧化應激在COPD 中也至關重要。有3 個不同的實驗組借助香煙煙霧提取物(cigarette smoke extract,CSE)誘導細胞氧化應激,并檢測出多種circRNA 異常升高,這些指標可能是阻斷氧化應激的潛在靶點。XUE 等[12]發現發生氧化應激條件下,hsa_circ_0006872 (circASCC3) 通過miR-145-5p/NF-κB 途徑,促進CSE 誘導的人肺微血管內皮細胞內ROS、SOD 和MDA 增多,促炎、促凋亡。WANG 等[34]發現circANKRD11 可與miR-145-5p 結合,導致Bax、caspase3、TNF-α 等炎癥因子及凋亡相關蛋白的表達增加,沉默circANKRD11 可明顯改善CSE 誘導氧化應激所致的炎癥及凋亡情況。QⅠAO 等[35]發現在CSE 處理的人支氣管上皮樣細胞中,circRBMS1 在氧化應激狀態下表達上調,敲除circRBMS1 后可降低炎癥水平、減少細胞凋亡。
3.2 抗氧化應激circRNA
研究發現在H2O2誘導的神經元氧化應激模型中,circPRKCⅠ表達下調,通過circPRKCⅠ-miR-545/589-E2F7軸,上調凋亡相關蛋白caspase3和caspase9的表達,而過表達circPRKCⅠ可顯著減輕氧化應激損傷,減少細胞凋亡[36]。
4 circRNA在腎疾病氧化應激中的作用
氧化應激是急性腎損傷(acute kidney injury,AKⅠ)和糖尿病腎病(diabetic nephropathy,DN)的發病機制之一,circRNA 在其中也發揮著重要作用,見表4。
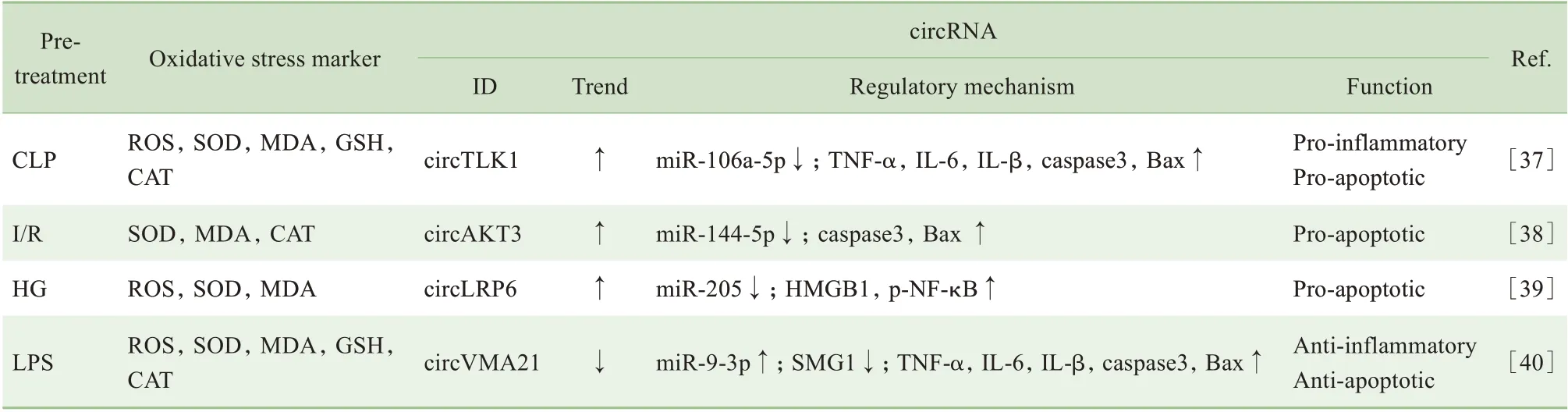
表4 circRNA在腎疾病氧化應激中的表達調控機制Tab 4 Regulatory mechanism of circRNA expression under oxidative stress in kidney diseases
4.1 促氧化應激circRNA
在盲腸結扎穿刺(cecum ligation and puncture,CLP)制作的膿毒癥相關性AKⅠ模型中,circTLK1的表達升高,通過miR-106a-5p 軸加劇炎癥、凋亡等氧化應激損傷[37]。在腎Ⅰ/R 損傷模型中,高表達的circAKT3 通過miRNA 海綿作用下調miR-144-5p 的表達,致使Bax 及caspase3 上調,介導了氧化應激過程[38]。在HG誘導的氧化應激細胞模型中,circLRP6顯著上調并吸附miR-205,使高遷移率族蛋白1(high mobility group protein 1,HMGB1)表達上調,HMGB1 具有促炎作用,可加劇氧化應激所致的細胞損傷,也是DN病情進展的獨立危險因素[39]。
4.2 抗氧化應激circRNA
SHⅠ等[40]的實驗表明,在LPS 誘導腎細胞模型中,circVMA21 表達下調,通過miR-9-3p/SMG1/炎癥因子軸介導氧化應激過程,過表達circVMA21 則可降低炎癥水平、減少細胞凋亡。
當然,circRNA 參與和介導的氧化應激不只局限于上述器官系統疾病中。LⅠ等[41]在HG 誘導的人視網膜上皮細胞中,發現高表達的circRNA_0084043 參與氧化應激過程,導致細胞活力下降和凋亡增加,下調其表達則可減輕氧化應激損傷。YANG 等[42]從circRNA 的角度研究了氧化應激在骨關節炎中的發病機制,揭示了circRSU1/miR-93-5p/MAP3K8軸,通過MEK/ERK1/2和NF-κB途徑促進骨關節炎的發生。
5 circRNA 與氧化應激相互作用機制分析與探討
5.1 氧化應激狀態導致circRNA表達改變
多項研究已經證實氧化應激狀態下多種circRNA出現明顯的上調或下調,雖然氧化應激介導circRNA形成和變化的機制尚未完全明確,但有報道表明氧化應激可通過影響轉錄過程的順式作用元件[43]、促進反式作用因子的核轉移[44]、改變剪接體的功能[45],進而對基因表達進行調控,而上述機制都在circRNA的形成過程中發揮重要作用。當然,氧化應激狀態下circRNA 的差異性表達很可能是一個復雜的多通路機制,還有待進一步深入。
5.2 circRNA調控氧化應激進程
circRNA 可通過多種機制,在轉錄或轉錄后水平調控氧化應激的進程。已有多項研究[12,19-24,35-38]表明circRNA 主要通過miRNA 的介導調控相關炎癥因子及凋亡基因的表達,影響炎癥水平及細胞凋亡、死亡進程,發揮促或抗氧化應激損傷的作用。也有研究[22-24,32-33]顯示circRNA 直接或間接調控抗氧化基因的表達,改變氧化應激進程。以核因子E2相關因子2(nuclear factor-erythroid 2-related factor 2,NRF2)和Kelch 樣環氧氯丙烷相關蛋白1 (Kelch-like ECHassociated protein 1,KEAP1)為例,KEAP1/NRF2信號通路在調控抗氧化基因的表達中發揮重要作用,circKEAP1與miR-141-3p結合可激活KEAP1/NRF2信號通路,減輕氧化應激損傷[46],circTCONS_l2_00004572則可下調NRF2的表達,導致ROS增加,加劇氧化應激損傷[47]。
6 結語與展望
氧化應激可導致circRNA 表達變化,circRNA 也可調控氧化應激狀態,兩者相互作用和影響,參與多種疾病的發生、發展。氧化應激條件下表達變化的circRNA 大致可分為促氧化應激和抗氧化應激2 類:前者多在氧化應激時表達上調,介導炎癥因子及凋亡蛋白表達增多,加劇氧化應激損傷,下調此類circRNA 可減輕氧化應激損傷;后者多在氧化應激時表達下調,過表達此類circRNA 可降低炎癥水平、減少細胞凋亡,起到抗氧化應激損傷的作用。本文綜述了各系統疾病中circRNA 與氧化應激的相互作用,分析了circRNA 在促氧化應激和抗氧化應激中的具體作用機制,希望能為進一步研究提供參考。

