發酵乳桿菌LFQ153胞外多糖對RAW264.7巨噬細胞氧化損傷的保護作用
劉聰秀,宋佳佳,王洪偉,張玉,索化夷
(西南大學 食品科學學院,重慶,400715)
氧化應激是指機體受到不良刺激時,產生的過量自由基超出細胞抗氧化防御能力,造成機體氧化與抗氧化作用失衡的現象[1]。持續的氧化應激可導致脂質過氧化、蛋白質和DNA損傷,引發炎癥、糖尿病、動脈粥樣硬化和神經退行性疾病[2]。其中,炎癥與氧化應激密不可分,氧化應激使機體產生過量活性氧,激活免疫細胞釋放多種炎癥介質,引起機體炎癥反應[3];同時炎癥反應會促進大量自由基釋放,進一步加劇氧化應激[4]。因此,緩解氧化性損傷對維持機體健康具有重要意義。
已有研究表明,多糖可通過清除活性氧自由基,提高抗氧化物酶活性,減少脂質過氧化物產生等途徑起到抗炎抗氧化作用。例如,黨參多糖對H2O2誘導的RAW264.7巨噬細胞氧化損傷具有保護作用[5],羊肚菌多糖對脂多糖誘導的RAW264.7巨噬細胞炎癥反應具有抑制作用[3]。除植物多糖和真菌多糖外,乳酸菌胞外多糖(exopolysaccharide,EPS)由于具有生產周期短、成本低和易于控制等優勢,也受到越來越多關注。乳酸菌 EPS是乳酸菌在生長代謝過程中分泌到細胞外的天然高分子聚合物,通常由一種或多種不同類型的單糖組成,可保護細胞免受干燥脫水、抗生素或有毒物質等外界不良影響[6]。研究證實,乳酸菌EPS具有抗炎、抗氧化、抗腫瘤和降糖降脂等生物學活性[7]。如HU等[8]發現鼠李糖乳桿菌ZFM231的EPS具有顯著降血脂、降膽固醇活性和自由基清除能力;SIRIN等[9]的研究表明,保加利亞乳桿菌B3和植物乳桿菌GD2的EPS可緩解淀粉樣β蛋白誘導的人神經母細胞瘤細胞SH-SY5Y氧化應激,預防阿爾茨海默病。
我國乳酸菌發酵食品資源豐富,已有學者從傳統發酵食品中分離出產EPS的乳酸菌,并研究乳酸菌EPS的生物活性,如LIU等[10]發現從四川泡菜中分離到的植物乳桿菌HY,其產生的EPS具有較強抗氧化能力。本研究從青海西寧市手工酸奶中分離得到1株產EPS且胃腸抗性較好的發酵乳桿菌LFQ153,其EPS對氧化損傷的緩解作用尚不清楚。因此,本研究首先通過DPPH自由基和羥自由基清除實驗考察EPS的體外抗氧化水平,進而基于氧化損傷的RAW264.7巨噬細胞,從抗氧化酶活性、炎癥因子表達以及核因子E2相關因子2(nuclear factor E2-related factor 2,Nrf2)/血紅素氧合酶1(heme oxygenase-1,HO-1)/核因子κB(nuclear factor-κB,NF-κB)通路等角度,研究EPS對巨噬細胞氧化損傷的保護作用與機制,旨在為功能性乳酸菌胞外多糖的開發提供一定理論基礎和科學依據。
1 材料與方法
1.1 材料及試劑
發酵乳桿菌LFQ153,本課題組分離自青海西寧市手工酸奶;RAW264.7小鼠單核巨噬細胞,來自中國科學院細胞庫。
濃 H2SO4、苯酚、FeSO4、30% H2O2、95%乙醇、無水乙醇、三氯乙酸、三氯甲烷、異丙醇,成都市科隆化學品有限公司;DPPH、1,10-菲啰啉、噻唑藍(methyl thiazolyl tetrazolium,MTT)、脂多糖(lipopolysaccharides,LPS),Sigma-Aldrich 試劑公司;MRS培養基,廣東環凱微生物科技有限公司;DMEM(dulbecco′s modified eagle medium)培養基、胎牛血清(fetal calf serum,FBS)、0.25%胰酶、青霉素-鏈霉素溶液,美國 Gibco 公司;非必需氨基酸、磷酸鹽緩沖液(phosphate buffer saline,PBS)、二甲基亞砜(dimethyl sulfoxide,DMSO)試劑,北京索萊寶科技有限公司;Griess 試劑盒、BCA試劑盒、超氧化物歧化酶(superoxide dismutase,SOD)試劑盒、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)試劑盒、丙二醛(malondialdehyde,MDA)試劑盒、細胞裂解液,碧云天生物技術研究所;過氧化氫酶(catalase,CAT)試劑盒,南京建成生物工程研究所;RevertAid First Strand cDNA合成試劑盒、PCR 引物設計和合成,美國 Thermo公司;SYBR Green RCR Master Mix,翌圣生物科技有限公司。本研究采用的化學試劑均為分析純。
1.2 儀器與設備
Epoch2型多功能酶標儀,美國BioTek公司;5810R型高速冷凍離心機,德國 Eppendorf 公司;CFX96 Touch型熒光定量 PCR 儀,美國 Bio-rad 公司;P100K200型超微量核酸蛋白測定儀,美國Pultton公司;371型二氧化碳培養箱,美國Thermo公司。
1.3 實驗方法
1.3.1 發酵乳桿菌LFQ153胞外多糖的制備
將發酵乳桿菌LFQ153接入MRS液體培養基活化后,以2%的比例接種擴大培養。37 ℃厭氧培養 48 h后,取培養液于4 ℃下4 000 r/min離心15 min去除菌體,收集上清液,沸水浴10 min使分解多糖的酶類失活。冷卻至室溫,50 ℃減壓濃縮至原體積的1/4,加入三氯乙酸至質量濃度40 g/L,4 ℃靜置8 h,在4 ℃下10 000 r/min離心10 min去除蛋白質沉淀。加入3倍體積的預冷95% (體積分數)乙醇,4 ℃靜置8 h,在4 ℃下10 000 r/min離心10 min得到粗多糖沉淀。將粗多糖沉淀溶于60 ℃蒸餾水中,10 000 r/min離心10 min去除底部不溶沉淀,然后將上清液裝入截留分子質量為8~14 kDa的透析袋內,每隔6~8 h換1次水,連續透析2 d。收集透析袋內多糖溶液,真空冷凍干燥制得粗多糖。
采用DEAE Sepharose Fast Flow陰離子柱(21 mm×135 mm)初步純化粗多糖,取200 mg粗多糖溶于20 mL去離子水,過0.22 μm濾膜后加入DEAE Sepharose Fast Flow柱,用去離子水、0.05、0.1、0.2 mol/L NaCl 溶液以流速4 mL/min梯度洗脫,6 mL/管收集洗脫液,苯酚硫酸法[11]跟蹤檢測洗脫液,收集主峰組分,濃縮透析并冷凍干燥。采用Superdex 200凝膠柱(10 mm×240 mm)進一步純化,取多糖干粉溶于去離子水配成10 mg/mL的溶液,過0.22 μm濾膜后用去離子水以流速1 mL/min洗脫,3 mL/管收集洗脫液,苯酚硫酸法跟蹤檢測,收集洗脫峰,濃縮后冷凍干燥,得到純化多糖EPS,根據苯酚硫酸法測得EPS總糖含量為(91.70±0.82)%。
1.3.2 EPS的體外抗氧化活性
1.3.2.1 DPPH自由基清除作用
參照CHEN等[12]的實驗方法,分別吸取 1 mL不同質量濃度的EPS樣品(1~5 mg/mL)于試管中,加入 1 mL 現配的 0.2 mmol/L DPPH無水乙醇溶液,混勻。室溫避光反應 30 min后于517 nm 處測定OD值,DPPH自由基清除率計算如公式(1)所示:
(1)
式中:A1為多糖樣品的OD值;A0為乙醇溶液代替DPPH溶液的OD值;A2為去離子水代替多糖樣品的OD值。
1.3.2.2 羥自由基清除作用
參照CHEN等[12]的實驗方法,分別吸取1 mL不同質量濃度的EPS樣品(1~5 mg/mL)于試管中,依次向管中加入各1 mL 的0.75 mmol/L 1,10-菲啰啉、0.75 mmol/L FeSO4、0.01%(體積分數)H2O2和0.15 mol/L pH 7.4的磷酸鈉緩沖液,混勻后于37 ℃反應1 h,測定混合液在536 nm處的OD值,羥自由基清除率計算如公式(2)所示:
(2)
式中:A1為多糖樣品的OD值;A2為去離子水代替多糖樣品的OD值;A0為去離子水代替多糖樣品和 H2O2的OD值。
1.3.3 細胞實驗
1.3.3.1 細胞培養
RAW264.7巨噬細胞復蘇后,加入DMEM完全培養基(含10%FBS、1%青霉素-鏈霉素和1%非必需氨基酸),置于37 ℃、5% CO2細胞培養箱中培養,待細胞生長至融合度達80%,用 0.25%胰酶消化細胞獲得細胞懸液用于后續實驗。
1.3.3.2 RAW264.7巨噬細胞活力的測定
調整細胞數量為5×105個/mL,以100 μL/孔接種于 96 孔板,37 ℃培養過夜后棄去培養液,PBS洗滌1次,每孔加入100 μL含不同質量濃度EPS(62.5、125、250、500 μg/mL)的DMEM完全培養基,以無 EPS的相同培養基為正常對照,只加完全培養基為空白對照,每組設4個復孔,培養 24 h后每孔加10 μL MTT溶液于 37 ℃避光孵育,4 h后吸掉上清液,加入150 μL DMSO振搖15 min,于490 nm處測定OD值,細胞活力計算如公式(3)所示:
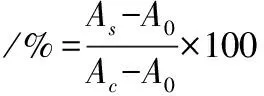
(3)
式中:A0為空白對照組 OD 值;Ac為正常對照組 OD 值;As為實驗組OD值。
1.3.3.3 RAW264.7巨噬細胞中NO含量的測定
RAW264.7巨噬細胞以5×105個/mL接種于96孔板,每孔100 μL,37 ℃培養過夜后棄去培養液。PBS洗滌1遍后,對照組和LPS組加入完全培養基,EPS組分別加入含不同質量濃度EPS(125、250、 500 μg/mL)的完全培養基,每組設3個復孔。培養箱中孵育2 h后,向LPS組和EPS組每孔加入10 μL的10 μg/mL LPS(使培養基中LPS終質量濃度為1 μg/mL)。繼續培養22 h后,取 50 μL上清液至96 孔板,加入 50 μL Griess試劑 A和試劑 B,在540 nm 處測定各孔 OD值,根據標準曲線計算每組NO含量。
1.3.3.4 RAW264.7巨噬細胞中抗氧化酶活性和MDA含量的測定
RAW264.7 巨噬細胞以5×105個/mL接種于6孔板, 37 ℃培養過夜后棄去培養液,分組及處理同 1.3.3.3。培養結束后棄去上清液,預冷PBS洗滌2次,每孔加入 200 μL 細胞裂解液,冰上反復吹打,于4 ℃、12 000 r/min 離心10 min收集各組細胞上清液。根據BCA 試劑盒說明書測定各組細胞蛋白濃度, CAT、SOD、GSH-Px和MDA的檢測均按照試劑盒說明進行。
1.3.3.5 RAW264.7巨噬細胞中氧化損傷相關基因表達的測定
RAW264.7 巨噬細胞以5×105個/mL接種于6孔板,分組及處理同 1.3.3.3。培養結束后,按照臧中昊[13]的方法裂解細胞提取總 RNA,根據RevertAid First Strand cDNA試劑盒合成cDNA,體系反應 37 ℃ 30 min、95 ℃ 5 min后,用 RT-PCR檢測mRNA表達,引物見表1。PCR反應條件:95 ℃ 預變性10 min;95 ℃ 15 s,60 ℃ 1 min,72 ℃ 30 s,循環40次。以甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)為內參基因,使用2-ΔΔCt法計算mRNA含量。

表1 PCR 引物序列Table 1 Sequences of PCR primers
1.3.4 EPS的單糖組成分析
參考WANG等[14]的方法采用離子色譜儀分析EPS的單糖組成,并稍作修改:采用CarboPac PA20 色譜柱(3 mm×150 mm),脈沖安培檢測器,流動相為H2O、15 mmol/L NaOH 和 100 mmol/L NaOAc,以進樣量5 μL、流速0.3 mL/min進行洗脫。配制10 mg/mL單糖標準品混合溶液,包括巖藻糖、鹽酸氨基半乳糖、鼠李糖、阿拉伯糖、鹽酸氨基葡萄糖、半乳糖、葡萄糖、N-乙酰-D-氨基葡萄糖、木糖、甘露糖和核糖。配制多糖溶液,取 10 mg EPS于安瓿瓶中,加入 10 mL 的3 mol/L三氟乙酸,120 ℃烘箱水解 3 h,待水解液冷卻后,氮氣(65 ℃)吹干,重復3次加入甲醇 3 mL用氮氣吹干以除盡三氟乙酸,再加入5 mL去離子水溶解多糖酸水解產物,稀釋10倍后12 000 r/min離心5 min,取上清液進樣分析。
1.3.5 數據處理
2 結果與分析
2.1 EPS的體外抗氧化活性
由圖1可知,在1~5 mg/mL內,DPPH自由基和羥自由基的清除率隨EPS質量濃度的增加而增加,存在劑量依賴關系。當質量濃度為5 mg/mL時,EPS對DPPH自由基和羥自由基的清除率分別為(64.19±1.03)%和(61.87±3.09)%。
與本研究相似,植物乳桿菌CNPC003胞外多糖在質量濃度為8 mg/mL時對DPPH自由基的清除率為51.52%[15];發酵乳桿菌S1胞外多糖在質量濃度為4 mg/mL 時對DPPH自由基和羥自由基的清除率分別為60.50%和61.67%[14]。在體外抗氧化實驗中,乳酸菌EPS通常表現出較強的清除自由基能力,推測可能是多糖碳氫鏈上的氫原子結合羥自由基生成水,從而達到清除羥自由基效果[16]。此外,多糖大分子自身具有的空間結構可對DPPH自由基或羥自由基產生包合作用,從而抑制自由基反應[17]。
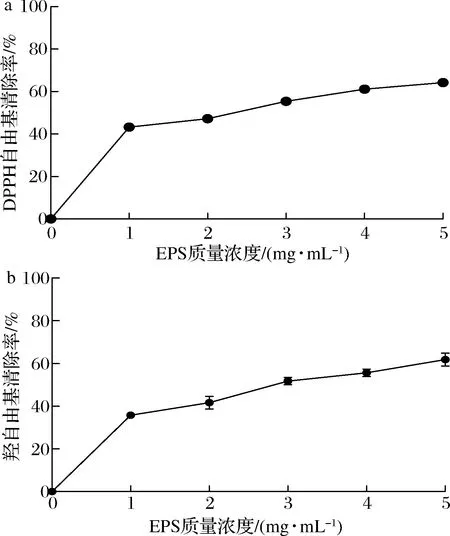
a-DPPH自由基清除率;b-羥自由基清除率圖1 EPS對DPPH自由基和羥自由基清除活性的影響Fig.1 Effect of EPS on DPPH and hydroxyl radical activity
2.2 EPS對RAW264.7 巨噬細胞活力的影響
如圖2所示,質量濃度為62.5~500 μg/mL的 EPS 作用細胞 24 h 后,與對照組相比,各組細胞活力沒有差異(P>0.05),表明EPS對RAW264.7細胞無毒性作用。因此,本研究選取125、250、500 μg/mL 3個質量濃度進行后續實驗。
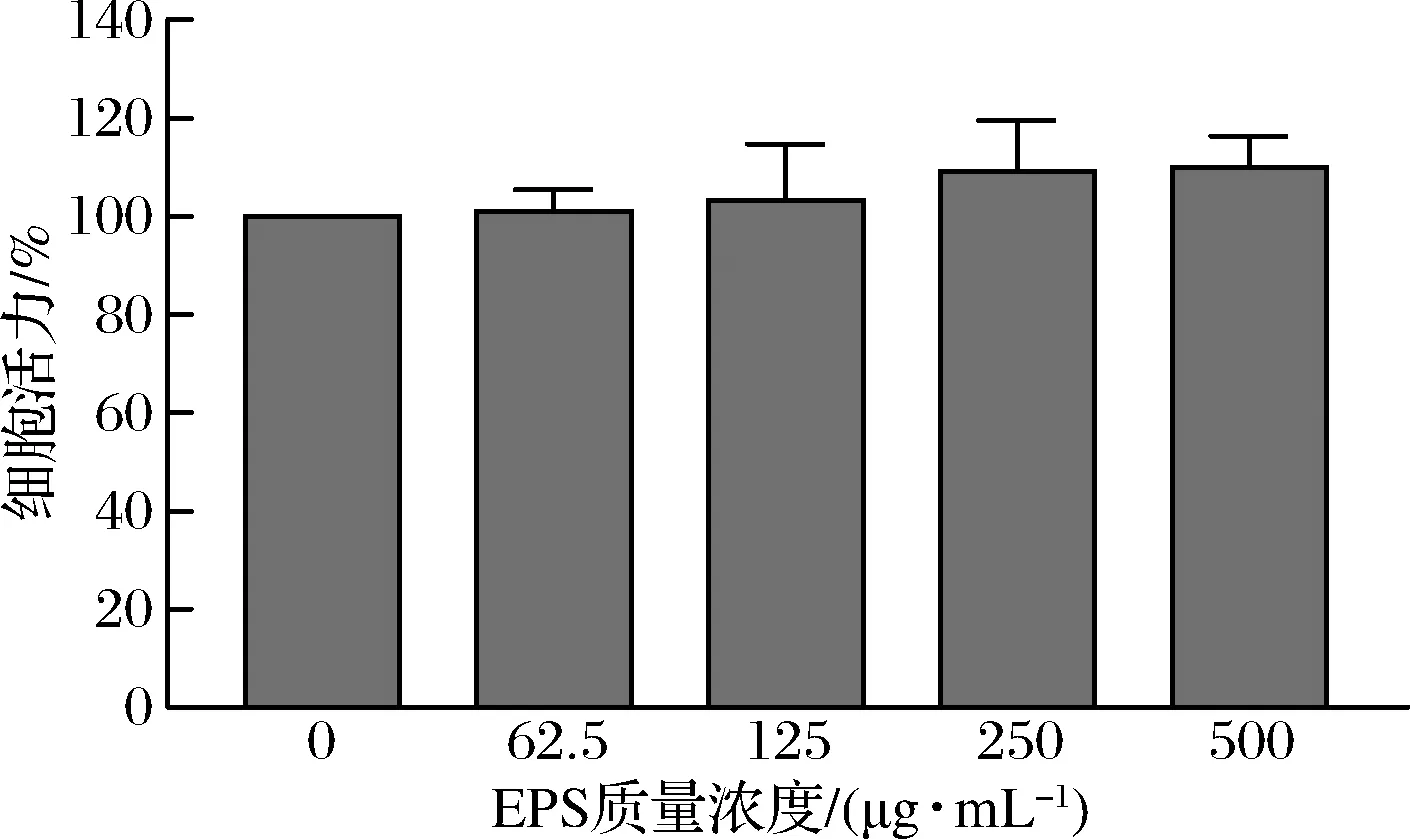
圖2 EPS 對 RAW264.7 巨噬細胞活力的影響Fig.2 Effect of EPS on the viability of RAW264.7 macrophages
2.3 EPS對RAW264.7巨噬細胞中抗氧化酶活力和MDA含量的影響
由圖3可知,與對照組相比,LPS處理使細胞內抗氧化酶SOD、CAT 和 GSH-Px的活力顯著下降,MDA 含量顯著增加(P<0.05),表明LPS可使細胞發生氧化損傷。與LPS損傷組相比,經EPS處理后細胞中SOD、CAT 和 GSH-Px 的活力均有所提升,而MDA的含量呈下降趨勢(P<0.05)。并且,3種抗氧化活力與EPS劑量呈正相關,而MDA的含量與EPS劑量呈負相關,這表明隨EPS濃度增加,細胞抗氧化酶活力提高,自由基清除能力增強,脂質過氧化物減少,LPS誘導的細胞氧化損傷減輕。
2.4 EPS對RAW264.7 巨噬細胞 中NO含量和炎癥基因表達的影響
根據圖4結果,與對照組相比,LPS誘導損傷的細胞中NO含量、iNOS、TNF-α、IL-1β和IL-6的mRNA表達量均顯著增加(P<0.05);與LPS處理組相比,經不同濃度的EPS干預后,細胞中NO 含量、iNOS、TNF-α、IL-1β和IL-6的mRNA表達量均明顯下降(P<0.05),而且,這種降低作用與EPS的劑量呈濃度依賴性關系。上述結果表明,EPS可通過降低NO含量和抑制炎癥基因表達,緩解LPS引起的細胞炎癥損傷。
2.5 EPS對RAW264.7 巨噬細胞氧化損傷的保護機制
為進一步研究EPS保護RAW264.7 細胞氧化損傷的作用機制,本研究采用RT-PCR檢測Nrf2/HO-1/NF-κB 通路相關基因的表達水平。如圖5所示,與對照組相比,LPS刺激使RAW264.7巨噬細胞中Nrf2、HO-1和IκB-α的mRNA表達顯著下降,而NF-κB的mRNA表達顯著上升(P<0.05);與LPS處理組相比,EPS的干預不僅顯著上調了Nrf2、HO-1和IκB-α的mRNA表達水平,還顯著下調了NF-κB的mRNA表達水平(P<0.05)。RAW264.7 巨噬細胞內Nrf2、HO-1和IκB-α的mRNA表達量與EPS劑量呈正相關,而NF-κB的mRNA表達量與EPS劑量呈負相關。結果表明,EPS對RAW264.7巨噬細胞氧化損傷的保護機制,可能與EPS激活Nrf2/HO-1通路,并抑制NF-κB通路有關。
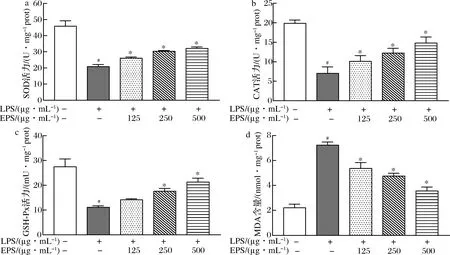
a-SOD活力;b-CAT活力;c-GSH-Px活力;d-MDA含量圖3 EPS對RAW264.7巨噬細胞中抗氧化酶活力和MDA含量的影響Fig.3 Effects of EPS on antioxidant enzymes activity and MDA content in RAW264.7 macrophages 注:與對照組相比,#表示P<0.05;與LPS損傷組相比,*表示P<0.05 (下同)
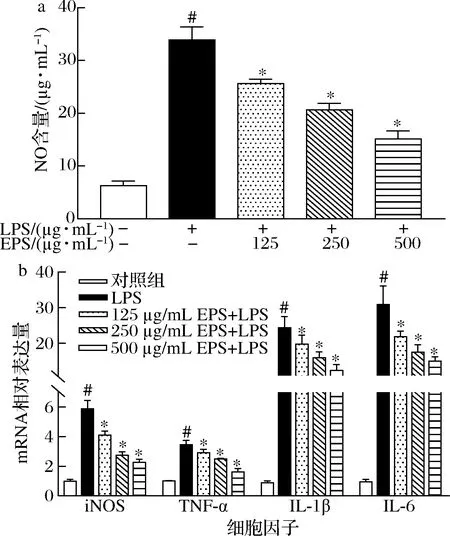
a-NO含量;b-iNOS、TNF-α、IL-1β和IL-6的mRNA相對表達量圖4 EPS對RAW264.7巨噬細胞中NO含量和炎癥 基因表達的影響Fig.4 Effects of EPS on NO content and inflammatory genes expression in RAW264.7 macrophages
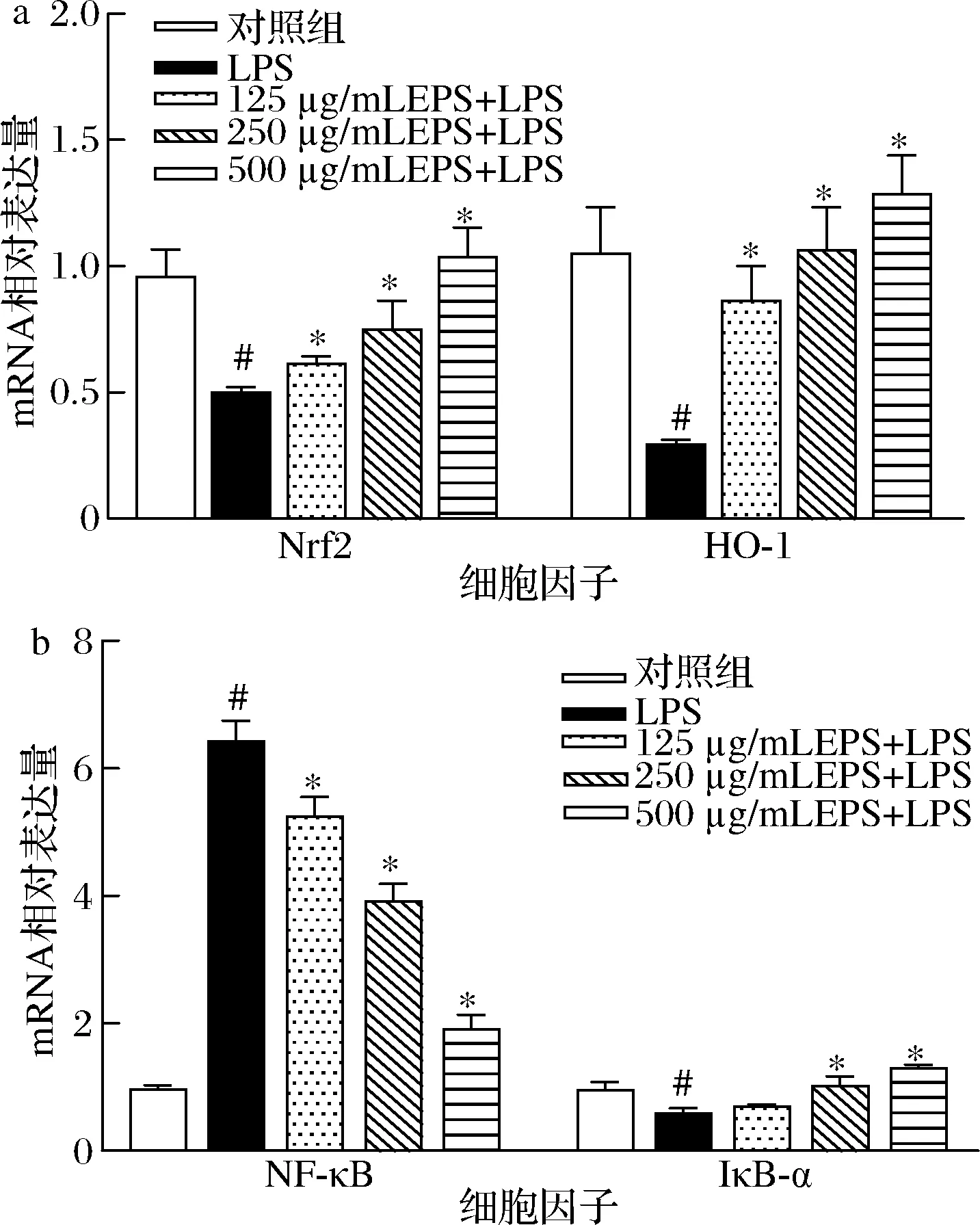
a-Nrf2和HO-1的mRNA相對表達量;b-NF-κB和IκB-α的 mRNA相對表達量圖5 EPS對RAW264.7巨噬細胞中Nrf2/HO-1/NF-κB 通路相關基因表達的影響Fig.5 Effects of EPS on the expression of Nrf2/HO-1/NF-κB signaling-related genes in RAW264.7 macrophages
2.6 EPS的單糖組成
圖6為單糖標準品(圖6-a)和 EPS(圖6-b)的離子色譜圖。結合圖6-a和圖6-b可知,EPS由鹽酸氨基葡萄糖、半乳糖、葡萄糖和甘露糖組成,摩爾比為2.48∶10.26∶50.22∶8.16。
乳酸菌胞外多糖通常由葡萄糖、甘露糖、半乳糖、鼠李糖及少量糖單元衍生物組成[10]。半乳糖、葡萄糖和甘露糖均含有醛基,容易被自由基氧化降解,使多糖具有抗氧化活性[18]。并且,多糖的抗氧化活性與葡萄糖、甘露糖含量呈顯著正相關[19]。與本研究相似,瑞士乳桿菌MB2-1的胞外多糖由半乳糖、葡萄糖和甘露糖組成,對DPPH自由基、羥自由基和超氧陰離子自由基均有較強清除作用[20];動物雙歧桿菌RH的胞外多糖主要由摩爾比為43∶34∶18∶4∶1∶1的葡萄糖、甘露糖、半乳糖、阿拉伯糖、果糖和鼠李糖組成,在抗氧化實驗中表現出較強的羥自由基和超氧陰離子自由基清除活性[21]。由此推斷,本研究中EPS的抗氧化活性與半乳糖、葡萄糖和甘露糖的存在及比例有關。
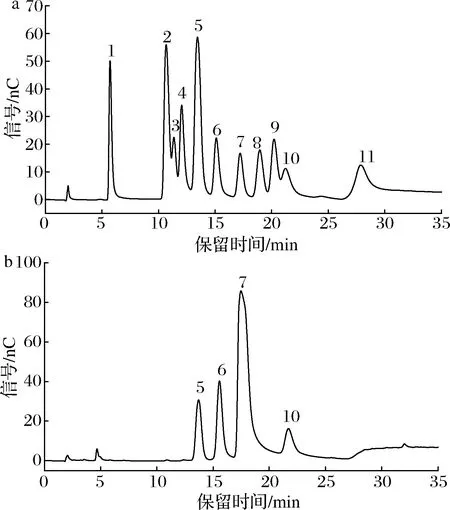
1-巖藻糖;2-鹽酸氨基半乳糖;3-鼠李糖;4-阿拉伯糖; 5-鹽酸氨基葡萄糖;6-半乳糖;7-葡萄糖;8-N-乙酰-D-氨基葡萄糖; 9-木糖;10-甘露糖;11-核糖 a-單糖標準品的離子色譜圖;b-EPS的離子色譜圖圖6 單糖標準品和 EPS離子色譜圖Fig.6 The ion chromatograms of monosaccharides standard and EPS
3 結論與討論
巨噬細胞作為免疫細胞,在機體受到病理刺激時發揮免疫應答作用,消除外界應激源或誘導劑造成的不良影響。LPS 是革蘭氏陰性菌外膜的主要成分,具有毒性,可促使巨噬細胞分化產生炎癥介質(如NO)和細胞因子(如TNF-α、IL-1β和IL-6等),常用于研究氧化應激與炎癥反應[5]。因此,本實驗采用LPS誘導RAW264.7巨噬細胞建立氧化損傷模型,研究EPS對RAW264.7巨噬細胞氧化損傷的保護作用及機制。
已有研究證明,抗氧化酶活力的高低和MDA的水平可反映細胞氧化損傷的程度[22]。抗氧化酶SOD、CAT和GSH-Px 是細胞抗氧化防御體系中的重要組成部分,可通過清除體內的過量自由基和脂類過氧化物,保護生物膜結構和功能的完整性,從而減輕細胞氧化損傷[23];MDA是脂質過氧化反應的終產物之一,它具有細胞毒性,可誘使蛋白質、核酸等大分子物質發生交聯聚合,使細胞出現異常分裂和癌變,最終導致細胞退化、引發疾病[24]。本實驗中,EPS顯著提高RAW264.7巨噬細胞內SOD、CAT和GSH-Px活性,并降低MDA含量,表明EPS對RAW264.7巨噬細胞的氧化應激反應具有抑制作用。炎癥反應與氧化應激密切相關,LPS刺激可使RAW264.7巨噬細胞發生氧化應激,產生過量活性氧及炎癥介質,誘導 iNOS 高度表達[13]。iNOS 是NO的上游激酶,通過調控NO的合成參與炎癥反應[25]。NO是炎癥反應中發揮重要作用的促炎因子,過量的NO可導致DNA損傷,誘導凋亡和氧化應激,最終加劇機體炎癥,其分泌量可間接反映炎癥程度[26-27]。TNF-α產生于炎癥初期,它能刺激細胞產生炎癥因子(如IL-1β和IL-6),使機體發生炎癥,增加誘發類風濕性關節炎、哮喘和炎癥性腸病的風險[26, 28]。本研究中,EPS降低了RAW264.7 巨噬細胞內NO含量,并抑制了TNF-α、IL-1β和IL-6的mRNA表達,表明EPS對RAW264.7巨噬細胞的炎癥反應具有抑制作用。
Nrf2是調控氧化應激的關鍵因子,一方面,它通過激活SOD、CAT和GSH-Px等抗氧化酶增強組織抗氧化能力[22];另一方面,其可誘導HO-1的表達,HO-1能有效清除自由基,通過激活抗凋亡蛋白抑制過氧化反應[29]。正常情況下,NF-κB和IκB-α以復合物形式存在于細胞內;當細胞受到氧化應激刺激時,IκB-α發生磷酸化與降解,使NF-κB解離并被激活,進而促進多種炎癥介質的產生,引起炎癥反應[3]。本實驗結果顯示,RAW264.7巨噬細胞經EPS處理后,細胞內Nrf2、HO-1和IκB-α的mRNA表達量均上升,而NF-κB的mRNA表達量下降,提示EPS的抗炎抗氧化作用可能與Nrf2/HO-1/NF-κB通路有關,這與前人的研究結果一致[30]。
上述分析表明,發酵乳桿菌LFQ153EPS能夠有效緩解LPS誘導的RAW264.7巨噬細胞氧化損傷,并且這種保護作用可能與與Nrf2/HO-1/NF-κB通路的調節有關。此外,對EPS的單糖分析表明,EPS的抗氧化活性還與半乳糖、葡萄糖和甘露糖的存在及比例有關。綜上,本研究可為功能性發酵乳桿菌LFQ153胞外多糖的進一步開發利用提供理論依據。

