基于GFAP/STAT3通路探討針康法對腦缺血再灌注大鼠神經功能和星形膠質細胞的影響
孔妍 鄒偉 關睿騫 劉雙嶺 陳奧 崔乃松
缺血性腦卒中屬“中風病”范疇,最早見于《內經》中“卒中”“薄厥”等[1],是由于腦血流供應不足導致局部腦組織缺血、缺氧引發的急性腦功能障礙性疾病,該病具有“四高一多”的特點,即發病率高、致殘率高、致死率高及并發癥多[2],嚴重威脅到人類的生命健康。缺血性腦卒中占全部腦卒中類型的60%~80%,治愈率極低,且越來越趨于年輕化[3],如何針對本病給予及時有效的治療干預,減輕卒中后的各種神經和肢體功能障礙,一直是臨床醫師研究關注的重點問題。近年來,將中醫治療手段與現代康復技術相結合用于臨床各種功能障礙的治療,已取得了長足進展,其中以針灸和現代康復技術結合應用最為廣泛[4-5]。針康法是將頭穴叢刺法與康復訓練同步結合進行的一種治療方法,較之單一治療手法能夠更大限度地發揮二者的優勢,達到療效最大化[6],已在臨床廣泛應用于腦卒中的康復治療[7-8]。研究發現,缺血性卒中后星形膠質細胞的激活和反應性膠質化,能夠觸發級聯炎癥反應和膠質癱痕生成,從而加重缺血性神經功能損傷[9-10]。本實驗擬通過研究針康法對局灶性腦缺血再灌注模型(middle cerebral artery occlusion,MCAO)大鼠神經功能及膠質纖維酸性蛋白(glial fibrillary acidic protein,GFAP)/信號傳導及轉錄激活蛋白(signal transducer and activator of transcription 3,STAT3)通路的影響,探討針康法干預星形膠質細胞活化保護神經功能的相關作用機制。
1 材料與方法
1.1 實驗動物
SPF級健康雄性SD大鼠,體質量(250±20)g,購于黑龍江中醫藥大學GLP實驗動物中心,實驗動物使用許可證號:SYXK(黑)-2016-004,并經黑龍江中醫藥大學實驗動物倫理委員會批準(批準號JZLLSC2019-0160)。于12小時/12小時晝夜循環交替,溫度20~22℃,濕度50%~60%實驗環境下,適應性喂養1周,維持自由進食、飲水。
1.2 實驗試劑
山羊血清封閉液、TBST溶液、蘇木素染液(國藥集團化學試劑有限公司,批號:191002/S200201/200102);辣根過氧化物酶、ECL化學發光試劑,Trizol試劑盒,逆轉錄試劑盒(Sigma-Aldrich公司,批號:191101/020115/200403/200211);DAB 顯色試劑盒、BCA 蛋白含量檢測試劑盒(南京建成生物工程研究所,批號:026-01-04/2020-01-02);鼠抗GFAP、表皮生長因子受體(epithelial growth factor receptor,EGFR)抗體、山羊抗兔IgG 二抗(Abcam公司,批號:K200302/K200106/200205);鼠抗抗體-磷酸化蛋白質激酶(phospho-Janus kinase 1,p-JAK1)、p-STAT3抗體(Santa Cruz公司,批號:sc-200106/sc-200504)。
1.3 實驗儀器
Sorvall Stratos冷凍高速離心機(美國Thermo公司,型號208V);Stuart 組織勻漿器(英國Bibby-Stuart公司,型號SHM2);Leica光學顯微鏡(德國 Leica公司,型號DMi8);紫外可見分光光度計(METTLER TOLEDO公司,型號UV5);SDS-PAGE凝膠電泳儀(美國Bio-rad公司,型號:165-8029);Invitrogen iBright凝膠智能成像系統(美國Thermo公司,型號CL1000);實驗室大鼠恒溫箱(FU.YI.LIAN公司,型號FYL-YS-280L)。
1.4 分組與造模
90只SD大鼠隨機分為假手術組、模型組、針刺組、康復組、針康組共 5組,每組各18只。模型組和各治療組均采用Longa改良線栓法建立大鼠MCAO模型[11]:大鼠稱重后以10%水合氯醛(300 mg/kg)腹腔注射麻醉,仰臥位固定于手術臺上,常規消毒頸部皮膚,取頸部正中部位切口,鈍性分離右側頸總動脈和頸外動脈,動脈夾夾閉頸內動脈,在頸總動脈近心端與頸外動脈處用縫合線結扎,在頸外動脈分叉處做一直徑約0.20 mm的V型切口,將線栓自切口處導入動脈管腔,在插入線栓的同時松開動脈夾,線栓插至深度約(18.50±0.50)mm處,遇明顯阻力時停止,造成大鼠腦缺血,在缺血90分鐘后將線栓拉出進行再灌注。假手術組不進行血管結扎及線栓導入,其他操作相同。于大鼠麻醉清醒后采用Zea-Longa’s級標準評分法對大鼠進行神經功能評分,評分為1~3分即為造模成功,可進行下一步實驗。
1.5 干預方法
(1)針刺組:于造模后第2日開始給予頭穴叢刺法干預治療,參考《實驗動物穴位圖譜》取百會穴及百會左、右側各旁開2 mm處(頂區)作為刺激區,以華佗牌針灸針(0.25 mm×25 mm)向前平刺至頂前區,深度0.5寸,快速捻轉(頻率200轉/分鐘)5分鐘后留針6小時,留針期間每1小時捻轉一次,每次5分鐘,每日針刺1次。(2)康復組:各組大鼠均于造模前給予適應性跑臺訓練3天,康復組大鼠于造模后第2日開始給予跑臺訓練,均為每次30分鐘,每日1次。采用五跑道電動跑臺,設定跑臺斜度為0°,跑臺履帶不斷向后傳輸,履帶尾部帶有電柵欄,為避免電柵欄的電擊,大鼠需不斷自主向前奔跑,履帶傳輸速度:術前3天為12 m/分鐘,術后第1日為5 m/分鐘,術后第2日為8 m/分鐘,第3日及以后為12 m/分鐘。(3)針康組:于造模后第2日開始給予頭穴叢刺法結合跑臺康復訓練。(4)假手術組、模型組:造模后不給予任何干預治療,僅放回籠中正常飼養。
1.6 觀察指標
1.6.1 神經功能評分 (1)Zea-Longa’s級標準評分[12]:采用Zea-Longa’s級標準評分法分別于治療第6小時、3天、7天、14天對大鼠進行神經功能評分,評分按照0~4分五級評分:0分為行為正常,無神經功能缺損癥狀;1分為提尾時左前肢屈曲;2分為行走時左前肢屈曲并軀體自發性向左轉圈;3分為軀體左側偏癱;4分為意識障礙,無法自發行走,分值越高表示神經功能損傷越嚴重。(2)mNSS評分[13]:采用改良神經功能缺損評分(mNSS評分)分別于治療第6小時、3天、7天、14天對大鼠神經功能進行評價,該評分法包括運動、感覺、平衡功能及反射水平等多個方面的測評,能夠全面反映出腦缺血大鼠的神經功能損傷情況,總分為18分,分值越高表示神經功能損傷越嚴重,其中0~6分為輕度損傷;7~12 分為中度損傷;13~18分為重度損傷。
1.6.2 免疫組化法檢測腦組織GFAP、EGFR陽性表達 神經功能評分后,腹腔麻醉大鼠,迅速開胸暴露心臟,采用4 ℃,0.9%生理鹽水和4%多聚甲醛溶液依次心臟灌注,待大鼠死亡后斷頭取腦,將腦組織置于4%多聚甲醛溶液中固定處理,常規脫水,石蠟包埋切片,在3% H2O2中室溫孵育10分鐘,微波抗原修復,血清封閉30分鐘,滴加稀釋的一抗,4℃保存過夜,PBS沖洗3次×2分鐘,滴加稀釋的二抗,37℃孵育30分鐘,PBS沖洗3次×2分鐘,DAB顯色,蘇木素復染,常規脫水、透明、中性樹膠封片,置顯微鏡下觀察,每組隨機選取5個高倍鏡(×400)下視野,采用Image-pro plus 6.0圖像分析系統對陽性表達進行分析,以陽性細胞計數代表蛋白表達量。
1.6.3 WB檢測腦組織P-JAK1、P-STAT3蛋白表達 神經功能評分后,同“1.6.2”方法心臟灌注處死大鼠后斷頭取腦,腦組織以4 ℃,0.9 %生理鹽水清洗干凈,研磨粉碎,加入足量新鮮配制的蛋白裂解液,4℃下勻漿處理30分鐘,12000 r/分鐘高速離心10分鐘,取上清液,BCA 法測定蛋白濃度。10% SDS-PAGE凝膠電泳分離蛋白,PVDF轉膜,5%脫脂牛奶室溫封閉1小時,TBST 洗膜后,滴加稀釋的一抗(1∶500),4 ℃孵育過夜,TBST洗膜后,滴加辣根過氧化物酶標記的二抗(1∶1000),室溫孵育1小時,TBST洗膜后,ECL顯色、曝光,以GAPDH為內參,采用Image J凝膠成像分析系統對電泳圖像進行分析,以各目的蛋白與GAPDH的光密度比值代表蛋白的相對表達量。
1.6.4 RT-PCR檢測腦組織GFAP、EGFR mRNA水平 神經功能評分后,同“1.6.2”方法心臟灌注處死大鼠后斷頭取腦,腦組織以Trizol 法提取總RNA,紫外分光光度法檢測總RNA濃度。采用逆轉錄試劑盒獲得 cDNA后進行PCR擴增反應,反應程序為:95℃預變性3分鐘,變性30秒;62℃退火30秒;72℃延伸30秒,共40個循環。以GAPDH為內參,采用Invitrogen iBright凝膠成像分析系統對電泳圖像進行分析,以2-△△Ct值計算蛋白的相對表達量。PCR引物序列由上海生工生物工程有限公司設計合成,見表1。

表1 引物序列
1.7 統計學方法
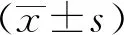
2 結果
2.1 Zea-Longa’s級標準評分比較
模型組和各治療組大鼠在不同時間點的Zea-Longa’s級標準評分均較假手術組明顯增加(P<0.05),各組Zea-Longa’s級標準評分隨時間呈現下降趨勢;其中,各治療組大鼠在第3天、7天、14天時的Zea-Longa’s級標準評分均較模型明顯降低(P<0.05)。見表2。
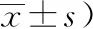
表2 各組MCAO大鼠Zea-Longa’s級評分比較(分,ˉ
2.2 mNSS評分比較
模型組和各治療組大鼠在不同時間點的mNSS評分均較假手術組明顯增加(P<0.05),各組mNSS評分隨時間呈現下降趨勢,其中,各治療組大鼠在第3天、7天、14天時的mNSS評分均較模型組明顯降低(P<0.05),針康組在第6小時的mNSS評分亦較模型組明顯降低(P<0.05)。見表3。
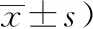
表3 各組MCAO大鼠mNSS評分比較(分,
2.3 腦組織GFAP、EGFR陽性表達
免疫組化結果可見,模型組和各治療組大鼠腦組織GFAP、EGFR陽性細胞計數均較假手術組明顯增多(P<0.05);各治療組大鼠腦組織GFAP、EGFR陽性細胞計數均較模型組明顯減少(P<0.05),且以針康組陽性細胞計數為最低。見表4、圖1。

表4 各組MCAO大鼠腦組織GFAP、EGFR陽性細胞計數比較(個

圖1 各組MCAO大鼠腦組織GFAP、EGFR陽性表達(DBA,×400)
2.4 腦組織P-JAK1、P-STAT3蛋白表達
WB結果可見,模型組和各治療組大鼠腦組織P-JAK1、P-STAT3蛋白表達均較假手術組明顯增加(P<0.05);干預后,各治療組大鼠腦組織P-JAK1、P-STAT3蛋白表達均較模型組明顯降低(P<0.05),且以針康組為最低。見表5、圖2。

圖2 各組MCAO大鼠腦組織P-JAK1、P-STAT3蛋白表達
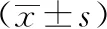
表5 各組MCAO大鼠腦組織P-JAK1、P-STAT3蛋白表達
2.5 腦組織GFAP、EGFR mRNA水平
RT-PCR結果可見,模型組和各治療組大鼠腦組織GFAP、EGFR mRNA水平均較假手術組明顯增加(P<0.05);干預后,各治療組大鼠腦組織GFAP、EGFR mRNA水平均較模型組明顯降低(P<0.05),且以針康組為最低。見表6。
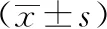
表6 各組MCAO大鼠腦組織GFAP、EGFR mRNA水平比較
3 討論
缺血性腦卒中歸屬于中醫學“中風”“卒中”“薄厥”等范疇,本病病位在頭部,為人體經氣匯聚之所,《靈樞·五亂》記載“氣亂于頭則為厥逆, 頭重眩仆……取之天柱。”可見,頭部穴位與人體臟腑器官及經絡氣血功能有著密切聯系[14]。頭穴叢刺取頭頂區百會穴及左、右側各旁開2 mm處,主要對應大腦中央前回、中央后回及旁中央小葉等區域,配合長留針、間斷捻轉手法,尤適用于腦卒中后運動、感覺障礙的治療[15]。針康法是頭穴叢刺法與現代康復治療的有機結合,即在頭穴叢刺長留針期間,同步進行各種運功康復訓練[16],臨床用于腦卒中的治療,療效確切,其核心治療思想為“針康同步、動態治療、整體康復”,其中,頭穴叢刺法可通過針刺效應透過顱骨,直接刺激大腦皮質,作用于責任病灶;康復訓練則作用于四肢,通過多次重復康復運動,間接刺激中樞神經系統,提高腦神經元功能可塑性,促進受損神經功能恢復,二者雙向調節、同步作用,以實現療效最大化[17-18]。
近年來,關于針康法干預治療腦缺血再灌注損傷的機制研究屢見報道,如針康法可能通過促進腦缺血區域皮質突觸可塑性,降低腦缺血后神經細胞損傷,加速神經功能重建[19];其可通過下調Caspase-3 mRNA和蛋白,抑制海馬神經元凋亡,促進腦卒中后神經功能恢復[20];或可上調腦缺血區皮質微血管計數及海馬SDF-1A mRNA表達,參與血管內皮細胞遷移和增殖,降低腦缺血再灌注后神經損傷[21],然而,關于針康法干預星形膠質細胞活化改善腦缺血再灌注損傷的機制研究目前尚未見報道。研究發現,星形膠質細胞作為中樞神經系統中數量最多的細胞,在腦缺血狀態下,發揮著雙重作用[22-24]:一方面,腦缺血后星形膠質細胞能夠迅速活化為反應性星形膠質細胞,通過分泌神經營養因子、促紅細胞生成素及谷胱甘肽等抗氧化物質,發揮神經保護作用;另一方面,活化后的星形膠質細胞可通過分泌多種炎癥介質、興奮性氨基酸、細胞毒性因子等物質進一步損傷腦神經。同時,星形膠質細胞過度增生形成的膠質瘢痕,可壓迫局部腦組織,抑制微血管生成,阻礙局部腦血流恢復,進一步加重腦組織缺血缺氧情況[25]。GFAP是星形膠質細胞的特異性標志蛋白,能夠反應出星型膠質細胞的反應性和重塑性[26]。EGFR是一種酪氨酸激酶型受體,廣泛分布于活化的星形膠質細胞中,能夠反映出星形膠質細胞的分化與增殖情況[27]。腦卒中后,GFAP、EGFR在星形膠質細胞中均呈現高表達,且與神經功能損傷程度密切相關[28]。STAT3 是信號轉導子和轉錄激活子(STAT)家族成員之一,在活躍狀態下可與 GFAP 啟動子位點結合,誘導酪氨酸快速磷酸化,促進星形膠質細胞的活化、增生[29]。STAT3同時是 EGFR下游的重要效應分子之一,其可通過與細胞表面受體結合后誘導受體上的酪氨酸殘基磷酸化和核轉位,進而刺激星形膠質細胞活化,加速神經細胞損傷[30]。由此可見,對腦卒中后星形膠質細胞的活化機制進行深入研究,抑制其活化和反應性膠質化,對于改善腦卒中后繼發性腦損傷,促進神經功能恢復具有重要的意義。
本研究采用針康法干預治療MCAO大鼠,通過研究該方法對腦卒中后神經功能及GFAP/STAT3通路的影響,探討針康法干預星形膠質細胞活化發揮神經保護作用的相關作用機制,也為臨床尋找治療缺血性腦卒中的新作用靶點和治療方案提供數據支持。結果顯示,治療干預后,針刺組、康復組和針康組大鼠的的Zea-Longa’s級標準評分和mNSS評分在第3天、7天、14天時均較模型組明顯降低(P<0.05),且各組評分均隨時間呈現下降趨勢。免疫組化和RT-PCR結果可見,各治療組大鼠在干預治療后的腦組織GFAP、EGFR陽性細胞計數和mRNA水平均較模型組明顯減少(P<0.05),且以針康組為最低。WB結果可見,各治療組大鼠在干預治療后的腦組織P-JAK1、P-STAT3蛋白表達均較模型組明顯降低(P<0.05),且以針康組為最低。研究結果提示:針康法能夠明顯改善MCAO大鼠神經功能損傷,并降低缺血腦組織GFAP、EGFR、P-JAK1、P-STAT3等蛋白及基因表達。
綜上所述,針康法干預治療腦缺血再灌注大鼠能夠有效改善神經功能損傷,該作用機制可能是通過調控GFAP/STAT3通路抑制星形膠質細胞活化實現的。

