非甾體類抗炎藥相關性上消化道出血的危險因素及凝血相關指標分析
鄧園園, 黃應文, 熊 紅, 盧水煥, 周先寶, 賀學強
(中國人民解放軍聯勤保障部隊第九二四醫院 消化科, 廣西 桂林, 541000)
非甾體類抗炎藥(NSAIDs)是指無甾體結構的抗炎藥物,包括阿司匹林、雙氯芬酸、塞來昔布等,已被廣泛應用于抗凝血、抗炎、止痛、抗風濕、抗癌等方面[1]。然而,長期服用NSAIDs的患者具有較高的胃腸道反應發生風險,其中10%~25%患者可出現消化性潰瘍,約1%患者可出現消化道出血甚至穿孔等嚴重并發癥,嚴重時將危及生命[2]。研究[3]表明,消化道出血患者常見凝血功能異常,且常伴有胃黏膜糜爛或消化性潰瘍等表現,故推測NSAIDs相關性上消化道出血可能與NSAIDs致胃腸道黏膜損傷和抗血小板聚集與黏附等作用有關。本研究觀察NSAIDs相關性上消化道出血患者的凝血相關指標變化,并分析可能的危險因素,以期為NSAIDs的科學用藥和消化道出血的防治提供參考依據。
1 資料與方法
1.1 一般資料
選取2019年10月—2021年5月中國人民解放軍聯勤保障部隊第九二四醫院收治的108例NSAIDs相關性上消化道出血患者設為出血組,另選取同期服用NSAIDs但未發生上消化道出血的108例門診復查患者設為非出血組。本研究經醫院倫理委員會審核批準,且患者和(或)家屬均簽署知情同意書。
納入標準: ① 入院前有長期服用NSAIDs史或短期維持NSAIDs治療史者,且出血組患者用藥期間或用藥后出現出血癥狀; ② 出血組患者均因腹痛、黑便或嘔血等癥狀就診,糞便隱血檢查呈陽性,內鏡檢查可見胃腸黏膜出血斑點或糜爛等,符合《內科學》[4]中關于消化道出血的診斷標準; ③自愿參與本研究并能配合臨床檢查及評估者。排除標準: ① 呼吸系統疾病所致出血者; ② 合并血管畸形、消化系統腫瘤、肝硬化及食管胃底靜脈曲張破裂等因素所致出血者; ③ 飲食因素所致黑便者; ④ 合并肛裂、痔瘡、炎性腸病者; ⑤ 消化道相關手術所致出血者; ⑥ 未接受內鏡檢查者; ⑦ 先天性凝血功能缺陷患者,既往有血液系統疾病或其他可能影響凝血功能疾病的患者。
1.2 方法
1.2.1 資料收集: 統計2組患者的年齡、性別、吸煙史、飲酒史、幽門螺桿菌(Hp)感染情況、基礎疾病(高血壓、高脂血癥、糖尿病、冠心病、腦血管疾病、慢性胃炎、貧血)、服用NSAIDs種類、NSAIDs用藥時間、聯合用藥[質子泵抑制劑(PPI)、胃黏膜保護劑、氯吡格雷、利尿劑、鈣通道拮抗劑(CCB)、β腎上腺素受體阻斷劑、血管緊張素轉換酶抑制劑(ACEI)、血管緊張素Ⅱ受體阻斷劑(ARB)、口服降糖藥物二甲雙胍]情況等。有吸煙史指吸煙頻率≥10支/d, 吸煙時間>1年; 有飲酒史指飲酒量≥100 mL/d, 飲酒時間≥1年; Hp感染情況根據14C呼氣試驗結果診斷。
1.2.2 實驗室指標檢測: 所有受試者入院后均急查實驗室指標,或空腹8 h以上于次日清晨8: 30—9: 30采集空腹靜脈血4.0 mL, 采用全自動凝血儀檢測凝血功能指標[活化部分凝血活酶時間(APTT)、凝血酶時間(TT)、凝血酶原時間(PT)、纖維蛋白原(Fib)、D-二聚體(D-D)和血小板(PLT)]水平,常規檢測操作均由固定檢驗人員嚴格按照試劑說明書執行。
1.3 統計學分析
2 結 果
2.1 上消化道出血患者的臨床癥狀與體征
出血組108例上消化道出血者中, 71例出現黑便、47例出現嘔血(有10例患者兼有黑便、嘔血), 49例伴有腹脹、腹痛等腹部癥狀。本組患者的NSAIDs服用量均在說明書推薦的安全劑量范圍內。
2.2 一般資料比較
2組性別分布情況比較,差異無統計學意義(P>0.05); 出血組年齡≥60歲者、有吸煙史者、有飲酒史者占比均高于非出血組,差異有統計學意義(P<0.05)。見表1。

表1 2組患者一般資料比較
2.3 Hp感染及基礎疾病情況比較
出血組合并Hp感染、冠心病、腦血管病及慢性胃炎者占比高于非出血組,差異有統計學意義(P<0.05或P<0.01); 出血組合并高血壓、糖尿病、高脂血癥、貧血者占比與非出血組比較,差異無統計學意義(P>0.05)。見表2。
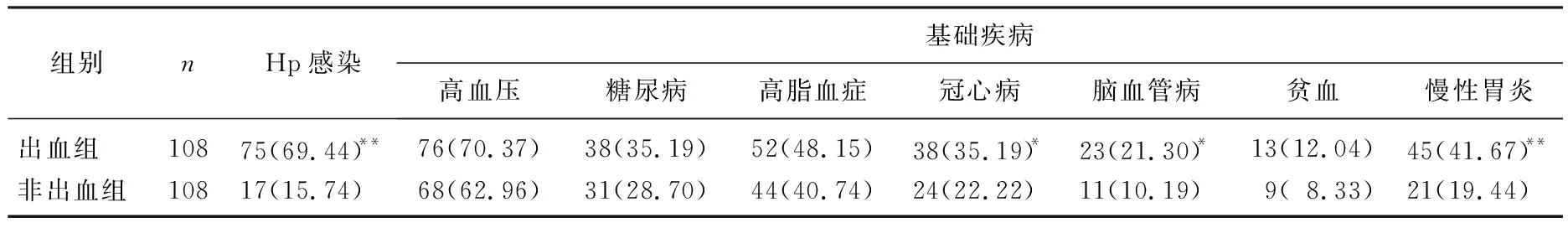
表2 2組患者Hp感染及基礎疾病情況比較[n(%)]
2.4 用藥情況比較
出血組NSAIDs用藥時間>12個月者占比、阿司匹林用藥率、≥2種NSAIDs聯用率以及氯吡格雷、螺內酯用藥率均高于非出血組, NSAIDs用藥時間<1個月者占比、布洛芬用藥率、雙氯芬酸鈉用藥率、PPI用藥率、胃黏膜保護劑用藥率均低于非出血組,差異有統計學意義(P<0.05或P<0.01); 2組其余用藥情況比較,差異無統計學意義(P>0.05)。見表3。
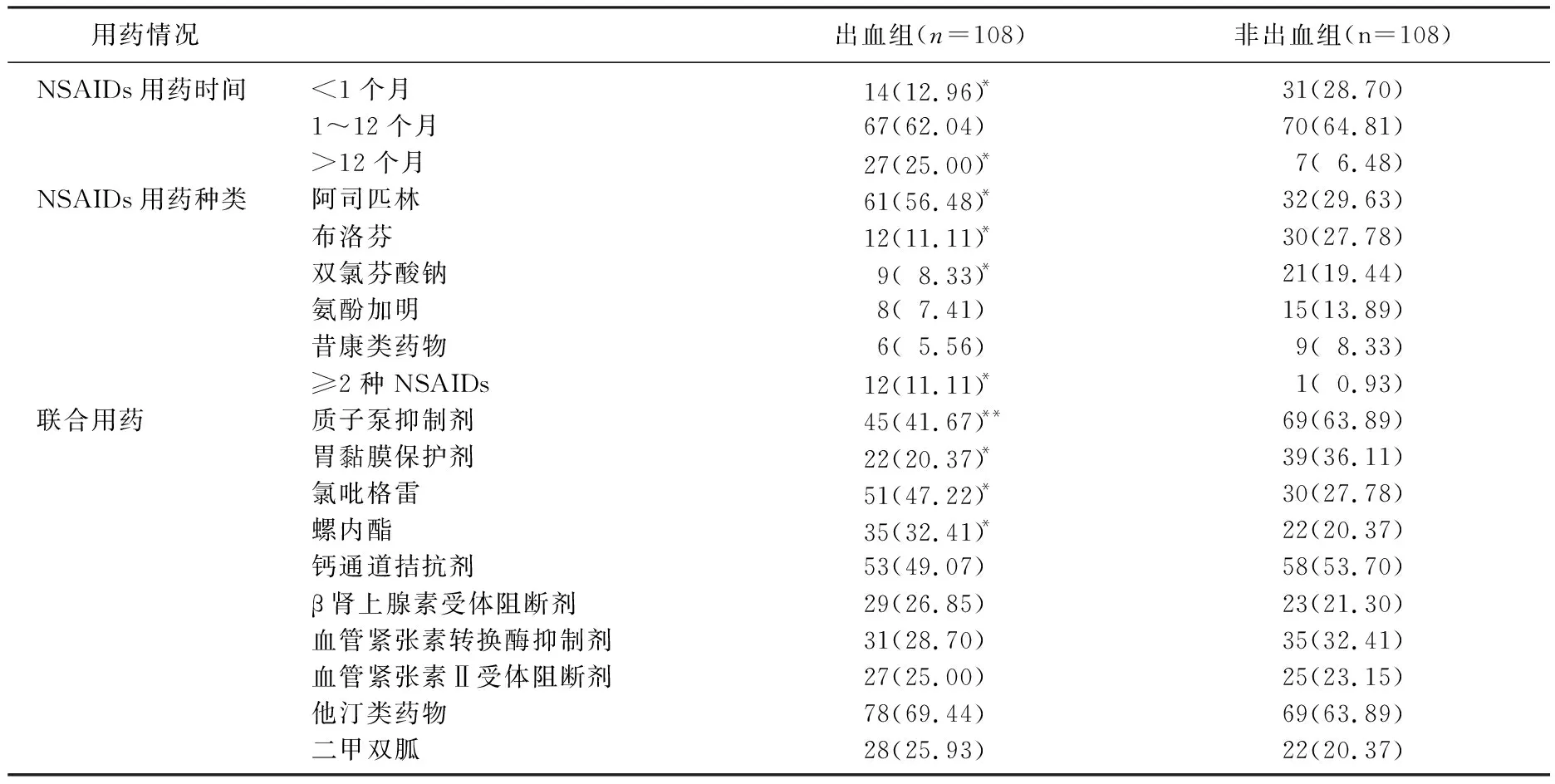
表3 2組患者用藥情況比較[n(%)]
2.5 凝血指標比較
2組PT、TT、APTT、Fib、D-D、PLT比較,差異均無統計學意義(P>0.05), 見表4。

表4 2組凝血指標比較
2.6 非條件多因素Logistic回歸分析
以單因素分析中差異具有統計學意義(P<0.05)的指標為自變量,以消化道出血為因變量,進行非條件多因素Logistic回歸分析。自變量賦值情況: 年齡, <60歲=1, ≥60歲=2; 吸煙,否=0, 是=1; 飲酒,否=0, 是=1; Hp感染,否=0, 是=1; 冠心病,否=0, 是=1; 腦血管病,否=0, 是=1; 慢性胃炎,否=0, 是=1; 用藥時間, <1個月=1, 1~12個月=2, >12個月=3; 用藥種類,聯合用藥=3, 阿司匹林=2, 其他=1; 螺內酯,否=0, 是=1; 氯吡格雷,否=0, 是=1; PPI, 否=0, 是=1。
非條件多因素Logistic回歸分析結果顯示,使用PPI和使用胃黏膜保護劑是NSAIDs相關性上消化道出血的獨立保護因素(P<0.05或P<0.01), 高齡、吸煙、飲酒、合并Hp感染、冠心病、腦血管病、慢性胃炎和服用阿司匹林、服用≥2種NSAIDs、NSAIDs用藥時間長、聯用螺內酯、聯用氯吡格雷是NSAIDs相關性上消化道出血的獨立危險因素(P<0.05或P<0.01)。見表5。
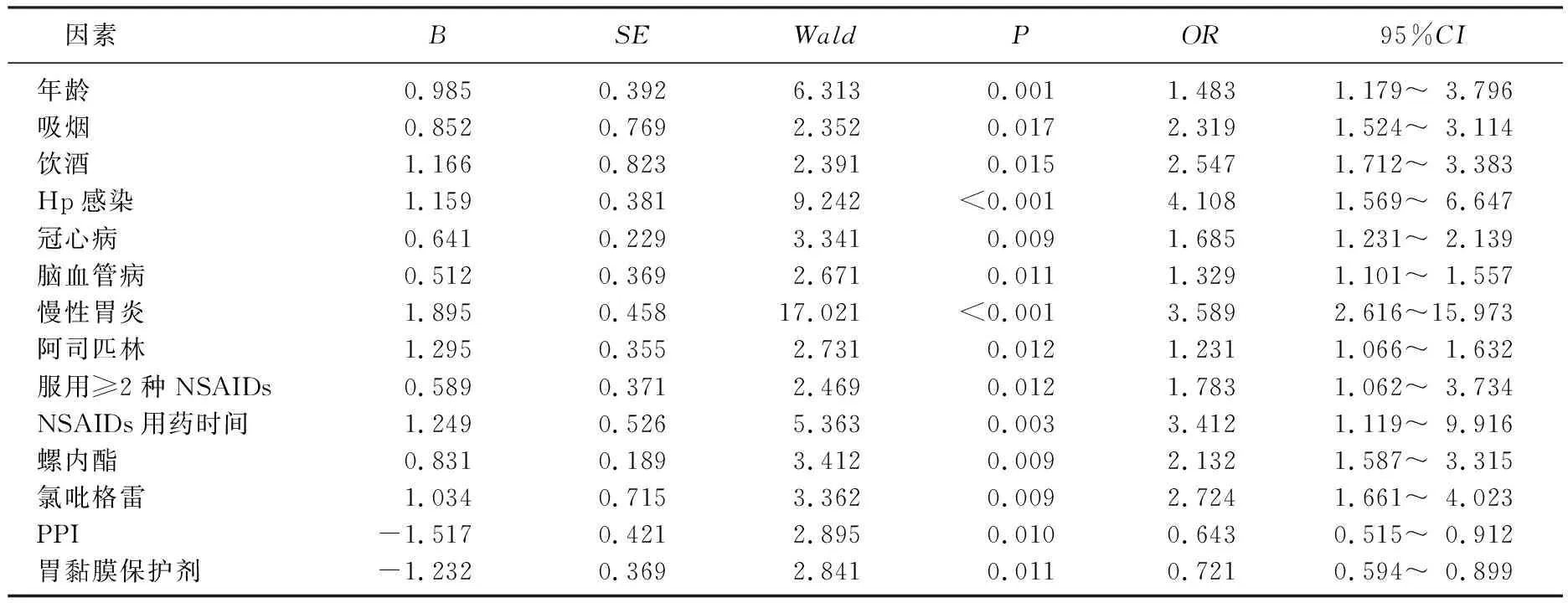
表5 NSAIDs相關性上消化道出血的非條件多因素Logistic回歸分析
3 討 論
上消化道出血是NSAIDs的嚴重不良反應之一,不僅會增大臨床治療難度,而且具有較高的致死風險[5]。NSAIDs相關性消化道出血的發生機制較為復雜,主要與NSAIDs弱酸性作用、抑制環氧合酶活性、誘導白三烯釋放等有關[6-7]。NSAIDs種類較多,且用藥患者的年齡、基礎疾病等情況差異較大,導致臨床用藥決策的選擇和消化道出血的防治較為困難,故分析NSAIDs相關性上消化道出血的影響因素非常必要。
本研究中,出血組年齡≥60歲者占比(55.56%)顯著高于非出血組,且多因素Logistic回歸分析顯示高齡是NSAIDs相關性上消化道出血的獨立危險因素(P<0.05), 表明年齡較大者服用NSAIDs可能更容易發生消化道出血。分析原因,老年人往往存在生理性胃黏膜屏障功能減弱、伴發基礎疾病較多等情況,常需長期用藥或用藥種類繁多,增加了消化道出血風險[8]。本研究還發現,出血組中有吸煙史及飲酒史者占比顯著高于非出血組,且多因素Logistic回歸分析證實吸煙、飲酒為上消化道出血的獨立危險因素。分析原因,香煙中的尼古丁會影響受損胃腸黏膜的修復,而酒精對胃腸黏膜具有刺激和損傷作用,可增加炎癥反應、凝血功能障礙等的發生,進而增加黏膜損傷、出血的發生風險[9-10]。
本研究發現,相較于非出血組,出血組合并Hp感染、冠心病、腦血管病及慢性胃炎者占比顯著更高,且以上因素均為NSAIDs相關性上消化道出血的獨立危險因素(P<0.05)。分析原因,合并心腦血管疾病、Hp感染或慢性胃炎時,患者胃黏膜已存在不同程度損傷或缺血缺氧情況,在NSAIDs刺激下更易發生上消化道出血[11-13]。多因素Logistic回歸分析結果顯示,使用PPI和胃黏膜保護劑均為NSAIDs相關性上消化道出血的保護性因素,故建議服用NSAIDs時可聯合應用恰當的PPI及胃黏膜保護劑,以降低出血風險,而合并Hp感染或有慢性胃炎病史者應慎用NSAIDs。
NSAIDs種類較多,本研究出血組中,阿司匹林的用藥率(56.48%)最高。同時,出血組NSAIDs使用時間>12個月者占比(25.00%)和≥2種NSAIDs聯用率顯著高于非出血組,且多因素Logistic回歸分析證實NSAIDs用藥時間長、聯用≥2種NSAIDs均為上消化道出血的獨立危險因素,提示臨床用藥時應盡量避免長時間用藥和多種NSAIDs聯用。本研究還發現,聯用螺內酯、氯吡格雷也是NSAIDs相關性上消化道出血的獨立危險因素(P<0.05), 與相關研究[14-15]結論相符。相關專家共識[16]也指出,除高齡、合并Hp感染、既往消化道潰瘍或出血史外,聯合抗凝或抗血小板治療等是消化道出血的高危因素。伍雙蝶等[17]報道,阿司匹林可導致大鼠小腸黏膜損傷,且與氯吡格雷聯用時損傷加重。因此,長期服用NSAIDs者應酌情調整螺內酯、氯吡格雷用量,以降低消化道出血的發生風險。
相關研究[18-19]指出,凝血功能指標異常與消化道出血具有一定相關性,而NSAIDs可能引起血小板聚集減少、局部血流量減少等,進而增大消化道出血風險。本研究中, 2組患者PT、TT、APTT、Fib、D-D及PLT比較,差異均無統計學意義(P>0.05), 與李璧倩等[20]研究結論基本一致,提示NSAIDs相關性上消化道出血可能與凝血機制的關系并不明顯。分析原因,可能是NSAIDs使用劑量處于安全范圍內,并不足以明顯干擾凝血功能。
綜上所述, NSAIDs相關性上消化道出血的危險因素較多,高齡、吸煙、飲酒、有心腦血管病史、合并Hp感染、有慢性胃炎病史、長期使用NSAIDs或多藥聯用的患者更易發生NSAIDs相關性上消化道出血。臨床治療時,針對高危因素制訂個性化治療方案并聯用PPI、胃黏膜保護劑,可預防或減少NSAIDs相關性上消化道出血的發生。

