多參數磁共振成像(mp-MRI)對NSCLC非手術療效的評估和預測價值
王闖 王琨
非小細胞肺癌(Non-small cell lung cancer,NSCLC)療效評價使用實體瘤療效評價標準1.1(Response Evaluation Criteria in Solid Tumors,RECIST1.1)[1]從解剖學角度對病灶的形態測量分析。病灶治療后體積改變與其內部的血流供應、細胞活性等生物學特征改變不一致,療效評估及預測并不能夠做到早期、及時、準確。近年來功能影像學成為準確、早期監測肺癌療效的突破點,本文研究多參數磁共振成像(Multiparameter magnetic resonance imaging,mp-MRI)中,靶病灶最長徑之和(Sum of longest path distance,SLD)聯合ADC值改變對NSCLC非手術療效的評價及預測。
資料與方法
一、一般資料
前瞻性收集2019年6月-2020年11月在我院進行非手術治療的49例NSCLC患者納入本次研究,年齡范圍為47~85歲,患者的基本情況及特征(見表1)。納入標準為:①病理為NSCLC患者;②無手術指征,擬行非手術治療,排除標準:有MR檢查禁忌癥。

表1 患者及病灶的基本情況及特征比較
二、檢查方法
mp-MRI掃描采用3.0T Skyra MRI超導磁共振成像系統,掃描前訓練病人呼吸,讓其平靜呼吸。具體掃描序列參數如下:①橫斷位T1WI-VIBE:TR4.00 ms、TE1.85 ms、矩陣189×384、 FOV262×400 mm、層厚3.0 mm、層間距0.6;②橫斷位T2WI-FS:TR4100 ms、TE98 ms、矩陣320×320、FOV340×340 mm、層厚3.0 mm、層間距0.6;③冠狀位T2WI:TR1400 ms、TE92 ms、矩陣248×256、 FOV349×360 mm、層厚3.0 mm、層間距0.6;④冠狀位T2WI-FS:TR3800 ms、TE98 ms、矩陣320×320、FOV300×300 mm、層厚3.0mm、層間距0.6 ⑤軸位DWI,采用橫斷位掃描、使用自旋回波平面成像、TR8400 ms、TE55.0 ms、帶寬2488、層厚5 mm、層間距1 mm、激勵次數3、回波間隙0.51 ms、視野380 mm×310 mm、呼吸方式采用自由呼吸(Breathe freely,FB)、采用2個b值(b=50 s/mm2、b=800 s/mm2)。DWI序列掃描應用基于K空間算法的并行采集技術(generalized autocalibrating partially parallel acquisition ,GRAPPA)。
三、圖像分析及處理
由1名影像科副主任醫師和1名影像科主治醫師,對磁共振檢查結果按照RECIST 1.1 標準測量。分別測量治療前和治療后SLD。在ADC值(b=50、800 s/mm2)圖上采用最大層面勾勒法,沿著病灶邊緣勾畫 3次,取平均值。ADC值變化率第1療程后=(ADC測量值第1療程后-ADC測量值治療前)/ADC測量值治療前×100%,記錄為ADC2;ADC值變化量第一療程后=ADC測量值第一療程后-ADC測量值治療前,記錄為ADC3。
四、療效評估
參照RECIST1.1標準將病例分為完全緩解組(complete response,CR):腫瘤靶病灶完全消失;部分緩解組(partial response,PR):SLD減小≥30%;疾病進展組(progressive diserse,PD):SLD增加≥20%或者有新發靶病灶;疾病穩定組(stable disease,SD):SLD減小<30%或增加<20%。有效組:完全緩解+部分緩解組,無效組:疾病穩定+疾病進展組。
五、統計學分析

結 果
2名影像科醫師對SLD、ADC值測量具有良好的一致性(ICC為0.862~0.983,WCV為 3.7%~4.6%)。治療第1療程后SLD與治療前SLD值無明顯統計學差異(t=0.177、P=0.859),治療后第2個療程SLD與治療前SLD值有統計學差異(t=7.410、P<0.001)。治療后第1療程ADC值改變(ADC值、ADC變化率、ADC變化量)與第2療程SLD變化率之間的相關性分析(表2)。以第一療程結束后的各組參數對第二療程結束后治療療效的效能為依據,制作出ROC曲線,(表3、圖1)。圖2a~2l為某病例治療前、治療第一、二療程后所得圖像對比。
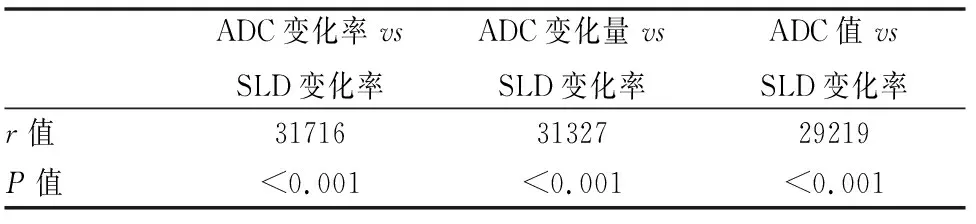
表2 第一療程ADC改變與第二療程SLD變化率相關性研究(spearman檢驗)
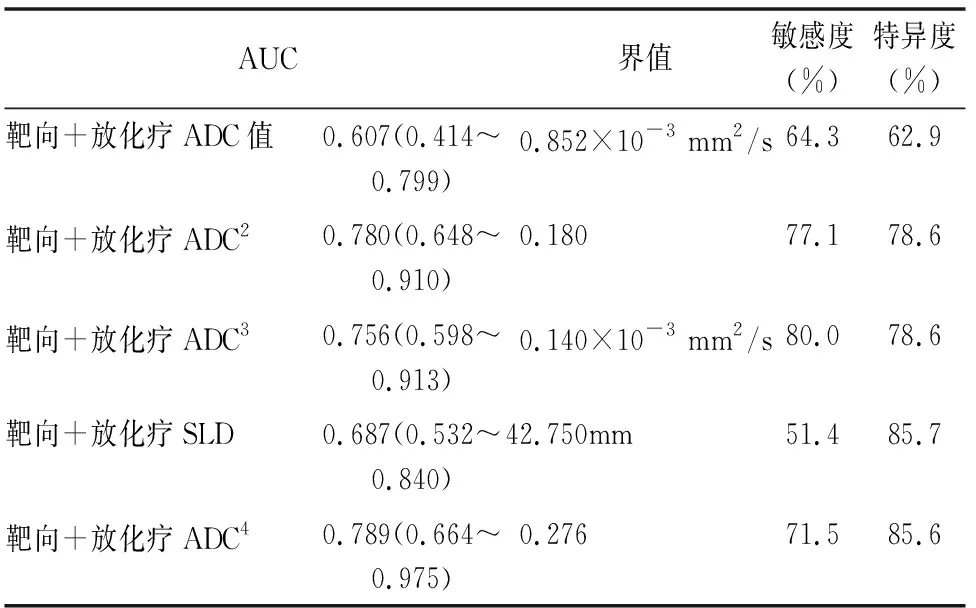
表3 SLD及ADC預測肺癌療效的ROC曲線分析結果表
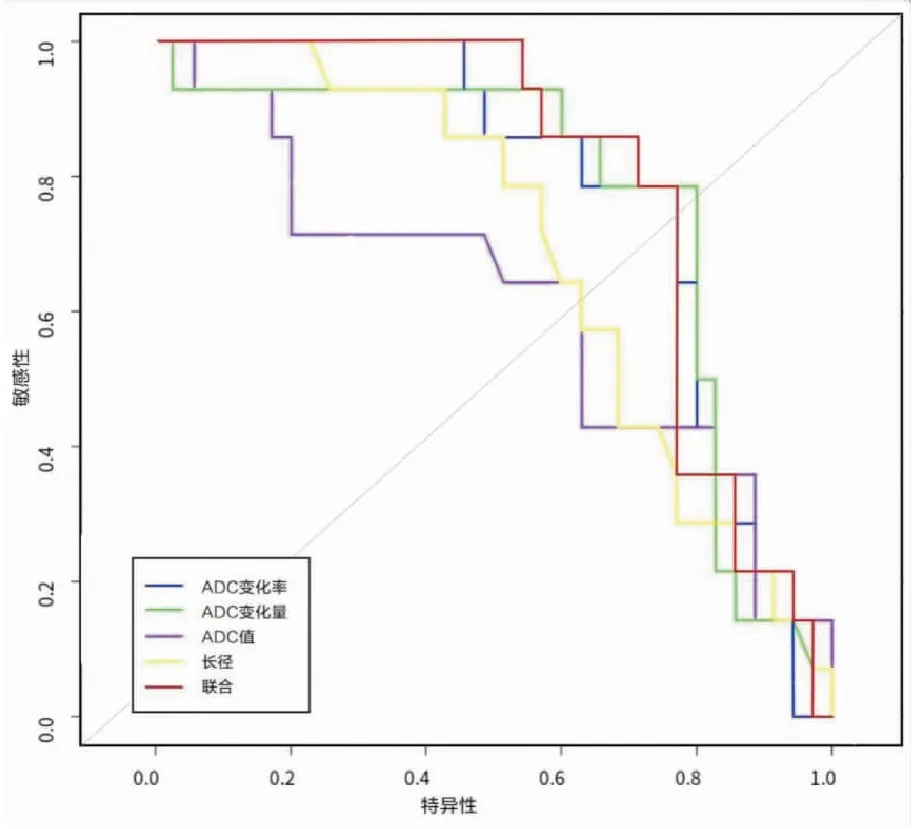
圖1 第1療程后ADC值、ADC值變化率、ADC值變化量、SLD變化以及四種參數聯合(ADC值&ADC值變化率&ADC值變化量&SLD)診斷NSCLC療效ROC曲線
討 論
臨床上對NSCLC療效評估目前主要是腫瘤形態學監測對比,目前大部分使用計算機斷層成像(computed tomography,CT),其應用成熟,掃描速度快。PET-CT(positron emission tomography-computed tomography,PET-CT)近年來臨床使用也較為頻繁,其可以反映出組織代謝放射性核素的狀況,較為準確的反應療效。單一的形態學數據,難以顯示腫瘤內壞死,纖維化等成分。同時部分病灶的形態變化與實際腫瘤細胞的改變并不是同步的,如部分患者腫瘤治療后,瘤體內部出血或囊變,導致病灶體積變大。CT對療效的評價存在一定的不足和滯后,對NSCLC的早期療效評價及預測并不能及時準確的反應出真實變化[2]。PET-CT是目前用于評估腫瘤早期療效,且可以定量評價體內腫瘤組織生物學指標的先進技術,可以作為腫瘤治療的療效評價及預測的理想手段,對肺內體積較小病灶進行測量時,PET-CT掃描時容易受到病灶組織交界面部分容積效應的影響,導致其對氟代脫氧葡萄糖(18F-FDG)攝取值的測量較實際偏低,同時炎性病灶也會影響測量值[3]。PET-CT檢查費用較高,檢查時需注入放射性核素,其有輻射,在早期評價NSCLC療效也存在一定的局限性。目前對NSCLC非手術療效預測指標或方法,主要有:臨床分期、病理分型、體質狀況、體重丟失水平、PET-CT等,最新的TNM分期顯示出了臨床分期對NSCLC預測療效影響很大,部分研究發現盡管細化了分期,臨床分期對NSCLC的預測價值仍然有限[4-5]。影像學檢查因其可視、直觀、無創等優點在預測腫瘤療效中也占據重要位置[6]。
DWI目前在臨床應用較廣,不存在輻射傷害,技術成熟。DWI 基本原理是布朗運動,以活體組織細胞內外水分子隨機擴散運動為基礎,間接反映水分子所處的細胞結構等微環境狀態。ADC值是臨床上最常用來描述水分子 擴散運動的速率和范圍的量化指標,間接反映了水分子擴散受限的程度。肺癌組織細胞排列緊密、細胞外間隙小,癌細胞核漿比大,細胞內水分子運動空間亦相對狹小,自由擴散阻力較大,因此擴散受限明顯,ADC值降低[7]。本組病例中發現有效組治療前ADC值相對偏低,均值約為0.865±0.131×10-3mm2/s,在無效組中,病例治療前ADC值相對較高,均值約為0.908±0.129×10-3mm2/s,腫瘤病灶治療前ADC值偏高可能代表NSCLC病灶中細胞密度低,也有可能病灶中存在部分微小囊變、液化所致壞死等[8]。這些區域因細胞酸中毒、細胞缺氧、部分細胞及組織結構低灌注等影響,對治療的反應差,部分學者的臨床研究及實驗室研究表示,當治療有效時,病灶內部分腫瘤細胞會產生不同程度的溶解,壞死,同時腫瘤內部細胞的細胞膜發生壞死,水分子擴散運動恢復,在DWI掃描序列顯示為信號減低,同時ADC值圖測量數據增加[9-10]。本組病例中各組患者1療程后復查,有效組ADC值均明顯較治療前增加。第一療程ADC值改變與第二療程SLD變化率呈正相關,表明ADC值改變能夠作為評估NSCLC非手術療效的一項功能性指標。治療第1療程后,靶病灶SLD與治療前靶病灶SLD值無s明顯統計學差異(t=0.177、P=0.859);治療后第2個療程靶病灶SLD與治療前靶病灶SLD值有統計學差異(t=7.410、<0.0001),表明有效組第二療程SLD才較治療前改變明顯。本研究中靶病灶SLD預測第2療程療效敏感性低于功能性參數,也證實腫瘤病灶醫治后,功能學改變要早于形態學。將ADC改變聯合SLD預測第二療程NSCLC療均明顯優于ADC值、ADC值變化率、ADC值變化量以及SLD單獨預測,SLD聯合ADC值改變可以更好、更早、更精確的評價及預測NSCLC療效。
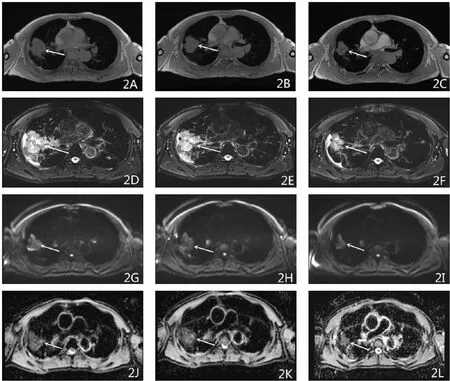
圖2 患者男,68歲,周圍型肺癌,病理類型鱗癌。圖2A、2D、2G、2J、分別為治療前T1WI橫斷位、T2WI-FS橫斷位、DWI、ADC值圖(ADC=0.844×10-3 mm2/s);圖2B、2E、2H、2K為第一療程后T1WI橫斷位、T2WI-FS橫斷位、DWI、ADC值圖(ADC=0.968×10-3mm2/s);圖2C、2F、2I、2L為第二療程治療后T1WI橫斷位、T2WI-FS橫斷位、DWI、ADC值圖(ADC=1.376×10-3mm2/s)。放化療后第1個療程病灶大小較治療前變化不明顯,但ADC值升高;第2個療程后病灶縮小,屬于PR組及有效組。
部分其他研究者[11-13]僅用ADC或ADC改變與CT、CTP、IVIM等聯合進行NSCLC非手術療效評價及預測,而本研究將ADC聯合SLD改變,減少了重復檢查、CT輻射性、造影劑毒副作用等,一次檢查即可準確評估與預測NSCLC療效,更有利于NSCLC非手術患者診療。本研究中的不足之處:病例數偏少,結果會產生一點的偏倚。未對肺癌患者進行病理類型分組,但是部分研究者[14-15]研究表明不同病理類型的肺癌ADC值一致性并無明顯差異;其次只研究了NSCLC,未將小細胞肺癌患者歸入本次研究。
綜上所述,NSCLC診療過程中,及時評價和預測療效,從而合理制定個體化治療方案尤為重要,通過mp-MRI掃描中SLD聯合ADC值改變對NSCLC非手術療效評價和預測效能均較高,從形態學(SLD)、功能學(ADC)更敏感、更準確的評估預測NSCLC非手術療效,更有利于NSCLC患者的診治。

