miR-211-5p在局灶性腦缺血再灌注損傷大鼠模型中表達分析
孫亞云,蘇建華,張俊華,馬永賓,張尊勝,查全斌
腦缺血和再灌注損傷是缺血性腦卒中的病理機制,造成腦組織內皮細胞和神經細胞損傷,影響大腦功能。一方面腦血流供應受阻能夠造成腦組織代謝的嚴重不平衡,引起腦組織損傷,更重要的是隨后的缺血再灌注將促進腦組織中自由基生成,常加劇腦缺血損傷[1]。腦缺血程度和持續時間及再灌注的時間影響腦缺血再灌注損傷的診治及預后[2]。研究表明,miR-211-5p在多種生物體的病理生理過程中發揮重要作用[3],在大鼠缺血再灌注模型中表達增加可以減輕缺血再灌注損傷[4],但是具體機制仍不清楚。腦源性神經營養因子(BDNF)可以營養神經細胞,減輕急性腦梗死患者缺血再灌注損傷。有研究表明,腦梗死早期梗死灶周圍BDNF呈高表達[5]。由此可見,BDNF由梗死灶周圍組織代償性生成以減輕梗死部位(尤其是缺血半暗帶區)損傷。因此,探索miR-211-5p是否靶向BDNF以減輕大腦缺血再灌注損傷尤為重要。
1 材料與方法
1.1局灶性腦缺血再灌注(MCAO/R)大鼠模型的建立及分組 選用斯萊克公司SPF級成年大鼠40只,體質量250~280 g。本研究符合相關管理準則及實驗動物倫理要求,實驗動物許可證號:SCXK(京)2016-0002。大鼠腹腔注射戊巴比妥鈉45 mg/kg麻醉。分離右側頸總動脈,做“V形”切口后插入尼龍栓線至大腦中動脈起始段(約18 mm,可見黑色標記至三岔口),扎緊栓線90 min后拔出,建立MCAO/R大鼠模型,動物給藥均在造模前24 h行側腦室注射。動物隨機分為4組,每組10只。假手術組(Sham組):拴線深度5 mm,其他手術過程同MCAO/R+溶劑組(Vehicle組);Vehicle組:造模后注射5 μl 1%DMSO助溶劑;MCAO/R+miR-211-5p組(Mimic組):造模前7 d,以0.1 μl/min顱內立體定位注射miR-211-5p mimic片段溶液8 μl;MCAO/R+anti-miR-211-5p組(Antagomir組):注射miR-211-5p Antagomir的方法同Mimic組。造模相關溶劑類藥物均來自美國Sigma公司。
1.2實驗方法 ①神經功能缺損評分:采用Longa 5分法[6]評定大鼠神經功能缺損情況。將大鼠放置在桌面上,正常運動記0分,左前肢伸展障礙記1分,行走轉圈記2分,行走傾斜記3分,行走障礙記4分;若大鼠在造模后死亡記5分。0~4分納入統計,5分在數據統計時剔除。 ②腦梗死體積測定:在再灌注72 h后,大鼠麻醉處死取出完整腦組織,-20 ℃速凍30~60 min后,冰上均勻切片。配置1%TTC染液,37 ℃恒溫避光孵育腦切片15 min,觀察腦組織變化。腦梗死體積百分比采用Image J軟件計算。③BDNF與miR-211-5p檢測:取-80 ℃冰箱保存的大鼠腦皮質及海馬組織,組織勻漿后以10 000×g 4 ℃離心15 min,收集上清。采用Q-PCR檢測血清miR-211-5p含量,采用ELISA和Western blot法測定BDNF表達。按照ELISA試劑盒說明書,將含有BDNF的血清標本、標準品、稀釋的檢測抗體(已被辣根過氧化物酶標記)加入到預先被人BDNF捕獲抗體包裹的標板孔中,經過孵育及洗滌,再用底物溶液三甲基六亞甲基二胺顯色,催化后采用酶標儀測定450 nm波長下的光密度(OD)值,并根據OD值得出所對應血清的BDNF濃度值。

2 結果
2.1腦梗死大鼠存活率及神經功能缺損評分 Sham組、Vehicle組、Mimic組、Antagomir組大鼠存活率分別為100.00%、50.00%、80.00%、60.00%。Vehicle組存活率較Sham組顯著降低,miR-211-5p處理后較Vehicle組顯著升高,拮抗miR-211-5p后存活率降低(P<0.05)。對各組大鼠進行Longa評分,Vehicle組較Sham組評分明顯升高,應用miR-211-5p后評分降低,拮抗miR-211-5p后評分升高(P<0.05)。見圖1。
2.2大腦梗死體積評估 隨機選取各組4只大鼠完整腦組織行TTC染色,結果發現與Vehicle組比較,Mimic組腦梗死體積百分比明顯降低,應用anti-miR-211-5p后,Antagomir組腦梗死體積百分比高于Mimic組(P<0.05)。見圖2。
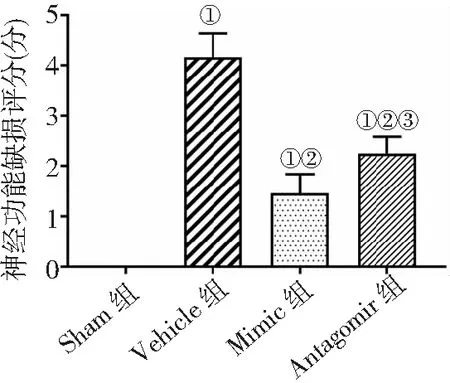
圖1 4組MCAO/R大鼠神經功能缺損評分比較
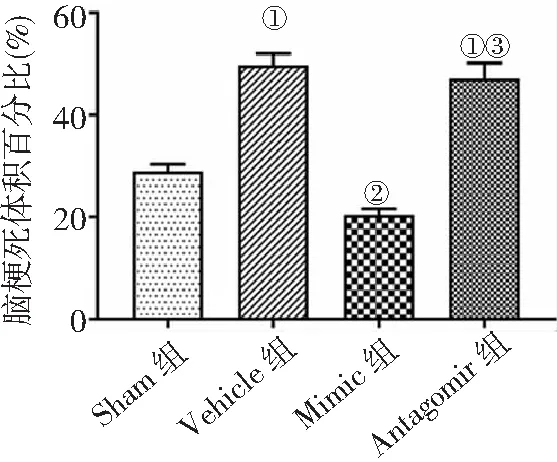
圖2 4組MCAO/R大鼠腦梗死體積比較
2.3miR-211-5p表達結果比較 與Sham組和Vehicle組比較,Mimic組miR-211-5p表達量升高,Antagomir組表達量降低,Antagomir組miR-211-5p表達量低于Mimic組(P<0.05)。見圖3。
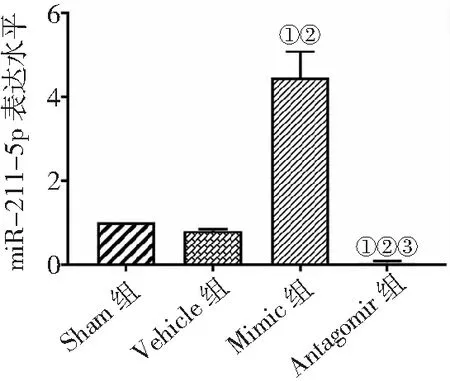
圖3 4組MCAO/R大鼠miR-211-5p表達水平比較
2.4ELISA法檢測BDNF蛋白表達 Mimic組BDNF表達量高于其他3組,Vehicle組和Antagomir組低于Sham組,Antagomir組低于Vehicle組(P<0.05)。見圖4。
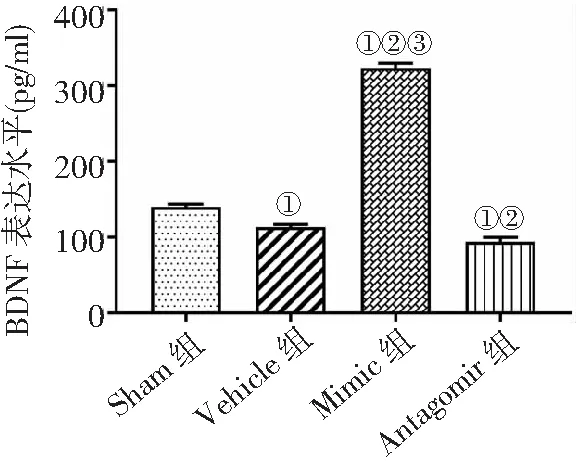
圖4 ELISA法檢測4組MCAO/R大鼠BDNF蛋白表達水平比較
2.5Western blot法檢測BDNF蛋白表達 Mimic組BDNF表達量高于其他3組,Vehicle組和Antagomir組低于Sham組,Antagomir組低于Vehicle組(P<0.05)。見圖5。
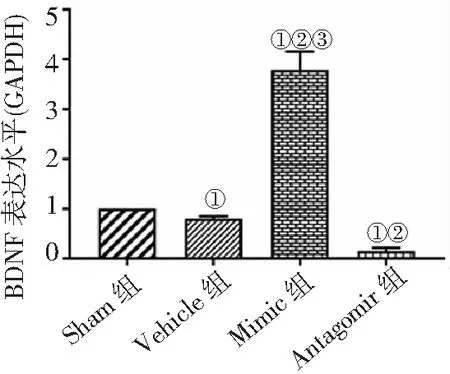
圖5 Western blot法檢測4組MCAO/R大鼠BDNF蛋白表達水平比較
3 討論
miRNA可調節神經細胞內多種靶基因,對神經系統發育有重要作用[7]。有研究表明miRNA調控眾多炎性介質的細胞內通路[8]。miR-211-5p在多種腫瘤、精神疾病和心腦血管疾病中發揮重要作用[9]。盡管有新的證據表明miRNA在人類和嚙齒類動物腦卒中后均會發生改變,但是關于miR-211-5p在腦卒中后炎癥反應調節中的作用及機制研究仍然有限。有研究發現,miR-146a可以抑制少突膠質前體細胞(OPC)中IPAK-1,增加髓磷脂蛋白并降低OPC的凋亡,從而改善腦缺血再灌注損傷[10];miR-3473b通過靶向小鼠小膠質細胞BV2細胞株的細胞因子信號轉導抑制因子3來降低小鼠的適應性免疫調節[11];抑制miR-19a可以調節葡萄糖代謝和神經細胞凋亡來保護缺血性損傷的神經細胞[12];Mcl-1是Bcl-2家族成員,miR-106b-5p抑制劑可以增強抗神經細胞凋亡效應,從而修復腦缺血再灌注損傷[13]。本研究發現,大鼠側腦室注射miR-211-5p后,存活率升高而Longa評分降低,大鼠腦梗死體積百分比降低,說明miR-211-5p具有修復大鼠MCAO/R損傷的作用。
miR-211-5p在多種生物體的病理生理過程具有重要的調控作用[14],通過下調膠質細胞源神經營養因子(GDNF)表達進而抑制骨髓間充質干細胞向腸神經節細胞分化[15];miR-211/BDNF軸通過PI3K/AKT途徑調節脂多糖誘導的星形膠質細胞增殖,提示其可能成為脊髓灰質損傷后反應性星形膠質細胞增殖干預策略的靶點[16];在新生大鼠MCAO/R模型中,miR-211/GDNF減少Neuro2A細胞凋亡,從而減輕缺氧缺血性損傷[17]。有研究認為,miR-211-5p在缺血性腦病中起重要作用,在大鼠缺血再灌注模型中表達增加并可減輕大鼠缺血再灌注損傷[4]。進一步檢測BDNF表達水平發現,BDNF在Mimic組中表達量高于Sham組,Antagomir組表達量最低,說明BDNF能減輕MCAO/R大鼠神經功能損傷,提高生存率;推測BDNF表達變化與miR-211-5p存在一定關系,miR-211-5p通過靶向調控BDNF參與對MCAO/R大鼠的腦損傷保護。
綜上,miR-211-5p表達水平與大鼠MCAO/R損傷具有相關性。

