水中運動聯合中藥內治對糖尿病大鼠心肌細胞凋亡和心功能的影響
黃光明,趙興昌,符顯昭
(1.右江民族醫學院臨床醫學院,廣西 百色 533000;2.右江民族醫學院附屬醫院中醫科,廣西 百色 533000)
成人心肌細胞在心室區域中占比高達49%[1],是心臟發揮泵血功能的關鍵細胞,而糖尿病狀態下的高血糖、高血脂、氧化應激等病理因素易誘發心肌細胞過度內質網應激(endoplasmic reticulum stress,ERS),造成心肌凋亡[2]。心肌細胞凋亡將促發凋亡區域的心肌細胞與細胞外基質的一系列代償性病理改變,導致心臟重塑發生與進展[3]。心臟重塑嚴重危害心臟結構與功能,是各種心血管疾病進展至心力衰竭的關鍵性病理改變[4]。目前臨床治療主要以降糖藥物防控糖尿病及其心血管并發癥進展,但無論發展中還是發達國家,糖尿病患者的心力衰竭發病率依舊居高不下[5]。因此,積極尋找減輕糖尿病下心肌細胞凋亡的有效方法,抑制心臟重塑發生與進展,對于降低糖尿病患者心力衰竭發生率意義重大。水中運動治療是水療康復的現代主流技術方法,可激發患者興趣,縮減心理障礙,緩解運動不耐受,心血管康復優勢明顯[6,7]。中藥內治是傳統康復醫學的重要治療方法,越來越多的藥理學研究和臨床試驗都證實了相關中藥成分具有抗炎、抗凋亡、調節代謝紊亂等多重功效[8]。本實驗擬探究水中運動聯合中藥內治對糖尿病大鼠心肌細胞凋亡和心功能的影響,為糖尿病合并心血管疾病的防治提供借鑒和依據。
1 材料與方法
1.1 主要試劑與儀器 鏈脲佐菌素(北京華越洋生物公司),血糖試紙(武漢博士德生物工程有限公司),高脂飼料(江蘇省協同生物工程有限公司),TUNEL試劑盒(北京華越洋生物公司),生理鹽水、PBS 緩沖液、二甲苯、乙醇溶液、過氧化氫溶液、4%多聚甲醛(成都市科隆化學品有限公司),PCR 引物及試劑(上海吉凱基因生物科技有限公司);Vevo-770 小動物超聲診斷儀,超凈工作臺(山東博科生物科技有限公司),-80 ℃超低溫冰箱(中國海爾),光學顯微鏡(奧林巴斯公司),PCR 儀(Bio-Rad 公司)。
1.2 動物分組與造模 雄性SD 大鼠125 只,體重(240±10)g[購自廣西醫科大學實驗動物中心,許可證編號SCXK(桂)2014-002],大鼠飼養于右江民族醫學院動物實驗中心,環境溫度(20±2)℃,相對濕度50%~60%。按照隨機數字表法將其分為空白組、模型組、中藥內治組、水中運動組、綜合康復組,每組25 只。除空白組外,其余組空腹10 h 后,隨即按照50 mg/kg 腹腔注射鏈脲佐菌素,72 h 后檢測其空腹血糖(FBG)水平,選擇連續2 次FBG≥16.7 mmol/L 大鼠,高脂飼養3 個月后作為2型糖尿病模型。造模成功后除空白組外各組繼續高脂飼養(具體成分為:豬膽鹽0.3%、膽固醇1.5%、豬油10%、蛋黃粉10%、普通飼料78.2%),空白組大鼠采用普通飼料喂養。實驗方案嚴格遵守美國NIH 下的實驗動物使用指南,并通過右江民族醫學院實驗動物倫理委員會的批準。
1.3 水中運動方案 水中運動組以及綜合康復組利用自制大鼠水療運動池進行游泳運動,水療運動池水深不小于30 cm,維持水溫32 ℃~35 ℃,每次使用前消毒,確保水質安全。每周運動6 次,第1 周為適應期,運動時間為10 min/次,第2 周為延長運動適應期,運動時間逐漸增至30 min/次,第3~8 周運動時間為60 min/次。
1.4 灌胃處理方案 將中藥復方(人參、麥冬、黃芪、地黃、大黃、山茱萸、黃連、五味子,購自右江民族醫學院附屬醫院)制成浸膏,依據人與大鼠劑量換算公式確定用藥劑量,配制成混懸液后,中藥內治組與綜合康復組按照1.0 g/(kg·d)灌服混懸液,模型組與水中運動組每天給予等體積生理鹽水灌胃處理,連續灌胃8 周,各組灌胃處理在運動前2 h 進行。
1.5 超聲心動圖檢測 各組接受相應處理8 周后進行超聲心動圖檢測,2%異氟烷吸入誘導麻醉大鼠,仰臥位固定,利用Vevo-770 小動物超聲診斷儀檢測左室舒張末期內徑(LVEDD)、左室收縮末期內徑(LVESD)、射血分數(EF)、二尖瓣快速充盈期與心房收縮期血流速度比值(E/A)。
1.6 實驗取材 各組接受末次相應處理并進行超聲心動圖檢測后,麻醉處死大鼠,摘取心臟,分為2 部分,一部分4%多聚甲醛固定,常規石蠟包埋、切片,用于TUNEL 法檢測心肌細胞凋亡,另一部分存放于-80 ℃液氮保存,用于RT-PCR 實驗。
1.7 TUNEL 法檢測心肌細胞凋亡 利用二甲苯處理心肌組織石蠟切片10 min,脫蠟后使用乙醇溶液完成水化處理,加入蛋白酶,室溫下15 min,3%過氧化氫溶液處理10 min,按照TUNEL 凋亡檢測試劑盒明配制TUNEL 液;將TUNEL 液添加至切片,37 ℃下反應60 min,PBS 沖洗后添加DAB 顯色劑,85%、95%、100%逐級濃度梯度乙醇脫水,二甲苯透明,最后中性樹膠封片。顯微鏡下觀察,拍照TUNEL 染色大鼠心肌細胞凋亡結果。凋亡陽性心肌細胞核為黃棕色,正常心肌細胞核呈藍色,每張切片選擇5 個不重復視野對細胞核總數和凋亡細胞核數目進行統計,并計算心肌細胞凋亡指數(cell apoptotic index,CAI)。CAI=凋亡心肌細胞核數/總細胞核數×100%,計算每個視野內的CAI,并取平均值。
1.8 Real time-PCR 測定心肌組織中葡萄糖調節蛋白78(GRP78)、半胱氨酸天冬氨酸蛋白酶-12(Caspase-12 mRNA)轉錄水平 取心肌組織0.1 g,加入液氮研磨后利用Trizol 試劑提取大鼠心肌組織總RNA,經瓊脂糖凝膠電泳檢測完整性后按照試劑盒說明書逆轉錄為cDNA,獲取目的基因。Real time-PCR 測定GRP78、Caspase-12 mRNA 相對表達水平,反應條件為96 ℃4 min,94 ℃30 s,58 ℃30 s,72 ℃30 s,共計40 個循環。目的基因的相對表達標準化為GAPDH,各項數據使用2_△△Ct法進行分析、計算。擴增目的基因所用引物見表1。

表1 目的基因及內參引物
1.9 統計學處理 所有數據采用SPSS 19.0 軟件包進行分析,計量資料以()表示,多組間比較采用單因素方差分析(One-way ANOVA),兩組間比較采用LSD-t檢驗。P<0.05 為差異有統計學意義,P<0.01 表示統計學意義顯著。
2 結果
2.1 大鼠一般情況 造模成功后,糖尿病大鼠精神萎靡,毛色暗淡,多飲、多食,體重下降。各組大鼠在飼養、灌胃、與水中運動期間進展順利。
2.2 各組大鼠心臟重塑指標的比較 超聲檢測結果顯示,與空白組比較,模型組大鼠LVEDD 與LVESD均增高(P<0.05),EF 降低(P<0.05),E/A 降低(P<0.01);經過8 周干預后,與模型組相比,水中運動組、中藥內治組和綜合康復組LVEDD、LVESD 均降低,EF 升高(P<0.05),E/A 升高(P<0.01);在各治療組中,綜合康復組各項指標值改善最為明顯,與水中運動組比較,差異有統計學意義(P<0.05),見表2。
表2 各組大鼠心臟重塑指標與心功能指標的比較()

表2 各組大鼠心臟重塑指標與心功能指標的比較()
注:與空白組比較,*P<0.05;與空白組比較,#P<0.01;與模型組比較,△P<0.05;與模型組比較,&P<0.01;與水中運動組比較,○P<0.05
2.3 各組大鼠心肌細胞凋亡CAI 的比較 光鏡下TUNEL 法檢測結果顯示正常狀態下心肌細胞核為藍色,陽性凋亡心肌細胞核為棕黃色,細胞核發生皺縮,體積小于正常細胞核大小;與空白組比較,模型組、水中運動組、中藥內治組、綜合康復組心肌細胞凋亡率均升高(P<0.01);與模型組比較,水中運動組、中藥內治組、綜合康復組心肌細胞凋亡率均降低(P<0.05);與水中運動組比較,綜合康復組心肌細胞凋亡率降低(P<0.05),見表3、見圖1。
表3 各組大鼠CAI 的比較(,%)

表3 各組大鼠CAI 的比較(,%)
注:與空白組比較,*P<0.01;與模型組比較,#P<0.05;與水中運動組比較,△P<0.05

圖1 各組大鼠心肌細胞凋亡情況(TUNEL,×200)
2.4 各組大鼠心肌細胞GRP78、Caspase-12 mRNA轉錄水平比較 與空白組比較,模型組、水中運動組、中藥內治組、綜合康復組大鼠Caspase-12、GRP78 的mRNA 轉錄水平均升高(P<0.01);經過8周治療后,與模型組比較,水中運動組、中藥內治組、綜合康復組Caspase-12、GRP78 的mRNA 轉錄水平均降低(P<0.05),與水中運動組比較,綜合康復組Caspase-12、GRP78 的mRNA 轉錄水平降低,差異有統計學意義(P<0.05),見表4。
表4 各組心肌細胞GRP78、Caspase-12 mRNA轉錄水平比較()
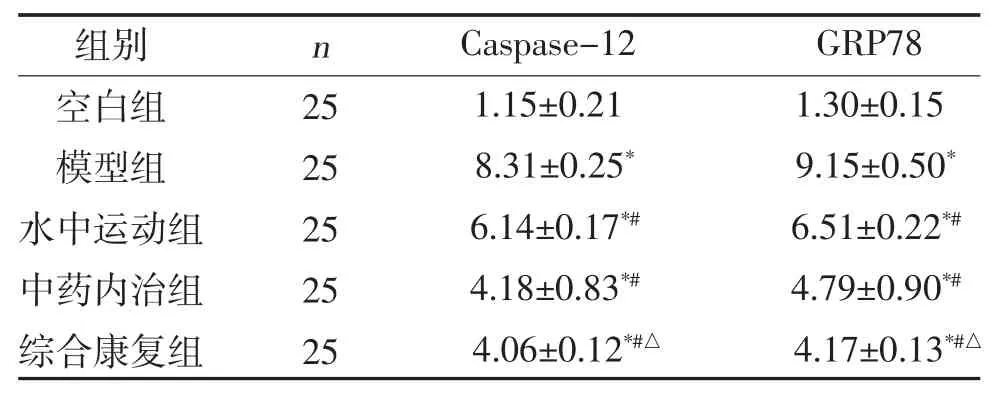
表4 各組心肌細胞GRP78、Caspase-12 mRNA轉錄水平比較()
注:與空白組比較,*P<0.01;與模型組比較,#P<0.05;與水中運動組比較,△P<0.05
3 討論
糖尿病對心臟危害極大,是心力衰竭的獨立危險因素。心肌細胞體外研究顯示高血糖合并高血脂狀態可顯著改變心肌細胞形態與空間排列并誘發心肌細胞大量凋亡[9],表明糖尿病可對心臟造成廣泛且嚴重的損害。ERS 則被證明在糖尿病與心肌細胞凋亡間發揮著中介作用,借助調控ERS 對抗心肌凋亡有望成為防治糖尿病下心力衰竭的重要途徑[10]。
內質網是真核細胞中處于動態平衡的囊體細胞器,負責蛋白質、脂質、類固醇的生物合成以及鈣離子的平衡調控。生理或病理性應激原均可改變內質網穩態,造成未折疊或錯誤折疊蛋白質積累,導致ERS 的發生[11],內質網為維持自身穩態將啟動減少蛋白質合成,增加折疊能力以及促進異常蛋白清除等途徑,被稱之為未折疊蛋白反應(unfolded protein response,UPR)[12]。糖尿病狀態下的高血糖、高血脂、氧化應激狀態、炎癥反應等病理因素易誘發心肌細胞持久的ERS,使蛋白激酶樣內質網應激酶(protein kinase R-like ER kinase,PERK)、活化轉錄因子6(activating transcription factor 6,ATF6)及肌醇需求酶1(Inositol-requiring enzyme1,IRE-1)與GRP78分離,轉而與未折疊蛋白結合,激活UPR 以恢復內質網穩態,但過度的ERS 將超過心肌內質網恢復穩態的能力,PERK、ATF6、IRE-1 三者將進而激活下游的凋亡信號分子CCAAT 增強子結合蛋白同源蛋白(CCAAT/Enhance-Binding protein Homologous protein,CHOP)、c-Jun 氨基末端激酶(c-Jun N-terminal kinases,c-JNK)、Caspase-12,激活相應CHOP/GADD153 途徑、c-JNK 途徑、Caspases12 三條ERS凋亡路徑,導致心肌細胞凋亡[13,14]。
本實驗借助建立2型糖尿病大鼠模型探究了水中運動、中藥內治和水中運動聯合中藥內治對糖尿病大鼠心肌細胞凋亡和心功能的干預效果。實驗結果顯示與空白組比較,模型組大鼠心臟重塑指標LVEDD、LVESD 增高,心功能指標EF、E/A 下降,表明實驗中糖尿病大鼠心臟結構肥大,存在典型的糖尿病心臟病變,并出現心功能下降。三個治療組經8周相應干預后,糖尿病大鼠心臟重塑和心功能均得到明顯改善,且綜合康復組心臟重塑和心功能改善優于單獨水中運動組。有糖尿病大鼠實驗表明[15],運動訓練可通過調控NADPH 氧化酶活性減輕大鼠心臟氧化應激反應,進而抑制糖尿病大鼠心臟重塑,保護心功能。楊海玉等[16]發現丹參中活性成分丹參酮可通過抑制糖尿病大鼠心肌中NF-κB 通路,減輕炎癥反應,對糖尿病大鼠心肌提供保護。上官若男等[17]的研究表明,游泳運動干預后糖尿病大鼠心室肥厚和心肌纖維化病變得到明顯改善。本實驗結果提示水中運動和中藥內治均具有縮小心臟肥大性改變、增強心肌收縮力、提升心臟射血功能的作用,與任磊等[18]的研究結果相似。研究表明[19],糖尿病患者和糖尿病動物模型心臟中均可發現心肌細胞凋亡增加。本實驗中心肌組織TUNEL 染色結果同樣顯示,糖尿病大鼠心肌細胞凋亡水平顯著升高,由于心肌細胞無增殖能力,凋亡后將直接影響心臟收縮與舒張,符合本實驗中觀察到的糖尿病大鼠心功能下降現象。符顯昭等[20]應用人參、麥冬、丹參、五味子、黃芪等配伍成中藥復方,可有效降低糖尿病大鼠心肌細胞凋亡水平。鄧爽等[21]研究發現,4 周游泳運動預適應可減少促凋亡因子表達,抑制心肌細胞凋亡,改善心肌重構模型小鼠心功能,延緩心力衰竭進展。在本實驗中發現水中運動與中藥內治均可減少糖尿病大鼠心肌細胞凋亡,兩者聯合下的綜合康復組心肌凋亡和心功能改善最佳。實驗進一步對其可能的作用機制進行了探究,通過對各組實驗大鼠心肌組織ERS 標志分子GRP78、Caspase-12 的mRNA 轉錄水平比較分析發現糖尿病模型大鼠內質網應激水平顯著升高,而三種康復治療方法均能明顯降低心肌細胞GRP78、Caspase-12 的mRNA 轉錄水平,提示各治療組心肌細胞凋亡水平的下降與抑制過度ERS所激活的Caspase-12 凋亡通路有關,這與金娟等[22]和常盼等[23]所報道的抑制ERS 凋亡通路,可降低心肌細胞凋亡水平的發現相符。另外,據相關臨床線性回歸分析報道內質網應激標志物GRP78 可協助診斷心力衰竭,評估心衰患者病情預后[24]。本實驗中水中運動組、中藥內治組和綜合康復組的糖尿病大鼠經8 周相應治療后心肌細胞GRP78 mRNA 轉錄水平相對模型組大鼠明顯降低,提示上述三種康復治療方法具有改善心力衰竭預后的潛在臨床應用價值。
綜上所述,細胞凋亡是糖尿病下心肌細胞發生過度內質網應激時的主要結局之一,心臟重塑則是大量心肌細胞因凋亡而丟失后的必然結果,減少心肌細胞凋亡可保護糖尿病患者心功能,降低其心力衰竭發生風險,本研究發現水中運動聯合中藥內治下的綜合康復治療可有效抑制糖尿病下心臟重塑,提升心功能,其機制與減輕心肌細胞過度內質網應激,抑制Caspase-12 凋亡通路有關。

