噬菌體抗體展示技術及其在抗新冠病毒抗體發現中的 應用
王加利 和似琦 康子茜 王建勛
(北京中醫藥大學生命科學學院,北京 102400)
20世紀90年代初,John McCafferty和Sir. Gregory Winter開發了一種被稱為噬菌體抗體展示的體外抗體篩選技術,該技術不依賴于體內的免疫反應,可用于發現針對幾乎所有類型抗原及單個靶點多表位的抗體,已被證明是一種強大的用于發現全人源抗體的技術平臺。2018年10月,Sir Gregory P. Winter因開發了此項技術獲得諾貝爾化學獎。該技術主要通過在絲狀噬菌體上構建抗體組合表達庫來篩選抗原特異性單克隆抗體[1]。由于單克隆抗體分子量(150 kD)較大,在噬菌體表面展示具有一定的挑戰性。因此,在噬菌體上展示的抗體多為保留親和性的較小的抗體片段,如單鏈可變片段(singlechain fragment variable,scFv)、抗原結合片段(fragment antigen binding,Fab)和 單 域 抗 體(single domain antibody,sdAb)。這些抗體片段具有較小的尺寸(15-50 kD),往往具有更好的藥代動力學和藥效學特性。與多克隆抗體和單克隆抗體相比,基于噬菌體展示技術的重組抗體片段生產速度更快,程序更自動化,且減少了對實驗動物的利用。首個獲美國食品藥品管理局(FDA)批準上市的全人源抗腫瘤壞死因子-α(anti-tumor necrosis factor-α,TNF-α)單克隆抗體阿達木單抗即通過該技術發現。截至2020年,共有70多個通過噬菌體抗體展示技術發現的單克隆抗體進入臨床研究,其中14個已經獲得批準[2]。
重癥急性呼吸綜合征冠狀病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)引起的 2019 冠狀病毒病(Coronavirus Disease 2019,COVID-19)仍在全球肆虐,成為目前最受關注的突發傳染性疾病。截至 2021 年6月21日,已有 178 503 429例確診病例,其中死亡 3 872 457例。(數據來源:https://covid19.who.int/)。自新冠病毒爆發以來,國內外多家研究機構和企業對其開展了流行病學和藥理學研究,其中包括治療和預防SARSCoV-2疫苗和抗體藥物的研究。雖然目前已有多種疫苗成功上市,但這些疫苗的保護率均無法達到100%,因此中和抗體的研究十分必要。并且相比新冠疫苗,中和抗體療法具有預防和治療的雙重作用。噬菌體抗體展示技術已被廣泛用于發現抗病毒感染的中和抗體,如流感[3]、麻疹[4]和狂犬病[5]等。在此次疫情中,研究人員也同樣通過該技術篩選抗新冠病毒中和抗體。目前已有多個研究團隊獲得該中和抗體,并進入臨床前研究階段。
本文闡述了噬菌體抗體展示技術的基本原理,抗體庫的構建、分類及淘篩流程,同時對該技術的優勢及局限性進行了分析。另外,總結了自新冠肺炎爆發以來,噬菌體抗體展示技術在研發新冠病毒中和抗體研究中的應用情況。
1 噬菌體抗體展示技術原理
噬菌體抗體展示技術通過將抗體基因序列插入到噬菌體外殼蛋白結構基因中,使抗體與噬菌體的外殼蛋白形成融合蛋白,并隨著子代噬菌體的重新組裝展示在噬菌體表面,同時又可以保持相對的空間結構和生物活性。該技術的突破性貢獻在于建立體外抗體功能和其對應的遺傳信息的直接聯系,其核心是基于噬菌體的生物學特征。T4、T7、λ,以及絲狀M13噬菌體均可用于噬菌體展示,其中M13噬菌體在噬菌體抗體展示技術中應用最廣泛[6]。
1.1 M13絲狀噬菌體
M13絲狀噬菌體是一種圓柱形病毒粒子,包含一個環狀單鏈DNA分子(6 407個堿基對),由9個基因組成,編碼5種衣殼蛋白(pIII、pVIII、pVI、pVII和pIX)以及6個組裝和復制蛋白[7-8]。主要衣殼蛋白pVIII以2 700個拷貝在DNA周圍形成一個管狀結構,呈重疊的螺旋排列。而其他4種次要衣殼蛋白均有5個拷貝,pVII和pIX位于衣殼的一端,pIII和pVI位于衣殼的另一端。大多數噬菌體抗體展示系統都是將抗體序列融合到pIII衣殼蛋白的N端,這是由于pIII蛋白結構的靈活性和它在不喪失其功能的情況下展示大蛋白的能力[9]。
1.2 M13噬菌體展示系統
在早期的研究中,抗體基因被直接克隆到絲狀噬菌體基因組中。由于每個噬菌體通常包含5個G3P拷貝,所以使用噬菌體載體會出現抗體-G3P融合蛋白的多價展示。盡管這樣的多價展示系統會干擾pIII-F菌毛的相互作用,從而對噬菌體侵染性和抗體庫多樣性產生負面影響[10]。但使用噬菌體系統的主要問題是克隆大量外源性DNA到噬菌體基因組可能產生的有害影響,如遺傳不穩定等[11]。為了避免這些問題,具有單價展示特性的噬菌粒載體系統現已被廣泛應用于噬菌體抗體展示技術中。
噬菌粒(phagemid)包含3個關鍵元素:(1)用于質粒篩選和擴增的抗生素標記;(2)抗體- G3P融合蛋白的編碼基因;(3)啟動滾環復制產生ss-DNA的M13 復制起點。在沒有其他噬菌體蛋白的情況下,噬菌粒會像質粒一樣進行擴增。為了制備展示抗體- G3P融合蛋白的功能性噬菌體,攜帶噬菌粒載體的大腸桿菌必須被輔助噬菌體感染。輔助噬菌體包含完整的M13基因組,具有編碼衣殼生成、噬菌體裝配、染色體復制和出芽所需的所有噬菌體蛋白。最常用的輔助噬菌體是M13KO7,它是M13的衍生物[12]。由于輔助噬菌體的野生型pIII基因的表達水平優于噬菌粒編碼的pIII-抗體融合基因,所以90%的子代噬菌體沒有展示抗體- G3P融合蛋白,而且絕大多數攜帶抗體- G3P融合蛋白的噬菌體均為單價展示[13]。目前利用超級輔助噬菌體可以將噬菌粒載體系統的抗體展示水平恢復到與噬菌體載體系統相同的水平[14]。然而,在構建噬菌體抗體庫中單價展示依然是最受歡迎的展示系統,因為它允許選擇更高親和力的抗體[15]。
2 噬菌體抗體庫
基于噬菌體抗體展示技術原理,研究人員通常在絲狀噬菌體上構建抗體庫來篩選抗原特異性單克隆抗體。
2.1 噬菌體抗體庫的構建
噬菌體抗體庫的構建包括:(1)提取B細胞mRNA(可來源于免疫或未免疫的人或動物),(2)用隨機引物將RNA逆轉錄為cDNA,(3)設計合適的引物從cDNA文庫中PCR擴增得到抗體V片段基因,(4)將基因克隆至噬菌粒載體中,(5)噬菌粒電轉TG1感受態細胞,(6)用輔助噬菌體感染對數期TG1細胞,擴增純化得到噬菌體抗體庫。
成功構建一個大型多樣化的噬菌體抗體庫的關鍵在于:(1)PCR擴增出多樣化的抗體基因組合庫;(2)抗體基因片段與噬菌粒載體的高效連接;(3)制備超高效率的電轉感受態,提高電轉效率[16]。噬菌體抗體庫質量評價的最佳標準是能否從中篩選出具有研究價值的抗體。
2.2 噬菌體抗體庫分類
噬菌體展示抗體庫可以根據獲得的抗體基因來源進行分類,主要包括:天然文庫,免疫文庫,半合成和全合成文庫。
天然文庫,也被稱為通用文庫,是由未免疫的健康人或動物的外周血淋巴細胞、脾臟和骨髓細胞中B細胞的IgM mRNA構建。由于天然文庫的抗體基因來源于未免疫者,所以該文庫中的抗體不偏向于任何特定的靶標,可用于分離針對所有類型抗原的抗體,也包括非免疫原性、疏水靶點和毒性抗原的抗體[17]。但從天然文庫獲得的抗體因在體內的親和力不夠成熟,往往較免疫庫抗體的親和力弱[18]。通常為了建立一個高度多樣化的天然噬菌體抗體文庫,研究人員會使用大量來自不同種族的抗體基因,并在文庫構建過程中最大限度地提高抗體基因擴增的效率[19]。從實用的角度來看,天然庫是開發抗體的首選文庫,因為它可以針對多種疾病循環利用。
免疫文庫是由免疫的人或動物的血細胞樣本中IgG基因的mRNA構建。由于VH和VL基因片段在體內經歷了自然的親和力成熟過程,這些抗體往往比從類似大小的天然文庫中分離的抗體具有更高的親和力[20]。免疫文庫的規模通常相對較小,但可通過從多個個體或宿主動物中獲取免疫球蛋白基因,來進一步提高抗體庫的庫容和多樣性。免疫庫的缺點是需要免疫,且有時引起的免疫反應是不可預測的或不正確的。而且,由于倫理問題、高成本和繁瑣的程序等原因,我們不可能為每種疾病建立免疫庫,因此構建天然文庫成為研究者的另一種選擇[21]。在醫學研究中,免疫庫常用于分離抗感染性疾病的抗體以及針對癌癥靶點的抗體[22-23]。
半合成抗體庫由天然抗體序列和合成抗體序列組合構建。被報道的半合成庫多通過人工合成隨機化CDR3,再與胚系可變區基因(CDR1和CDR2)組合,然后在體外模擬V(D)J重組構建[24]。在全合成抗體庫中,抗體基因的全部序列均由人工合成。半合成庫和全合成庫增加了抗體基因的多樣性,且不受人抗體基因種類的限制,具有極大的發展優勢[25]。但因抗體基因序列是人工隨機合成的,可能會導致部分克隆沒有生物學活性[26]。半合成文庫和全合成文庫是篩選針對自身抗原抗體的首選 文庫[27]。
2.3 噬菌體抗體庫的抗體片段形式
自1990年以來,不同的抗體形式已被用于構建噬菌體抗體展示文庫。由于大腸桿菌在折疊和分泌復雜的抗體時存在很強的偏倚,所以在大腸桿菌中很難實現生產全長IgG。因此,目前在噬菌體表面展示的均為抗體片段,如單鏈可變片段(scFv)、抗原結合片段(Fab)和單域抗體(sdAb)。
scFv是由抗體輕鏈可變區(VL)和重鏈可變區(VH)通過10-25個氨基酸組成的短而靈活的甘氨酸連接肽(linker)連接而成的單一肽鏈[28]。由于單鏈抗體體積小,其可以與隱蔽的或空間受限的抗原表位結合[29]。單鏈抗體在非目標組織滯留時間短且半衰期短,使其可應用于成像、藥物靶向輸送[30]、放射性核苷酸[31]以及毒素[32]等應用中。Fabs由抗體的整個輕鏈和位于鏈N端的兩個區域(VH和CH1)組成。噬菌體外殼蛋白上顯示的Fab抗體片段具有較高的結構穩定性,并且很容易轉換為完整的IgG抗體,并不會影響其結合活性[33]。重組抗體片段的另一種常見形式為單域抗體(sdAbs),也被稱為納米抗體,其來源于駱駝和鯊魚體內重鏈抗體(HCAbs)的可變區。由于其分子量小(~ 12-15 kD),在溶解度、穩定性和靶標可及性方面表現出一些優勢[34]。
從噬菌體抗體庫中篩選的抗體片段可以直接用于各種應用,也可以根據需要工程轉換成其他不同的形式,如全長單克隆抗體IgG、多價抗體、多特異性抗體以及免疫偶聯物[35]。
3 特異性抗體的淘選
從噬菌體抗體庫中獲得抗原特異性抗體需要經過生物淘選(biopanning)。淘選所用抗原可以是不同的形式,如純化的蛋白、合成的多肽、組織或全細胞[36]。通常體外淘選需要將目標抗原固定在固體表面,如磁珠、聚苯乙烯管或板。但當純化蛋白較難獲得或其在固體表面附著可能發生構象改變時,也可以在溶液中進行淘選,如使用含蛋白G/A、鏈霉親和素的磁珠。包被好抗原后,需使用封閉液封閉固體表面的剩余位點,如BSA、牛奶或酪蛋白,以防止非特異性噬菌體結合到表面[37]。當加入噬菌體抗體庫與固定的抗原相互作用后,大量的未結合或弱結合噬菌體必須通過嚴格的洗滌去除。隨后,結合的噬菌體可通過胰蛋白酶酶解或其他洗脫方法(如稀酸或稀堿)洗脫[13]。然后重新感染大腸桿菌,加入輔助噬菌體后擴增形成一個次級噬菌體抗體庫,用于下一輪淘選。通常經過3-5輪淘選,文庫中展示抗原特異性抗體的噬菌體達到顯著富集。完成生物淘選的陽性噬菌體文庫通過感染TG1細胞后挑選單克隆,然后利用噬菌體ELISA法進行高通量篩選。得到的陽性克隆通過測序可獲得抗體基因序列,以便對其進行下一步的基因工程改造。例如,陽性克隆的單鏈抗體基因可以被重新克隆到細菌表達載體中用于大規模生產,或者通過將可變區插入到含有抗體恒定區的表達載體中來重組成完整的單抗[38]。
最優淘選策略取決于許多參數,包括目標抗原濃度、抗原固定表面的類型、庫的質量以及結合和洗滌條件[39]。因為操縱洗滌條件可以控制結合特性,所以為了分離出高親和力的噬菌體抗體,每輪生物淘選的洗滌強度都應逐漸增加[40]。另外還可使用不同的洗滌條件,如改變pH值或與游離抗原競爭等。生物淘選過程的另一個重點是抗原濃度,一般隨著淘選次數的增加,抗原濃度應該逐漸降低。總之,通過靈活調節淘選壓力,我們可以從噬菌體文庫中得到更多或者親和力更強或者有某種特性的抗體。
4 噬菌體抗體展示技術的優點和局限性
噬菌體抗體展示技術不論是作為抗體發現的有力工具,還是作為抗體工程改造中的篩選工具,都有著傳統技術無可替代的優勢。其優勢主要體現在以下幾個方面:(1)該技術對人或動物的B細胞抗體基因庫進行體外建庫篩選,避免了免疫和細胞融合等步驟,大大縮短了實驗周期。且從構建的人源抗體庫中可直接獲得全人源抗體,免去了抗體人源化過程。(2)通過嚴格控制體外淘選條件可預先設計抗體特性,包括抗原表位特異性[41],甚至構象特異性[42]和種間交叉反應等[43]。(3)可被用于發現具有細微構象差異的靶標抗體,典型的例子是針對阿爾茨海默病肽聚集體的抗體和針對馬爾堡病毒的納米抗體[44-45]。(4)可通過隨機致突變技術,鏈置換或PCR錯配等改變抗體親和力,模擬抗體體內親和力成熟過程,篩選出親和力更高的抗體[46]。(5)使用大腸桿菌原核表達系統使該技術在成本效益和可擴展性方面優于其他真核展示方法,如酵母或哺乳動物細胞展示。
噬菌體抗體展示技術的局限性包括以下幾點:(1)與基于細胞的抗體制備技術相比,噬菌體抗體庫的篩選過程比較繁瑣[47]。(2)該技術無法控制生物淘選過程中的富集程度,這導致一些克隆在生物淘選過程中占主導地位,從而在淘選結束時只有少數陽性克隆。(3)在構建的抗體庫中,抗體可變重鏈(VH)和可變輕鏈(VL)基因通過PCR隨機重組,雖然增加了庫的多樣性,但也破壞了抗體分子的天然狀態,使其穩定性難以保證。(4)噬菌體抗體展示過程必須經過細菌轉化、噬菌體包裝,這大大限制了所建抗體庫的庫容和多樣性。
5 在抗新冠病毒抗體發現中的應用
SARS-CoV-2屬于冠狀病毒科β冠狀病毒屬,是一種單鏈RNA包膜病毒,可通過表面的刺突蛋白(S蛋白)與宿主細胞受體血管緊張素轉換酶-2(angiotensin converting enzyme-2,ACE-2)結合進入細胞[48]。S蛋白包含S1和S2兩個亞基,其中S1亞基C-端區的受體結合域(receptor binding domain,RBD)主要負責與宿主細胞受體結合,是目前篩選新冠中和抗體的主要靶點[49]。目前,國內外多家研究機構和企業正在加快推進新冠病毒中和抗體藥物的開發。噬菌體抗體展示技術在篩選抗病毒感染抗體方面有其獨特的優越性,在此次疫情中也發揮了其強大的功能。
中國科學院生物物理研究所的研究人員利用重組RBD蛋白免疫的小鼠外周淋巴細胞的RNA構建了一個Fab噬菌體抗體庫,然后以RBD作為靶點對抗體庫進行篩選,篩選出與 RBD特異性結合的抗體(H014)后對其進行人源化,通過新冠病毒假病毒和真病毒中和試驗測試其中和活性分別為 3 nmol/L和38 nmol/L[50]。匹茲堡大學的研究者同樣以SARSCoV-2 RBD蛋白為篩選靶點,6 d內從8個天然噬菌體展示抗體文庫(Fab、scFv和VH文庫)中篩選出多個全人源單克隆抗體。其中,IgG1 ab1對SARSCoV-2活病毒有很好的中和效果,IC50約為200 ng/mL。在hACE2轉基因小鼠的動物試驗中,也展示了抑制病毒感染的能力,在預先注射中和抗體之后,5只小鼠中只有一只被新冠病毒所感染[51]。秦成峰課題組通過構建新冠病毒免疫Fab噬箘體抗體庫,篩選出一種對活病毒中和效價可達0.22 nmol/L的高效中和抗體HB27。值得注意的是,HB27也可以防止SARS-CoV-2膜融合。在兩個已建立的小鼠模型中,單劑量的HB27對SARS-CoV-2具有有效的保護作用,且10倍有效劑量的HB27在恒河猴中并未發生明顯不良反應。目前該抗體已經在中國和美國進入臨床研究,是一種很有前途的抗COVID-19免疫療法的候選藥物[52]。Parray 等[53]從天然人源半合成噬菌體抗體庫中篩選出對新冠RBD具有高親和力的單鏈抗體片段II62,并將其進一步設計成另外兩種抗體形式,scFv- Fc和IgG1。在不同的檢測系統中,3種抗體均對SARS-CoV-2 RBD和S蛋白具有較高的結合活性。
納米抗體(Nanobodies,Nbs)體積較小(13-15 kD),具有優良的物理和化學性能,可霧化吸入,直接應用于感染部位,且生物利用度高,患者依從性高。它在治療呼吸道病毒方面具有非常吸引人的潛力[54]。近年來,它們對呼吸道病原體的應用研究也在加速。例如,使用納米抗體對抗MERSCoV[55]、H1N1[56]、H5N1[57]、流感[58]等。因此,通過噬菌體抗體展示技術開發高效的抗新冠病毒納米抗體成為許多科研工作者的研究方向。Wrapp等[59]使用SARS-CoV-1 和MERS-CoV S蛋白對駱駝進行免疫,構建了一個駝源噬菌體納米抗體庫,通過兩輪淘選獲得多個抗S蛋白的納米抗體,其中包括VHH-72。他們還發現VHH72對SARS-CoV-1 和SARS-CoV-2 S蛋白存在交叉反應,且將VHH72轉化為二價人IgG Fc融合體后能更有效地中和SARSCoV-2假病毒S蛋白,IC50約為0.2 μg/mL。此外,Huo等[60]利用SARS-CoV-2 RBD作為篩選靶標,從羊駝天然噬菌體納米抗體庫中分離出兩個納米抗體,H11-D4和H11-H4。它們結合RBD(KD分別為39和12 nmol/L)并在體外阻斷S蛋白與ACE2的結合。這兩種抗體與Fc融合后均能中和SARSCoV-2活病毒,H11-H4的中和活性為4-6 nmol/L,而H11-D4的中和活性為18 nmol/L。Hanke等[61]用SARS-CoV-2 S1-Fc和RBD蛋白免疫羊駝,通過對構建的噬菌體納米抗體庫進行連續兩輪的淘選后,結合ELISA實驗篩選出納米抗體Ty1。他們發現Ty1對SARS-CoV-2假病毒的中和作用可達0.77 μg/mL(54 nmol/L),而Ty1-Fc有效中和作用可進一步提高到約12 ng/mL。低溫電鏡的結構顯示,Ty1可以與“向上”或“向下”構象的RBD結合,并在空間上阻礙RBD- ACE2的結合。同樣,上海羅奇生物醫學科技有限公司使用SARS-CoV-2 RBD蛋白免疫駱駝后,從構建的噬菌體納米抗體庫中鑒定出381個與RBD特異性結合的Nbs,其中Nb11-59對SARS-CoV-2真病毒具有較強中和活性,約為0.55 μg/mL[62]。Dong等[63]從兩個羊駝VHH文庫(天然和合成)中發現了80多種針對SARS-CoV-2 S1蛋白的VHH抗體,其中19種可阻止S/ACE2 的結合。為了分析不同VHH抗體的協同效應,他們構建了雙特異性VHHFc抗體,該抗體對SARS-CoV-2 RBD的結合和S/ACE2 的阻斷明顯強于單價VHH-Fc抗體。其他研究人員也嘗試設計多價、多特異性Nbs來中和SARSCoV-2。如Koenig等[64]利用SARS-CoV-2 RBD和福爾馬林滅活的SARS-CoV-2免疫羊駝,通過對噬菌體納米抗體庫的淘選,發現了4種Nbs(VHHs E、U、V和W)能有效中和SARS-CoV-2真病毒和假病毒。這4個Nbs結合RBD上兩個不同的表位。他們設計了多種二價、三價和多特異性的Nbs,結果發現,VHH EEE(三價抗體)中和SARS-CoV-2假病毒的活性最高,IC50約為0.52 nmol/L。以上報道顯示出了對SARS-CoV-2具有中和作用的Nbs作為抗COVID-19潛在療法的潛力。基于噬菌體抗體展示技術發現靶向SARS-CoV-2 刺突蛋白抗體的臨床前研究如表1所示。
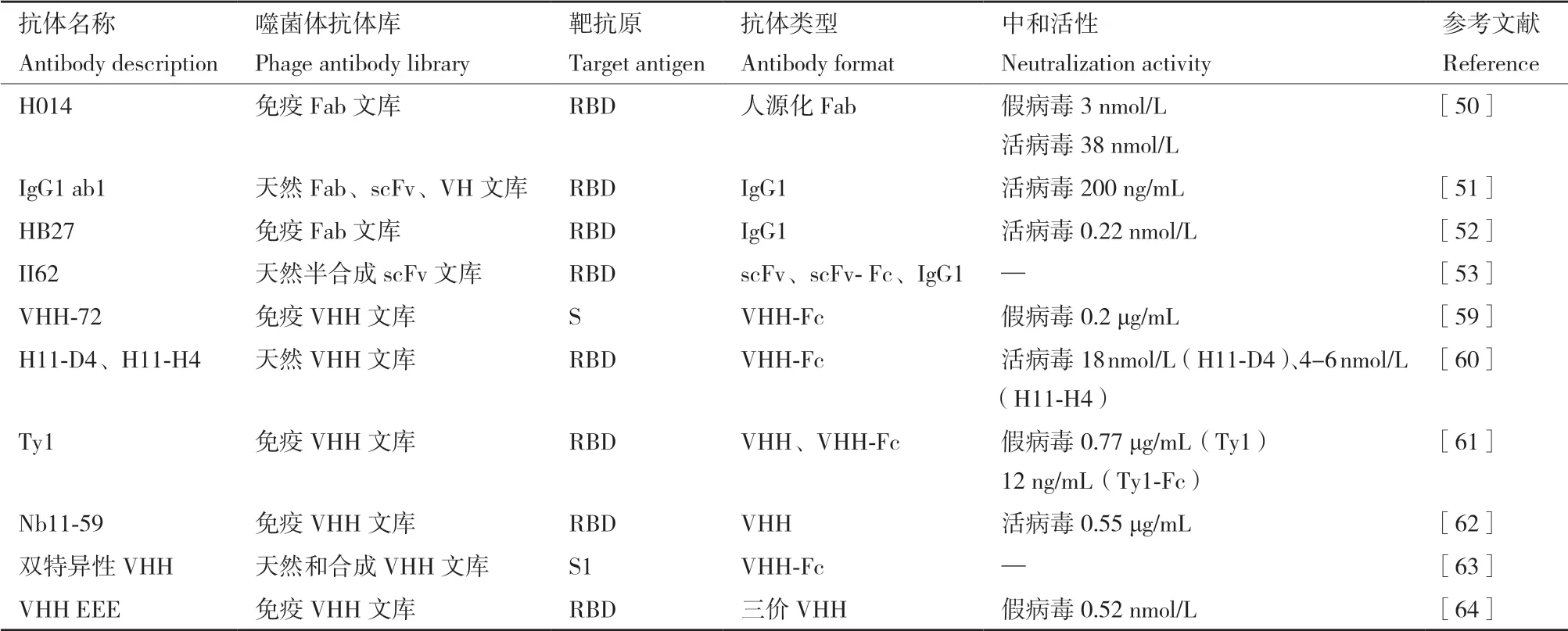
表1 噬菌體展示來源的靶向SARS-CoV-2刺突蛋白抗體的臨床前研究Table 1 Preclinical studies of phage display-derived antibodies targeting the spike protein of SARS-CoV-2
6 結論與展望
噬菌體抗體展示技術是最早也是應用最廣泛的體外抗體篩選技術,其無論是作為抗體發現的源頭技術,還是作為抗體工程中抗體特性改造中的篩選工具,都有著無可替代的優勢和多領域的應用。大量臨床開發中的噬菌體展示衍生抗體證明了這種體外篩選技術在發現治療性抗體方面的價值。一個龐大的多樣性噬菌體抗體庫,在短時間內可篩選出大量針對各種抗原的重組抗體。而且它不需要通過免疫就能分離出針對多種類型抗原的人類抗體,這使它與轉基因小鼠技術、抗體人源化技術和單個B細胞技術一起成為發現人類治療性抗體的主要平臺[65]。過去由于噬菌體展示技術的商業應用僅限于少數擁有其技術專利的公司,導致其發展受限。但近年來,隨著歐洲和美國的大部分噬菌體展示技術專利已經過期,促使該技術在抗體藥物研發等領域得到了廣泛應用。許多研究機構、初創企業和工業實驗室都在不斷對噬菌體抗體文庫的設計、構建和篩選進行優化。由于其獨特的優勢,相信該技術在今后單抗的研發和生產中會愈發地受到重視。
在抗擊新冠疫情的療法開發方面,中和抗體的開發一直是研發的重心之一。因為其可與疫苗一起形成雙重防御性的治療和保護作用。通過噬菌體抗體展示技術,不少研究者發現了對SARS-CoV-2中和活性較好的抗體,其中以納米抗體居多。鑒于納米抗體較穩定、具有容易表達和折疊的特性,有些研究者利用它們構建多價或多特異性分子,大大提高了對SARS-CoV-2的中和活性。雖然納米抗體可霧化吸入,直接應用于感染部位,但我們還需要通過進一步的研究來評估開發基于納米抗體的吸入藥物治療COVID-19的可行性。另外,有研究者認為噬菌體抗體展示技術在分離針對多種SARS相關冠狀病毒或SARS-CoV-2多種變異/突變體的交叉反應抗體方面比其他篩選策略具有優勢[66]。總之,噬菌體抗體展示技術作為一個多功能強大的抗體篩選平臺,為發現和設計新的具有更好藥代動力學特性、安全性和有效性的重組抗體分子提供了巨大的機會。