CRISPR/Cas基因編輯技術及其在微藻研究中的應用
陳映丹 張揚 夏嬙 孫虹霞
(1. 遵義醫科大學珠海校區 免疫與病原生物學教研室,珠海 519041;2. 中國科學院南海海洋研究所 中國科學院熱帶海洋生物資源與生態重點實驗室,廣州 510301)
基因編輯技術是指在基因水平上,對目標基因進行精確插入、刪除和修飾,從而改變基因的結構與功能的生物技術。近年來,基因編輯技術已從鋅指核酸酶(zinc finger nuclease,ZFN)技術、轉錄激活因子樣效應物核酸酶(ranscription activator-like effector nucleases,TALEN)技術,發展到成簇的規律間隔的短回文重復序列CRISPR/Cas(clustered regularly interspaced short palindromic repeats/CRISPR associated)核酸酶系統。其中,ZFN和TALEN技術依賴于DNA序列與蛋白質模板的特異性結合,設計和組裝非常繁瑣,且成本較高。相比之下,CRISPR/Cas技術作為一種新興的基因組編輯工具,能夠引導gRNA對DNA的識別及編輯,具有成本低、設計簡單、高效、特異的顯著優勢。
微藻作為初級生產者[1],種類繁多,約有5萬余種,且分布廣泛,生存條件多樣化,甚至可在高溫、高鹽等極端條件下生存。目前,其在食品、工業、農業、醫學等多個領域均有應用[2],具有改善免疫功能、預防心血管疾病、調節土壤理化性能、生產生物柴油、降解重金屬等功效[3-10]。另一方面,隨著人口的增長,資源儲備的枯竭,以及土地資源和自然環境資源等的不可再生性,使得人們面臨著資源短缺和環境污染的巨大挑戰,對微藻進行遺傳改良,以尋找可替代的資源,成為了人們應對挑戰的重要舉措之一。然而,野生微藻因其自身碳固定率、油脂積累率和產氫效率都較低,加之商業成本高昂等原因,嚴重影響了其大規模應用。因此,尋找并利用一種強大、廉價、精確的基因編輯技術,建立更加經濟綠色的生產工藝,是克服這些問題并實現后期大規模生產的重要策略,其中,CRISPR系統的優越性,無疑可為微藻的遺傳改良和應用提供重要的支持。
鑒于此,本文在簡要介紹CRISPR/Cas基因編輯技術的發展歷程的基礎上,討論了在微藻中應用較為成熟的Cas9和Cpf1兩種系統的不同特征,著重闡述了CRISPR技術在微藻領域的發展方向和應用,并探討了CRISPR基因編輯技術在微藻生物資源開發利用上的發展前景,以期為CRISPR/Cas系統在微藻基因編輯的相關研究提供參考。
1 CRISPR/Cas基因編輯技術概述
1.1 CRISPR/Cas基因編輯技術的發展歷程
CRISPR/Cas可通過特異性RNA引導Csa蛋白對DNA進行靶向切割,是迄今為止已知的原核生物中唯一的適應性免疫系統。自1987年,Ishino等[11]在研究大腸桿菌堿性磷酸酶同工酶轉化時,發現了串聯的、間隔的短回文重復序列,并在其他細菌中得到鑒定[12-17]。但直到2002年,才正式將存在于細菌和古細菌中的有規律的重復序列命名為成簇的規律間隔的短回文重復序列CRISPR,并首次發現在其附近還有CRISPR相關基因Cas[18]。之后,西班牙學者Mojica等[19]發現CRISPR間隔序列與噬菌體和外來質粒序列具有同源性,推測CRISPR可能與細菌的免疫防御有關聯。隨后,Barrangou等[20]證明了CRISPR/Cas系統參與了細菌對噬菌體免疫防御作用的功效。2008年和2010年,CRISPR的干擾工作[21]及其干擾機制[22]分別得到了揭示。此時,科研人員已經對CRISPR/Cas系統的作用機制有了基本了解(圖1)。
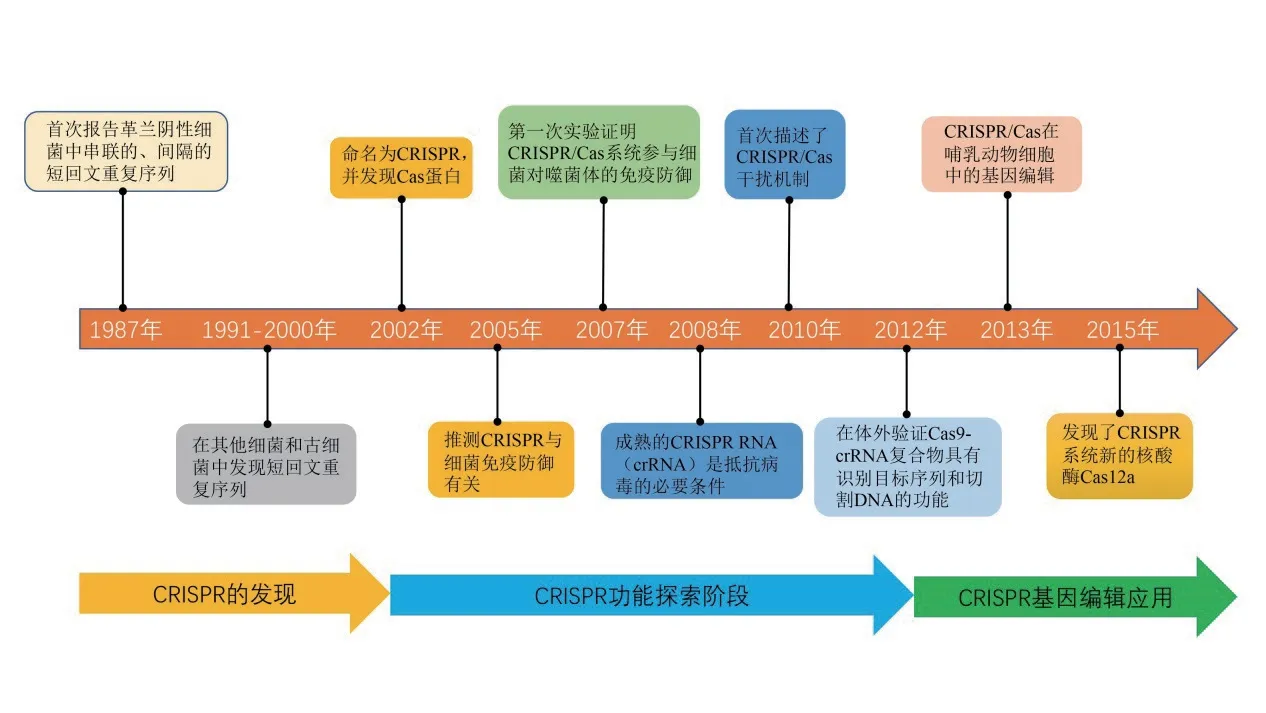
圖1 CRISPR研究發展過程時間線Fig. 1 The time line of the CRISPR development process
2012年,美國Emmanuelle和Jennifer實驗室發現嗜熱鏈球菌CRISPR/Cas系統的Cas9-crRNA復合物在體外引入了DNA特定位點的雙鏈斷裂,該斷裂序列可與crRNA互補,證實Cas9-crRNA復合物作為由RNA引導的核酸內切酶,具有識別目標序列和切割DNA的功能[23-24]。2013年,張鋒團隊首次使用CRISPR/Cas9工具在哺乳動物細胞中進行了有效的基因組編輯[25]。自此,使用CRISPR/Cas9敲除靶基因逐漸成為生物科技領域的熱門研究技術,為基因功能研究、動植物育種和生物量產率增加提供了新的技術支持。
1.2 CRISPR/Cas基因編輯技術的分類
CRISPR系統包括一段成簇的短回文重復序列和一系列Cas蛋白編碼基因,如Cas 1、Cas 2、Cas 4和效應蛋白Cas 9、Cpf 1等,進一步細 化,其可被分為2大類、6種類型和33個子類型(圖2)[26]。其中,Class I類系統包括type I、type III以及type Ⅳ,依賴于多亞基蛋白質復合物,可利用幾種Cas蛋白和crRNA形成效應復合物;Class II類系統包括type II、type V以及type VI,僅使用單一效應蛋白,利用大量的單組分Cas蛋白與crRNA結合以介導干擾過程。目前,由于克隆及在宿主細胞傳遞的便利性,Class II類效應子核酸酶應用更為廣泛,而type II的CRISPR/Cas9系統和type V的CRISPR/Cpf 1系統,是目前研究最深入、應用最廣泛的兩種類型(表1)。
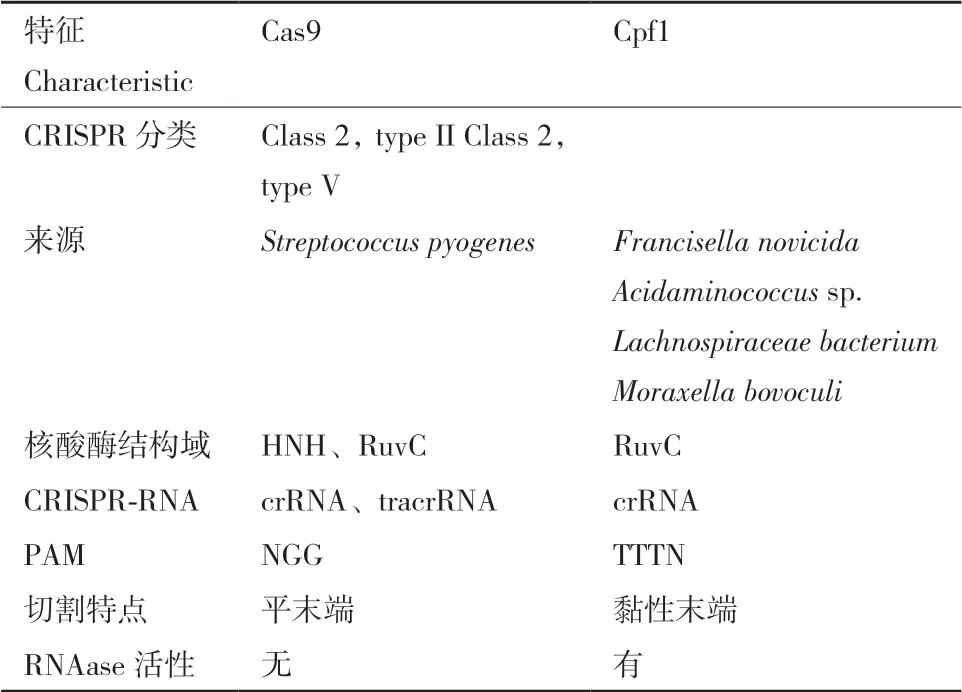
表1 Cas9和Cpf1的不同特征Table 1 Distinct characteristics of Cas9 and Cpf1
1.2.1 依賴于Cas9的CRISPR基因編輯 化膿性鏈球菌Cas9核酸酶(SpCas9)是在植物、動物和微藻中進行基因組編輯最常用的Cas9變體。CRISPR/Cas9免疫防御系統主要包含兩部分,引導RNA(gRNA)和Cas9蛋白。gRNA可結合到一個特定的目標DNA序列,并通過一個簡短的DNA序列,鄰近原間隔相鄰基序(protospacer adjacent motif,PAM)定位,通常是“NGG”[27]。由于 PAM 序列位于外來的 DNA 的原始間隔區旁邊,不在基因組 CRISPR 基因座中的間隔區旁邊,因此 PAM 有助于區分自身和非自身 DNA,從而防止自身免疫的產生。Cas9具有核酸酶活性,負責切割DNA雙鏈。當形成gRNA-Cas9復雜形式,Cas9在PAM序列前的3個堿基點進行雙鏈切割,主要產生平末端[24];切割點通常經過非同源端連接((non-homologous end joining,NHEJ)修復,這種連接通常容易出錯,導致切割點插入或刪除,而這種突變通常會導致移碼突變,影響蛋白質轉錄翻譯,從而破壞基因的功能。
1.2.2 依賴于Cpf1核酸酶的CRISPR基因編輯 2015年,張峰團隊發現了CRISPR系統新的核酸酶Cas12a(后期更改命名為Cpf1)[28]。CRISPR/Cpf1系統與Cas9系統在功能原理上相似,但與Cas9系統相比,存在著以下差別。首先,Cpf1相關的CRISPR陣列在轉錄為成熟的crRNA的過程中,無需tracrRNA和RNase III參與;其二,Cas12識別富含T的更長的PAM序列“TTTN”,Cas9識別富含G的PAM序列“NGG”;其三,Cpf1蛋白切割產生了黏性末端[28]。
與Cas9系統相比,CRISPR/Cpf1系統更具有一些優勢[29],主要表現Cpf1可在不需要tracrRNA的特性的條件下更簡單地制備指導RNA,且Cpf1具有的單個核酸酶結構域(RuvC)體積比Cas9小,編輯效率更準確有效;Cpf1蛋白切割產生的黏性末端,有利于目的基因利用非同源重組的方法插入位點;Cpf1識別更長的原間隔子相鄰基序(PAM),減少了其在富含GC的基因組上被誤讀的機會,從而導致靶標突變效率大大提高[29]。在PAM識別后,Cpf1將目標DNA切割到PAM位點的下游更遠的位置,以使其在非同源末端連接過程中得以保留。而在Cas9中,PAM位點靠近切割位點通常會導致其破壞,從而排除了之后的編輯工作。CRISPR/Cpf1基因編輯可將目標基因重新定位以進行重復編輯,從而提高了目標效率。
1.2.3 CRISPR基因調控 CRISPR干擾和CRISPR激活 CRISPR/Cas 系統還可通過催化失活的 DNasedead Cas(dCas)變體進行基因調控,用于CRISPR干 擾(CRISPR interference,CRISPRi)和CRISPR激活(CRISPR activation,CRISPRa)。如果Cas9的兩個蛋白結構域(HNH和RucV)失活,即可突變為一個保留了靶向DNA結合能力而無催化活性的Cas9蛋白(dCas9)[30-31]。dCas9是調節目標基因轉錄水平的工具,基因抑制的程度可以通過調節dCas9的表達或調節gRNA的結合位置來控制。為了提高效率,dCas9蛋白通常與各種轉錄抑制因子(如KRAB)或者轉錄激活因子(如VP64)融合,使目標基因在雙重效應下受到最大的抑制或上調。此外,與傳統的基因組編輯方法相比,使用CRISPRi造成的抑制是可逆的過程,甚至可以同時調節多個靶基因的表達。基于此,CRISPRi具有發展為一種操縱和修飾代謝途徑關鍵基因工具的潛能。
2 CRISPR/Cas基因編輯技術在微藻中的 應用
作為一種新興的生物技術工具,CRISPR基因編輯技術在生物的基因功能研究,以及動植物品種如水稻、高粱、小麥、大豆和玉米等的遺傳改造等方面展現出了廣闊的應用前景[32-37]。隨著技術的成熟和基因組測序成本的降低,CRISPR技術在微藻上的應用也得到了快速發展。據報道,CRISPR技術在微藻中的應用最早是在模式生物萊茵衣藻中實現的[38],隨著萊茵衣藻[39]和小球藻[40]等藻類基因組測序的完成,明確的遺傳背景更有力地推動了其在衣藻、藍藻等多種微藻基因工程中的研究和應用。將CRISPR技術應用于微藻中,不僅可證明特定基因的功能,開發具有工業性狀的菌株,而且與其他工程核酸酶相比,還具有高效率,高準確性和簡便性的特性。
2.1 衣藻
對模式藻萊茵衣藻的基因工程研究早在幾十年前就開始了[41]。萊茵衣藻具有單細胞形態,培養條件簡單,可自養、異養、混合營養生長等特征,是首批對其線粒體和葉綠體基因組進行測序的藻類之一[42]。同時,許多異源轉基因已在衣藻中表達,包括許多抗生素抗性標記、報告基因等,這些工具的開發對研究基因表達和篩選轉化細胞至關重要。這些特征使得其作為早期研究基因編輯技術的模型藻類。
自2014年CRISPR/Cas9系統首次被應用在萊茵衣藻的基因編輯中,Jiang等[43]也成功將Cas9和sgRNA轉入衣藻細胞進行了短暫表達,并成功敲除了萊茵衣藻中內源的雷帕霉素敏感性基因FKB12。然而,在超過109個細胞的16次獨立轉化實驗中,僅有一個帶有雷帕霉素抗性的突變體菌落產生,表現出極低的轉化效率,并提示Cas9潛在毒性的存在。為了避免Cas9載體引起的細胞毒性和脫靶效應,2016年,Shin等[44]在體外合成Cas9-gRNA核糖核蛋白復合物(RNP),并通過電穿孔方法直接將其轉化至萊茵衣藻中,成功在MAA7,CpSRP43和Ch1M三個不同基因座上獲得CRISPR/Cas9誘導的突變,與載體驅動轉化相比,RNP方法對基因沉默的效率提高了100倍,而且無非靶向效應。
作為具有多種代謝工程技術和工具的模式生物,萊茵衣藻可用于黃斑色素的工業生產。葉黃素和玉米黃質是膳食類胡蘿卜素,可降低年齡相關性黃斑變性,在維持眼睛健康方面發揮著關鍵作用。Baek等[45]使用預組裝的RNP遞送方法敲除玉米黃質環氧化酶(zeaxanthin epoxidas,ZEP)基因,發現ZEP敲除突變體可持續產生玉米黃質,光合產量也得到了大幅度提高[46]。再者,由于Cas9蛋白只具有瞬時活性并隨后被細胞內源蛋白酶降解,因此RNP也減少了脫靶效應和細胞毒性。
2017年,Cpf1核酸酶第一次在萊茵衣藻進行了試驗,通過將Cpf1 RNP與單鏈寡聚脫氧核苷酸(ssODNs)作為DNA修復模板,在萊茵衣藻中實現了同源定向的DNA替代,其共轉染可達到10%的精確效率,且Cpf1 RNP單獨轉化FKB12基因的靶向效率與Cas9 RNP相似。同年,研究人員首次使用CRISPRi系統用于萊茵衣藻中脂質的基因調控[47]。磷酸烯醇丙酮酸羧化酶(phosphoenolpyruvate carboxylase,PEPC)是脫羧酶家族中的一種關鍵酶,它與磷酸烯醇丙酮酸(Phosphoenolpyruvate,PEP)形成草酰乙酸直接相關,草酰乙酸流入三羧酸循環以進行蛋白質合成。通過下調PEPC1編碼蛋白的表達,調節碳在脂質中的流向,成功提高了萊茵衣藻的生物量和脂質積累速率。MAA7是編碼色氨酸合酶 β-亞基的基因,無功能的MAA7突變體可以在含有5-FI色氨酸類似物的培養基上進行營養缺陷型選擇。為解決低下的基因編輯效率,2020年,研究者選擇研究MAA7基因,使用預先組裝的RNP復合體,成功靶向敲除萊茵衣藻MAA7基因[48],通過MAA7突變體的選擇和鑒定,評估MAA7的基因編輯效率[44];通過在RNP上添加雙鏈HDR模板,評估靶向MAA7的HDR敲入效率,闡明了優化RNP復合物的濃度和轉化方案對于實現高效率的靶向敲除的重要性;同樣的,重組位點和HDR模板的濃度的優化對于實現高效率的HDR介導的敲入也至關重要[48]。同時,該優化方法也可以擴展到其他具有工業潛力的藻類。
2.2 藍藻
藍藻以其能利用太陽光和CO2,且遺傳操作適應性好的特性,成為了生產生物燃料和生物衍生化學品的理想底盤生物[49-50]。然而,藍藻基因組的修飾由于部分藍藻是寡倍體或多倍體而變得耗時和復雜。直到CRISPR/Cas技術對基因組編輯方式的改變,使得藍藻的代謝工程有了新的突破。
2016年,研究者第一次在藍藻中使用了CRISPR/Cas9系統。nblA 基因是聚球藻 2973 中藻膽體降解的必需元素。野生型聚球藻 2973 菌株在缺乏硝酸鹽的培養基中生長時表現出黃色漂白效果,但nblA刪除菌株具有明顯的非漂白表型,并在相同條件下保持綠色。通過選擇敲除nblA基因,可觀地表明了在藍藻中瞬時Cas9表達可以實現基因編輯,并且Cas9的存在提高了編輯效率[51]。隨后,Li及其同事通過敲除glgC基因,使藍藻中的大部分碳通量從糖原轉移到琥珀酸酯,從而產生更高水平琥珀酸酯的glgC缺失突變體[52]。但也發現高濃度的Cas9具有毒性,可降低藍藻細胞的生存力,從而促使人們探索通過使用新的Cpf1核酸酶來克服這一障礙。2016年,Ungerer研究團隊[53]對Cpf1和Cas9兩種蛋白的毒性評估結果顯示,Cpf1的毒性顯著低于Cas9,Cpf1是藍藻基因組編輯的較為合適的核酸酶,并首次通過2種藍藻的缺失突變、點突變以及插入突變,研究了Cpf1系統的多功能性[53]。
基因的敲除或敲入有時會損害宿主生物的生存力,但CRISPRi為藍藻工程學提供了另一種可行的方法,該方法依賴于無酶活性的dCas9,這對不能刪除而只能降低其表達的必需基因的研究尤其重要。Yao等[54]首次在藍細菌中引入了CRISPRi系統通過下調phaE和glgC基因,降低多羥基丁酸酯和糖原的產生,抑制phaE基因有效消除了集胞藻屬中的聚羥基丁酸酯(polyhydroxybutyrate,PHB)的合成,抑制glgC基因可使糖原合成大幅度降低。同樣的,Huang等[55]通過抑制glgC、sdhA和sdhB基因,下調糖原合成,使琥珀酸水平提高了12.5倍。Higo及其同事采用CRISPRi技術,通過抑制魚腥藻glnA基因不僅可高效生產銨鹽,還可控制細胞以誘導劑依賴的方式開啟和關閉銨的產生[56]。然而,研究人員在2018年發現dCas9可改變大腸桿菌的形態,使其成異常的絲狀形態,推測dCas9影響了細菌的細胞分裂,并對細胞膜的結構產生了影響[57]。這促使了研究者對不同Cas蛋白CRISPR干擾系統開展了進一步的研究。甲基-赤蘚糖醇-4-磷酸(methylerythritol-4-phosphate,MEP)途徑中關鍵酶的過度表達和融合導致藍藻光合角鯊烯的大量生產,首次藍藻中使用CRISPR/dCpf1系統,有效阻止了轉錄啟動,通過抑制acnB、cpcB2關鍵基因,提高了光合角鯊烯的產量[58]。由此可見,dCpf1介導的CRISPRi系統極大地促進了藍藻代謝工程的研究,是提高藍藻生物量切實可行的技術和方法。
CRISPR的另一個功效是多路復用,即多個基因可以并行編輯而不是單獨靶向。Kaczmarzyk等[59]的研究中運用CRISPR多路復用的作用,將脂肪酰基重新定向至脂肪醇合成,同時抑制了6個編碼消耗酰基ACP途徑的酶的天然基因,使C18脂肪醇生產率提高了3倍左右。多路復用開辟了應用組合方法優化藍藻的可能性,反過來又使藍藻代謝過程得到更大更廣的覆蓋。總之,CRISPR技術的出現及廣泛應用無疑加速了藍藻代謝工程的研究和進展。
2.3 硅藻
硅藻是單細胞真核生物,在全球海洋中碳和硅的循環利用中起著至關重要的作用。同時,由于脂質的高水平積累,硅藻被認為是生物燃料生產的重要候選者,在藥物,化妝品,營養補充劑和生物燃料中具有潛在應用價值。因此,了解CRISPR技術在硅藻工業上的開發應用也極為必要。
2016年,Nymark等[60]首次在硅藻中報道了基于Cas9的基因組編輯技術,通過轉化Cas9-gRNA質粒,對8個突變體的高光敏性生長測定和qRT PCR進行了表征,獲得了生長緩慢,對高光的敏感性增強的CpSRP54突變菌株。同年,Hopes等[61]使用兩個sgRNAs誘導脲酶基因的精確刪除,證明在硅藻Thalassiosira pseudonana進行基因編輯的可行性。
然而,CRISPR / Cas9技術在硅藻中的優化改進仍在進行中,以求突變型菌株的生產不被時間、步驟、脫靶等限制住。2018年,Stukenberg等[62]通過優化CRISPR/Cas9載體構建,簡化了篩選步驟,并誘導了單等位基因和雙等位基因突變。此外,通過CRISPR / Cas9切口酶進行基因組編輯是另一種改良方法。2020年,在海洋硅藻中使用Cas9切口酶進行基因組編輯誘變,靶向TpθCA3基因編輯[63]。通過這種修飾,使得Cas9誘變中潛在的脫靶頻率被最小化。同樣的,Moosburner等[64]通過將Cas9轉錄融合到2A肽的選擇標記上,為Cas9基因選擇抗生素,減少了生產和驗證突變細胞系的時間。然而,Cas9切口酶僅適用于少數幾種模式生物,在微藻的應用報道較少。
2.4 其他
微藻具有巨大的物種多樣性,在生態系統、水產養殖以及生物能源,糧食和飼料部門中都發揮著重要作用。除了上述藻類,CRISPR技術也在不斷地的探索性地應用在其他非模式藻類上。2016年,以工業產油微藻Nannochloropsis oceanica菌株IMET1為模型,建立了一種有效的基于CRISPR / Cas的微藻靶向基因敲除方法[65],從靶向基因敲除的突變菌株中獲得了大約1/1 000-1/100的成功率,比之前報道的[43]編輯效率高了幾個數量級。2017年,Ajjawi等[66]通過刪除在脂質生物合成中充當負調節劑的轉錄因子,使Nannochloropsis gaditana脂質產量增加了一倍。2019年,CRISPR / Cas9系統首次應用于小球藻FSP-E中,通過編輯fad3基因,達到脂質積累增加的結果[67]。盡管目前應用在非模式藻類的種類還不夠多,但隨著研究的深入,相信在不久的未來,CRISPR/Cas技術在藻類的潛力將得到更充分的發揮和利用(表2)。
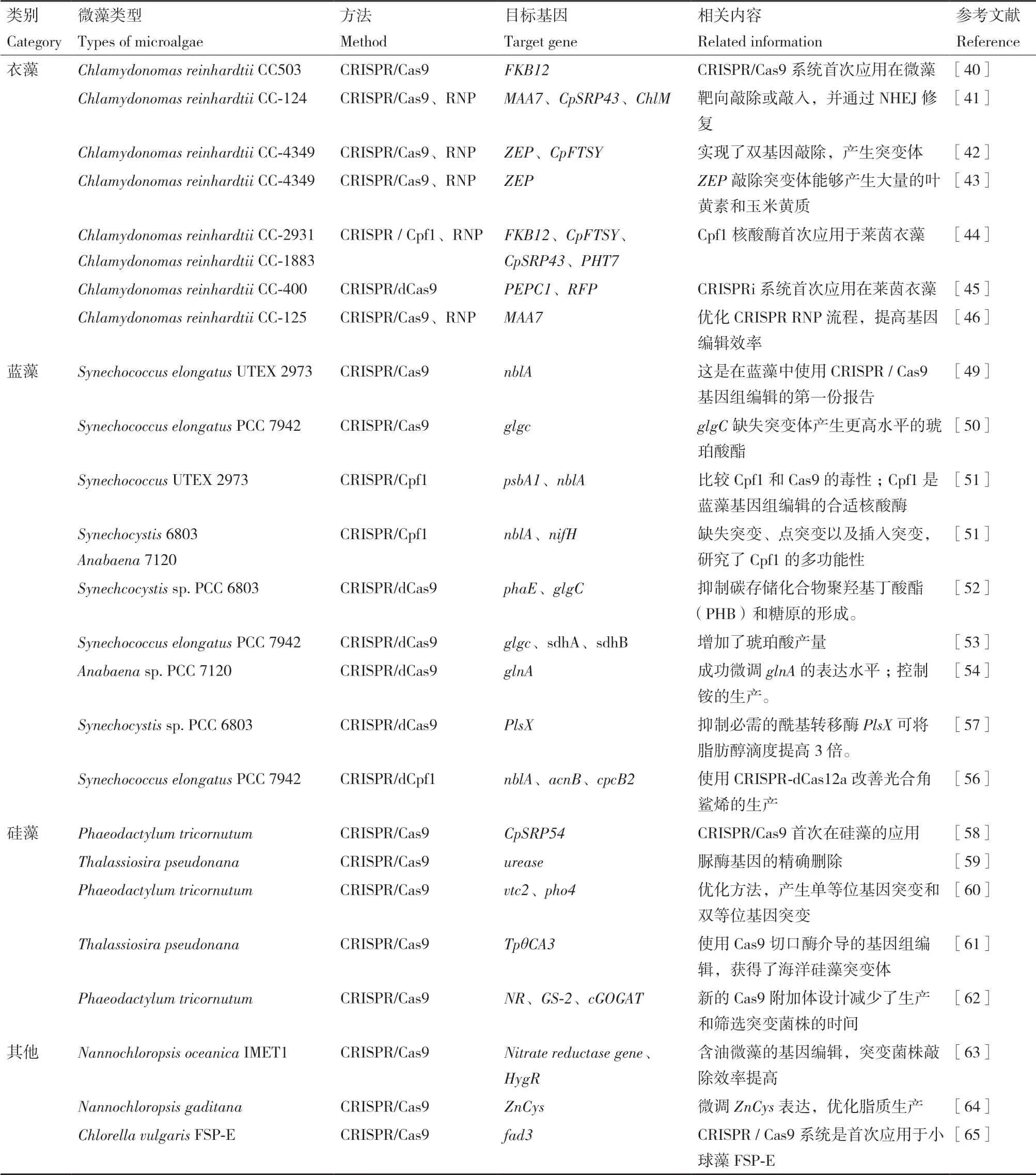
表2 CRISPR技術在微藻中的應用研究Table 2 Research on the application of CRISPR technology in microalgae
3 轉化方法
植物的轉化技術滯后于動物,而微藻的轉化又是在植物轉化技術基礎上實現的。正如Altpeter所指出的,成功的基因編輯是基于生物體的轉化技術的[68]。因此,此部分總結了微藻的轉化技術。
微藻轉化技術的滯后,可能與藻體細胞較小,以及存在保護細胞的細胞壁阻礙有關。藻類細胞壁是阻止外來DNA通過細胞膜進入的物理屏障,因此,許多轉化的方案依賴于細胞壁缺陷的衣藻細胞。目前,微藻常用的核轉化方法有粒子槍介導的生物轉化、玻璃珠方法和電穿孔等3種。1988 年首次使用包被DNA的鎢微粒轟擊萊茵衣藻細胞葉綠體[69]。粒子槍介導的生物轉化是利用微粒輸送系統,將含有外源基因的金屬微粒輸送整合到藻類細胞中,從而越過了細胞壁的生理屏障。但這種方法效率低下,獲得的轉化體少且需要專門的設備。玻璃珠核轉化是一種借助質粒和玻璃珠的存在,攪動細胞壁缺陷的衣藻細胞的方法[70]。玻璃珠方法僅適用于沒有細胞壁的菌株,否則會限制轉入細胞核的DNA量。雖然玻璃珠方法操作簡單,不需要專門的設備,但它的限制性是需要在轉化前用自溶素處理以去除菌株的細胞壁,使這種缺陷的衣藻細胞很難雜交,進而增加了遺傳分析的困難。盡管后期改良的玻璃珠技術(碳化硅代替玻璃珠)可以轉化具有細胞壁的微藻[71],但這種技術形成的毒副產物仍需謹慎處理。
電穿孔是使用最廣泛的轉染方法之一,因為它具有很高的效率和便利性。電穿孔轉化方法,可以用一個或幾個DNA分子將具有完整壁的細胞瞬時或穩定轉化,不需要特殊的細胞壁缺陷菌株或去除細胞壁的處理方法[72],也不會產生有毒的副產物。電脈沖在細胞的質膜上形成瞬時孔后,緊鄰質膜的帶電分子被嵌入膜中,幾小時后,帶電分子會完全穿過質膜并進入細胞,是一種快速簡便的方法。此外,電穿孔技術也是建立篩選目標表型的突變體文庫的簡便方法,其產生的突變體數量比玻璃珠方法高100倍左右,這是其他方法無法比擬的。然而,其所需的設備也比較昂貴。
4 編輯效率的提高
合成生物學時代,依賴于藻類基因工程有望生產如色素、油和脂類、甾醇、淀粉、多糖化合物等新型代謝物,在其中,CRISPR/Cas 系統已逐漸成為主要的基因組編輯工具。目前,提高微藻基因編輯效率可從兩方面入手:(1)合適的轉化方法;(2)CRISPR/Cas 系統引入微藻的模式。
在藻類物種中利用 CRISPR/Cas 的主要限制之一是缺乏高效和穩健的轉化系統。轉化方法的選擇極大地影響了目標宿主工程策略的整體有效性。電穿孔是首選方法,其增加了 DNA 傳遞的數量,缺點在于由于機械損傷導致細胞死亡率較高。除了上述3種傳統的轉化方法,另一種克服細胞壁障礙的策略是利用農桿菌或者細菌結合來介導轉化使 DNA 轉移通過細胞壁。將環狀自我復制附加型質粒轉移到硅藻中,細菌結合方法顯示出在某些微藻物種中進行染色體整合的前景[73]。此外,藍藻在沒有表面活性劑的情況下可從周圍環境中自然吸收 DNA[74]。除了這些經典方法之外,基于細胞穿透肽、細胞穿透聚合物、金屬有機框架、脂質體介導的轉化已在非藻類宿主中得到證實[75],這些尚未廣泛應用于藻類的新興轉化技術可能為DNA表達構建體傳遞到藻類基因組開辟新的途徑。總體而言,DNA 遞送和細胞壁透化的方法根據宿主生物體和目標細胞區室(細胞器或細胞核)而異,不存在一刀切的轉化策略。每個宿主生物都有自己的特性,尤其是細胞壁的存在與否的情況。大多數藻類系統的主要限制是在轉化中提供多組轉基因,而這些新型轉化技術是否有助于在單個轉化步驟中穩定轉化包含多基因途徑的較大 DNA 片段還有待觀察。
另一個決定編輯效率的重要因素是 CRISPR/Cas系統引入微藻的模式。最常用的方法是基于載體的傳遞,Cas9 與sgRNA 一起置于啟動子和終止子的控制之下。生物之間缺乏相容性是合成生物學工具擴展受限的原因之一,尤其是密碼子優化。盡管外源基因整合到微藻中,但轉基因表達通常很弱,根據目標藻體的密碼子偏好性,對Cas基因進行密碼子優化,以確保有效表達。另外,有報道稱Cas9組成型表達對衣藻細胞有毒性,可利用誘導型的啟動子和終止子來解決[43,60]。另一種方法是 Cas9 和 sgRNA 的附加體遞送[76]。附加體,即自我復制且不整合到染色體中的環狀質粒。附加體避免了非目標位置的插入和敲除,并獨立于染色體進行復制,使用附加體表達載體的優勢是,一旦去除選擇壓力,轉化細胞就會逐漸擺脫附加體。與電穿孔、微粒轟擊和玻璃珠攪拌相比,通過細菌結合轉化方法在遞送更大的 DNA 片段方面具有優勢。細菌結合轉化微藻的附加型載體提供了多基因途徑轉移的有效手段。第三種Cas遞送方法是通過 Cas9 核酸酶蛋白和 sgRNA 形成的核糖核蛋白復合物(RNP)。將純化的 Cas9 和體外合成的 sgRNA 孵育以促進復合物的形成并引入靶細胞。RNP 復合物執行 DNA 切割的功能,并在進入細胞后數小時內降解。由于在細胞內的停留時間較短,其具有較小的脫靶率[77]。
5 挑戰與展望
采用 CRISPR/Cas 的編輯系統是一種新興的綠色微藻技術。對CRISPR/Cas的理解和優化使這種生物技術成為一個有前途的手段,可以操縱一些淡水和海洋微藻的基因組。在兩種不同類別和6種不同類型的 CRISPR 系統中,以Cas9 驅動的II型系統在微藻的 CRISPR 研究中使用最多。本文除了回顧CRISPR的機制分類、一些經典的轉化方法外,還重點總結了CRISPR技術在藻類的應用,以期這些新興的轉化方法和不同的遞送方式,為提高轉化效率和轉基因的表達水平提供一些思路和方法。
從目前的報道來看,雖然CRISPR技術已經在藻類的研究中取得了一定成效,但其在應用過程中也存在諸多問題:(1)由于藻類存在細胞壁結構,很難將遺傳物質轉化到微藻中。藻類電穿孔轉化應用最廣泛,但轉化效率還有待進一步的提升。而目前脂質轉染與電穿孔相結合是提高轉化效率的較好選擇。(2)Cas9 RNP的方法雖比載體驅動的Cas9更有效率,但高質量的無毒的重組Cas9蛋白不容易制備,購買成本也較為高昂。(3)微藻可能存在沉默系統[78],在轉錄之后的水平上對抗遺傳物質。沉默組件的暫時關閉可能會提高轉換效率。(4)精確的基因組編輯技術需要精確的誘變而不會產生脫靶事件,這在微藻類中尚未建立良好的誘變體系。總體而言,CRISPR技術還存在一定的局限性,仍需后期的改進,以在微藻進行精準基因編輯。
與其他基因編輯技術相比,CRISPR技術在微藻中的應用進展較緩。隨著全基因組測序技術的更新,CRISPR技術有望加深我們對微藻基因功能和代謝機制的認識,提高對微藻生物燃料和其化學品的開發,為解決能源短缺和環境污染等問題提供了新思路。同時,應警惕基因突變帶來不可預知的風險和潛在的生物安全危機[79],在將CRISPR技術應用于商業用途之前,須考慮CRISPR轉基因產品對環境和生物遏制問題的影響。