QuEChERS-GC-MS/MS測定茶葉中吡唑醚菌酯、嘧菌酯的殘留量
梁少東,伍國怡,張 銓
(北海市食品藥品檢驗所,廣西 北海 536000)
吡唑醚菌酯、嘧菌酯屬于甲氧基丙烯酸類殺菌劑,其主要作用于真菌的線粒體呼吸,從而抑制真菌生長或殺死。因其具有高效、低毒的特點,其使用量在全球逐漸增長[1],在我國茶葉種植中也有使用。我國對茶葉中的吡唑醚菌酯最大允許殘留量為10 mg/kg,但對茶葉中嘧菌酯的最大允許殘留量卻沒有規定[2]。日本肯定列表制度中嘧菌酯在茶葉中的最大允許殘留量為10 mg/kg,歐盟對茶葉中的嘧菌酯最大允許殘留量為0.1 mg/kg。目前我國氣質聯用法檢測茶葉的國標中[3-4],其檢測的農藥并沒有包括吡唑醚菌酯和嘧菌酯。因此,本研究在借鑒檢測甲氧基丙烯酸類殺菌劑[5-9]以及茶葉中檢測農殘文獻方法[10-13]的基礎上,建立了一種利用QuEChERS凈化技術,快速測定茶葉中的吡唑醚菌酯和嘧菌酯的方法。
1 實 驗
1.1 儀器、試劑與材料
TQ-8040NX氣相色譜-串聯質譜儀,日本島津公司;XSE205電子天平,瑞士METTLER TOLEDO公司;ST40R高速冷凍離心機,Thermo scientific。
乙腈,美國Fisher公司;乙酸,上海安譜公司;吡唑醚菌酯(100 μg/mL,1.2 mL)、嘧菌酯(100 μg/mL,1.2 mL)標準物質,壇墨質檢科技股份有限公司;水為娃哈哈純凈水。
樣品來源市場抽檢茶葉15份。
1.2 標準溶液的配制
取吡唑醚菌酯、嘧菌酯標準物質各1.0 mL置于10 mL棕色容量瓶中,乙腈定容至刻度,配成濃度為10 μg/mL的標準儲備液;取適量吡唑醚菌酯、嘧菌酯標準混合液,用乙腈稀釋,配制成0.01,0.02,0.05,0.10,0.20 μg/mL系列濃度。取1 mL空白基質溶液氮氣吹干,加入1 mL相應濃度的混合標準溶液復溶,過0.22 μm微孔濾膜。基質混合標準溶液應現用現配。
1.3 樣品處理
稱取2.00 g試樣于50 mL塑料離心管中,加10 mL水渦旋混勻,靜置10 min。加入10 mL乙腈-乙酸(99:1),6 g無水硫酸鎂、1.5 g醋酸鈉及1顆陶瓷均質子,劇烈振蕩1 min,4200 r/min離心5 min。吸取8 mL上清液加到含1.2 g硫酸鎂、400 mg PSA、400 mg C18及400 mg GCB的塑料離心管中,渦旋混勻1 min。4200 r/min離心5 min,取上清液0.22 μm過微孔濾膜,上GC-MS/MS測試。
1.4 色譜條件
(1)SH-Rxi-5Sil MS 色譜柱(30 m×0.25 mm,0.25 μm);進樣口溫度280 ℃;載氣為高純氦氣,流速1.0 mL/min;恒流模式;不分流進樣;進樣量1 μL。色譜柱升溫溫度:初始溫度100 ℃,以30 ℃/min升至200 ℃,10 ℃/min升至300 ℃,保持10 min。
(2)質譜條件:將吡唑醚菌酯,嘧菌酯進行全掃描,確定母離子,再給予一定的碰撞能量,掃描二級子離子,選取豐度較高的2個子離子分別為定量離子對和定性離子對,最后以MRM模式優化最佳碰撞能量。優化后的質譜參數及保留時間見表1。
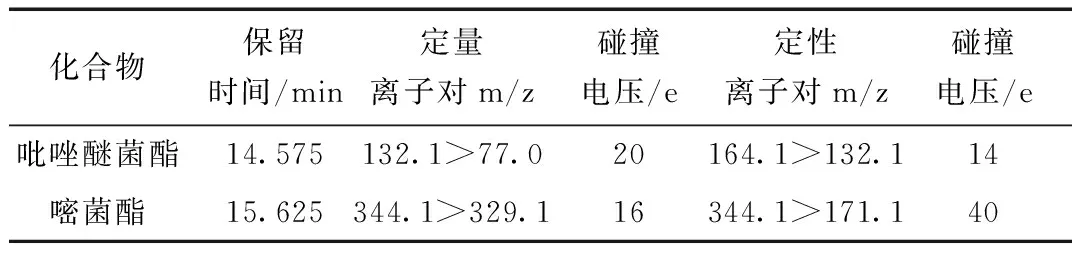
表1 質譜參數
(3)吡唑醚菌酯、嘧菌酯基質標準溶液色譜圖見圖1。
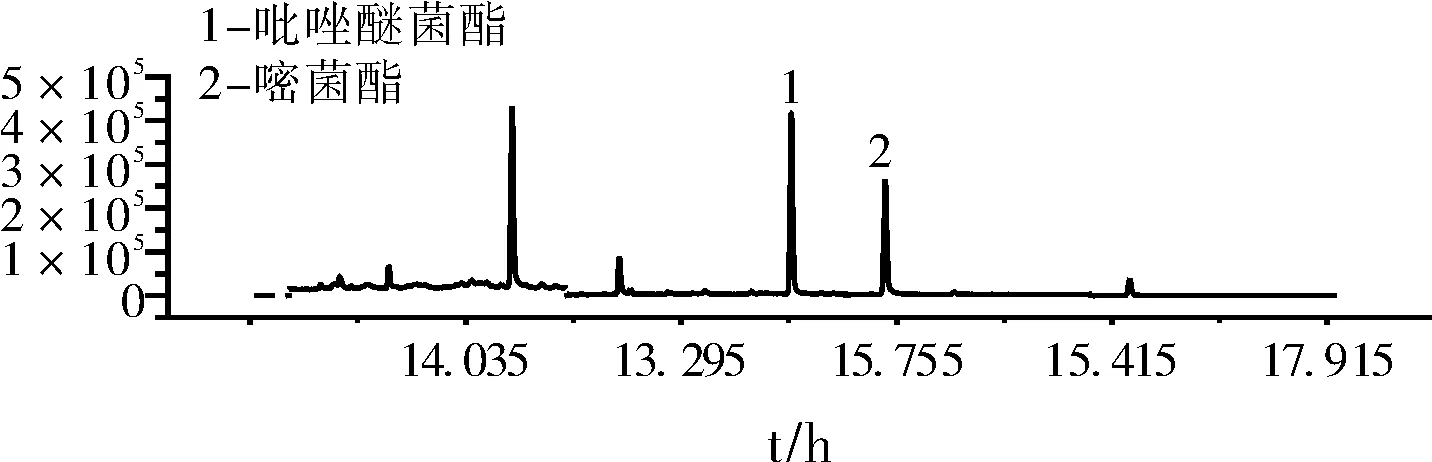
圖1 吡唑醚菌酯、嘧菌酯基質標準溶液色譜圖(0.10 μg /mL)
2 結果與討論
2.1 提取凈化方法
2.1.1 基質效應
基質效應的定義:“樣品中除目標分析物以外的其他成分對待測物測定值的影響”。基質效應可以是基質抑制,也可以是基質增強。在GC-MS/MS中,由于基質的影響,容易產生基質增強效應[14]。茶葉基質復雜,增加凈化步驟容易造成待測農藥的損失。因此本實驗采用茶葉空白樣品提取液,配制基質曲線,外標法定量。
2.1.2 樣品提取溶液
茶葉中農藥殘留的提取,提取液種類較多,主要有乙腈、丙酮、乙酸乙酯、正己烷等。乙腈作為提取劑時,相對其它溶劑,基質本底比較干凈,凈化后的溶液也較少色素殘留。而國標提取處理中,有用乙腈直接提取,也有用乙腈-乙酸(99:1)直接提取。因此,本文主要研究乙腈直接提取與乙腈-乙酸(99:1)提取對回收率的影響作比較。經實驗表明,吡唑嘧菌酯、嘧菌酯在乙腈和乙腈-乙酸(99:1)兩種提取體系中,兩種農藥總體回收率都不高,尤其吡唑醚菌酯回收率不到20%,嘧菌酯回收率在65%左右。但吡唑嘧菌酯在乙腈-乙酸(99:1)體系中回收率比乙腈體系中回收率高,嘧菌酯回收率相差不大,故提取溶劑選擇了乙腈-乙酸(99:1)。
2.1.3 樣品加水浸泡時間
現行國標中對茶葉前處理過程中,有選擇加水浸泡乙腈提取,也有不加水浸泡乙腈直接提取。因此,本文僅就吡唑醚菌酯、嘧菌酯是否加水浸泡,以及加水浸泡時間提取對回收率的影響作研究。經實驗表明,加水浸泡后,回收率比不加水回收率明顯要高。尤其是吡唑醚菌酯加水浸泡后,回收率明顯提高。故本研究前處理過程選擇加水浸泡后乙腈-乙酸(99:1)提取。為選擇最佳的浸泡時間,本實驗將茶葉樣品在同樣的蒸餾水浸泡,分別在10,20,30 min作檢測。比較發現,浸泡10 min,20 min,30 min提取,回收率沒有統計學上的顯著差異。綜合提取時間和回收率的影響,故選擇樣品在提取前加水浸泡10 min。
因為茶葉成品通常是干樣,加水浸泡可以使茶葉充分潤濕,加大了樣品與水的接觸面積,增加提取溶劑乙腈的親和度,更加容易形成分層。乙腈加入醋酸,可以和乙酸鈉形成弱酸性緩沖體系,弱酸性提取對某些農藥不容易造成分解,故最終前處理方法選擇樣品加水浸泡10 min后,乙腈-乙酸(99:1)提取。
2.2 方法的線性、檢出限、定量限、回收率和精密度
以濃度為橫坐標,定量離子對的峰面積為縱坐標繪制標準曲線,結果顯示在相應濃度范圍內,定量離子對的峰面積于質量濃度呈良好的線性關系,相關系數R2均在0.997以上。以S/N=3計算檢出限,S/N=10計算定量限,結果見表2。在陰性茶葉中分別添加3個水平的待測物,每個水平平行測定6次,考察方法的回收率和精密度。結果顯示,方法回收率為75.2%~91.0%,RSD為2.12%~7.14%(n=6)。結果見表2。

表2 線性范圍、線性方程、相關系數(R2)、檢出限和定量限
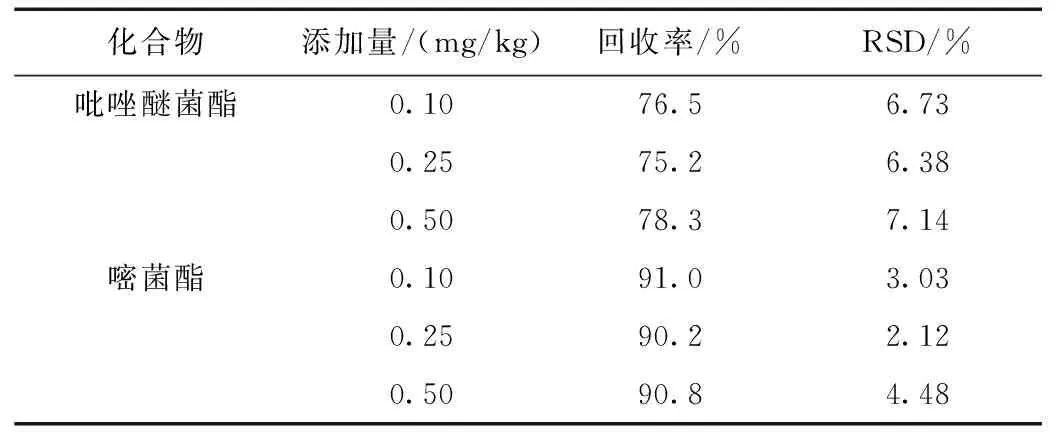
表3 陰性茶葉樣品中加標回收率及相對標準偏差(RSD,n=6)
2.3 樣品監測情況
在市區隨機抽取的15份茶葉中,有紅茶、綠茶、烏龍茶等。經檢測,15份樣品中吡唑醚菌酯、嘧菌酯均沒有檢出。
3 結 論
本研究建立了QuEChERS-GC-MS/MS測定茶葉中的吡唑醚菌酯、嘧菌酯的分析方法。考察了茶葉提取溶劑和茶葉浸泡時間對測定結果的影響,線性,回收率,精密度均符合實驗要求。本方法前處理簡單,快速,可批量操作,可用于茶葉中吡唑醚菌酯、嘧菌酯殘留量快速篩查和檢測。

