HPLC-MS/MS測定動物性食品中氟苯尼考及氟苯尼考胺殘留量結果的不確定度評定
◎ 韓瑨烜,高 鑫,宋 敏,嚴 婭
(新疆維吾爾自治區產品質量監督檢驗研究院,新疆 烏魯木齊 841100)
氟苯尼考(Florfenicol,FF)是氯霉素類的動物專用廣譜抗生素,是畜禽養殖業常用的一種抗菌效果極好的藥物[1]。氟苯尼考的主要代謝物為氟苯尼考胺(Florfenicol Amine,FFA),因此標準中計算氟苯尼考殘留量時通常是計算以上述兩種物質的含量之和。目前,液相色譜-串聯質譜法是檢測氟苯尼考與氟苯尼考胺殘留量的常見方法,《食品安全國家標準 動物性食品中氟苯尼考及氟苯尼考胺殘留量的測定 液相色譜-串聯質譜法》(GB 31658.5—2021)自2022年 2月1日起開始實施,實施后大部分畜禽肉中氟苯尼考的測定均須按照此標準執行[2]。
測量不確定度的評定可以體現檢測結果的可靠性,是食品檢測中質量控制的重要內容[3-4]。檢測和校準實驗室能力認可準則(ISO/IEC17025:2005)要求檢測和校準實驗室必須建立并實施測量不確定度評估程序。本文依據GB 31658.5—2021、《化學分析中不確定度的評估指南》(CNAS—GL06:2019)、《常用玻璃量器檢定規程》(JJG 196—2006)等標準[5],對動物性食品中氟苯尼考與氟苯尼考胺殘留量測定的不確定度進行評定,旨在為采用新標準檢測時的質量評價以及關鍵點控制提供重要參考。
1 材料與方法
1.1 材料與儀器
樣品為實驗室內部質控樣品。氟苯尼考(99.8%,BePure);氟苯尼考胺(99.2%,BePure);氯霉素-D5(100 μg·mL-1,BePure)。
LC-MS 8045超高效液相色譜-三重四極桿質譜儀(日本島津公司);Hettich 380R型高速冷凍離心機(德國海蒂詩公司);YP2002百分之一電子天平(上海越平科學儀器有限公司);AUW120d十萬分之一分析天平(日本島津公司);10~1 000 μL可調微量移液器(艾本德中國有限公司);所有玻璃量器均為A級。
1.2 方法
1.2.1 樣品制備
按照GB 31658.5—2021中樣品制備方法進行。
1.2.2 液相色譜條件
色譜柱:C18色譜柱;柱溫:35 ℃;進樣量:1 μL;流動相:A/B=0.1%甲酸-水/乙腈;流速:0.2 mL·min-1。
1.2.3 質譜條件
電噴霧(ESI)離子源;正離子(氟苯尼考胺)、負離子(氟苯尼考、氯霉素-D5)掃描模式;多反應監測(Multiple Reaction Monitoring,MRM);噴霧電壓:3 000 V;去溶劑溫度:500 ℃;氣簾氣壓力: 240 kPa;霧化器壓力:350 kPa。其他參數詳見表1。

表1 氟苯尼考和氟苯尼考胺主要質譜參數表
2 測量數學模型
2.1 數學模型的建立
以配制的工作溶液濃度(μg·L-1)為橫坐標,以工作液峰面積與其內標峰面積之比(響應值)為縱坐標,繪制標準工作曲線。計算公式為:
式中:X為試樣中待測組分的含量,μg·kg-1;c為從標準曲線上測得試液中待測組分的質量濃度,μg·L-1;m為試樣質量,g;V為試樣提取液總體積, mL;f為樣品制備過程中的稀釋倍數。
2.2 不確定度來源分析
分析測定過程中不確定度來源,見圖1。
3 分量計算
3.1 測量重復性引入的相對不確定度ur()
按照樣品處理方法,平行稱取質控樣品6份(n=6),根據公式,計算出單個樣品因測量重復性引入的相對不確定度,結果見表2。
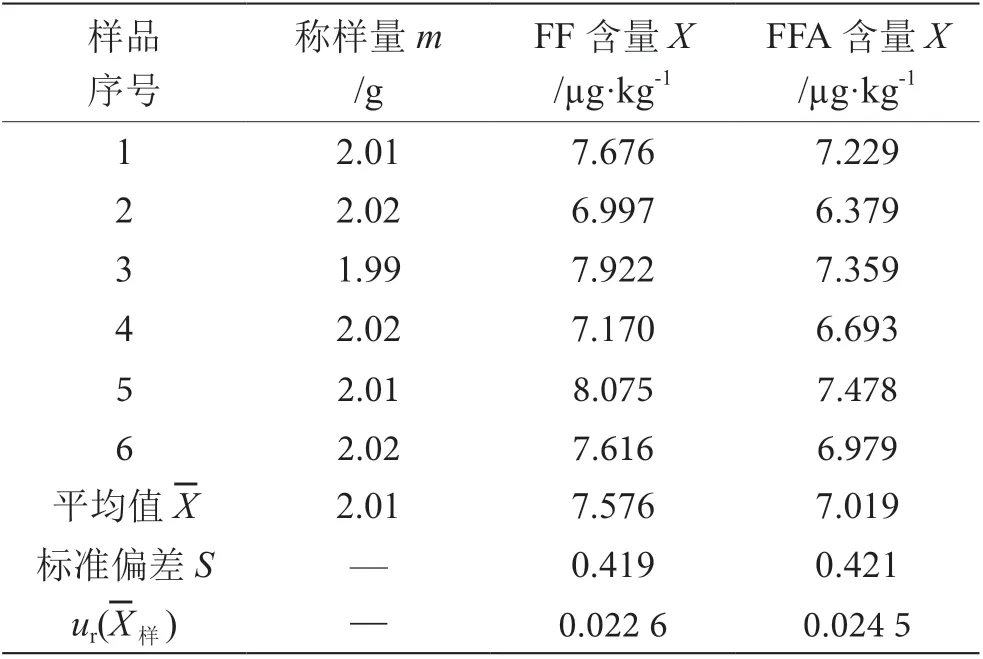
表2 樣品重復性測定結果表(n=6)
3.2 樣品溶液制備引入的相對不確定度
3.2.1 樣品稱量引入的相對不確定度ur(W樣)
使用精度為0.01 g的天平稱取豬肉樣品,實際稱量待測樣品平均質量為m=2.01 g,天平校準證書說明天平最大允許誤差M=±0.05 g,假設為均勻分布
3.2.2 樣品定容引入的相對不確定度ur(V樣)
定容溶劑由可調移液槍吸取500 μL加入,經查《移液器檢定規程》(JJG 646—2006)知該移液槍容量允許誤差M=±1.0%,假設為均勻分布不考慮溫度波動引起的溶劑體積變化,則不確定度,相對不確定度ur(V樣)=
3.2.3 內標體積引入的相對不確定度ur(Vis)
內標由可調移液槍吸取100 μL加入,經查《移液器檢定規程》(JJG 646—2006)知該移液槍容量允許誤差M=±2.0%,假設為均勻分布不考慮溫度波動引起的溶劑體積變化,則不確定度,相對不確定度
3.3 混合標準系列溶液配制引入的相對不確定度
3.3.1 標準儲備液引入的相對不確定度ur(Cs)
稱取FF標準物質0.010 08 g和FFA標準物質 0.010 11 g,分別置于10 mL容量瓶中,乙腈定容至刻度,制成1 mg·mL-1的標準儲備液。不確定度主要由標準物質稱量u(Ws)、10 mL單標線容量瓶(A級)的容量允許差不確定度u(Cs-容-10mL)及實驗室溫度波動不確定度u(Cs-溫-10mL)引入。
經查萬分之一天平檢定證書知最大允許誤差M=±0.000 05 g,假設為均勻分布,則=0.002 84。
根據《常用玻璃量器檢定規程》(JJG 196—2006)知10 mL單標線容量瓶(A級)的容量允許差M=±0.020 mL,假設為均勻分布,則
定容時實驗室溫度25 ℃,量器校準時溫度20 ℃,乙腈的體積膨脹系數為0.001 37 ℃-1,假設為均勻分布,則:
兩項合并得:
因此,標準儲備液配制引入的相對不確定度ur(Cs-FF)==0.005 00;ur(Cs-FFA)==0.005 00。
3.3.2 內標工作液配制引入的相對不確定度ur(Cis)
用移液器量取1.0 mL氯霉素-D5置于10 mL容量瓶中,用乙腈稀釋至刻度并搖勻,制成濃度分別為 10 μg·mL-1的氯霉素-D5內標儲備液,再用移液槍從儲備液中吸取0.1 mL置于10 mL容量瓶中,制成濃度為0.1 μg·mL-1的氯霉素-D5內標工作液。不確定度主要由移液槍的容量允許誤差u(Cis-移)、10 mL單標線容量瓶(A級)的允許差不確定度u(Cis-容)及實驗室溫度波動不確定度u(Cis-溫)引入。
經查《移液器檢定規程》(JJG 646—2006)知 1 000 μL移液槍容量允許誤差M=±1.0%,假設為均勻分布,則不確定度相對不確定度
已知移液器吸取0.1 mL時相對容量允許差的相對不確定度為0.011 5(3.2.3),10 mL容量瓶定容時相對不確定度為0.004 11(3.3.1),則:
3.3.3 混標中間液配制引入的相對不確定度ur(C混)
使用移液槍分別量取FF、FFA標準儲備液0.1 mL,置于同一100 mL容量瓶中,用乙腈定容至刻度并搖勻,制成濃度為1.0 mg·L-1的FF、FFA混合標準中間液。不確定度主要由移液槍的容量允許誤差u(C混-移)、100 mL單標線容量瓶(A級)的容量允許差不確定度ur(C混-容-100mL)及實驗室溫度波動不確定度ur(C混-溫-100mL) 引入。
已知移液器吸取0.1 mL時相對容量允許差的相對不確定度為0.011 54(3.2.3)。根據《常用玻璃量器檢定規程》(JJG 196—2006)知100 mL單標線容量瓶 (A級)的容量允許差M=±0.10 mL,假設為均勻分布,則定容時實驗室溫度25 ℃,量器校準時溫度20 ℃,乙腈的體積膨脹系數為0.001 37 ℃-1,假設為均勻分布,則=0.395 mL。
兩項合并得:
因此,混標中間液配制引入的相對不確定度為:
3.3.4 混合標準系列工作液配制引入的相對不確定度ur(C工)
用移液槍分別量取混合標準中間液20 μL、50 μL定容至100 mL容量瓶中,依次加入氯霉素-D5同位素內標儲備液200 μL,再用移液槍分別量取10 μL、20 μL、50 μL、100 μL至10 mL容量瓶中,依次加入氯霉素-D5同位素內標儲備液20 μL,均由乙腈定容至刻度,配制成FF、FFA濃度依次為2 μg·L-1、5 μg·L-1、 10 μg·L-1、20 μg·L-1、50 μg·L-1和100 μg·L-1混 合 標準系列工作液,混合標準工作液中含有氯霉素-D5同位素內標濃度為20.0 μg·L-1。不確定度主要由移液槍的容量允許誤差u(C工-移)、容量瓶的容量允許差不確定度ur(C工-容)及實驗室溫度波動不確定度ur(C工-溫) 引入。
已知10 mL容量瓶定容時相對不確定度ur(C工-10mL) 為0.004 11(3.3.1),100 mL容量瓶定容時相對不確定度ur(C工-100mL)為0.003 99(3.3.3)。經查《移液器檢定規程》(JJG 646—2006)知移液槍各吸液量下容量允許差M,假設為均勻分布,不考慮溫度波動引起的溶劑體積變化,各吸液量相對不確定度的計算結果見表3。

表3 ur(Cis)計算結果表
故混合標準系列工作液配制引入的相對不確定度為:
3.3.5 標準曲線擬合引入的相對不確定度ur(C擬)
FF、FFA標準系列工作液每個濃度點平行測定2次,利用工作站繪制標準曲線。標準曲線信息見表4,計算結果見表5。
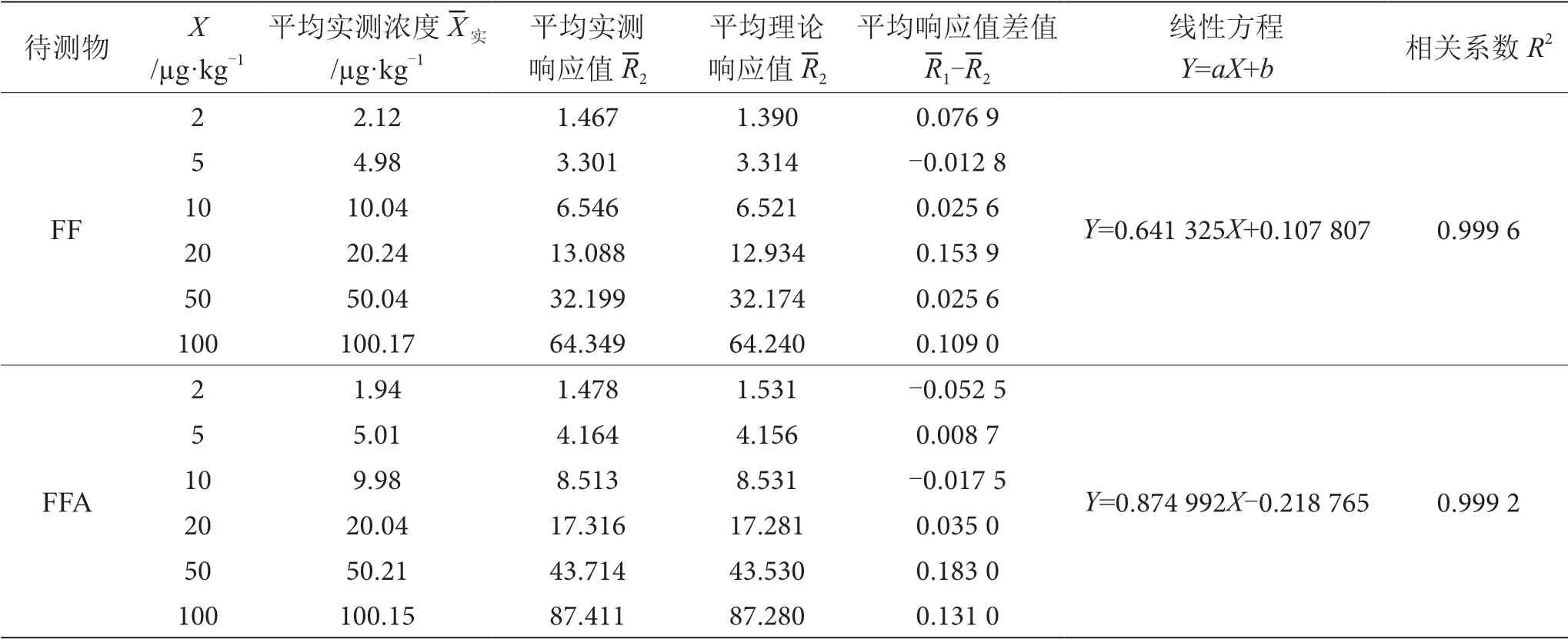
表4 氟苯尼考、氟苯尼考胺線性回歸方程及相關系數表
根據公式(2)~(4)計算得到ur(C擬),結果見表5。

表5 ur(C擬)計算結果表
式中:S為標準溶液平均響應值差值的標準偏差;P為樣品平行測定的次數,P=6;n為標準溶液測定的總次數,n=12;為樣品溶液的平均質量濃度,μg·kg-1;X實為標準溶液的實際質量濃度,μg·kg-1;為標準溶液的平均質量濃度,μg·kg-1;a為工作曲線斜率。
3.3.6 原始標準物質純度引入的相對不確定度ur(P)
經查詢標準物質證書可知,FF的純度為99.8%,標準不確定度為±1%,k=2,則u(PFF)=0.001/2=0.000 5,ur(PFF)=0.000 5/0.998=0.005 01;FFA的純度為99.2%,標準不確定度為±2%,k=2,則u(PFFA)=0.002/2=0.001,ur(PFFA)=0.001/0.992=0.002 01。
3.4 儀器分析引入的相對不確定度ur(E)
查詢高效液相色譜-質譜聯用儀校準證書知,該儀器的測量重復性(RSD)為2%,假設為均勻分布,則儀器分析引入的相對不確定度
3.5 回收率測試隨機效應引入的相對不確定度ur(R)
對同一樣品分高中低3個濃度合計加標9次(n=9),上機測得FF、FFA的加標回收率,結果見表6。根據公式(5)計算得到9次加標實驗的標準偏差S(R),根據公式(6)和(7)計算得到回收率測試過程中引入的相對不確定度ur(R),結果見表6。
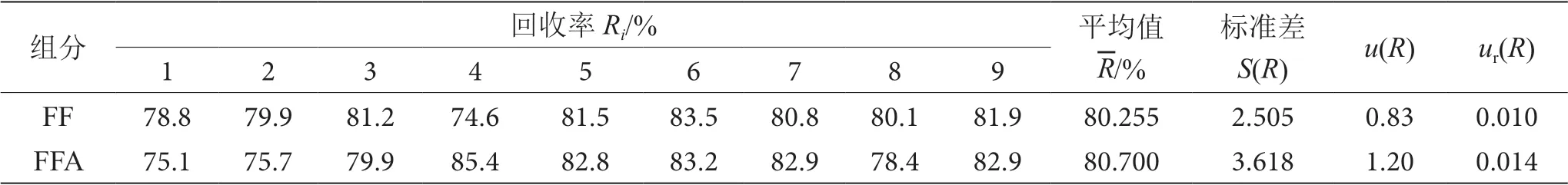
表6 ur(R)計算結果表
用t檢驗對回收率進行顯著性檢驗,計算公式為取P=0.95,查閱t檢驗表,t(0.05)=2.57,即當t值大于2.57時,與100%有顯著性差異,必須在計算公式中采用以修正結果。計算FF、FFA的t值分別為7.880、5.334,因此計算公式均需要代入回收率。
4 合成標準不確定度
氟苯尼考和氟苯尼考胺的相對不確定度分量見表7。
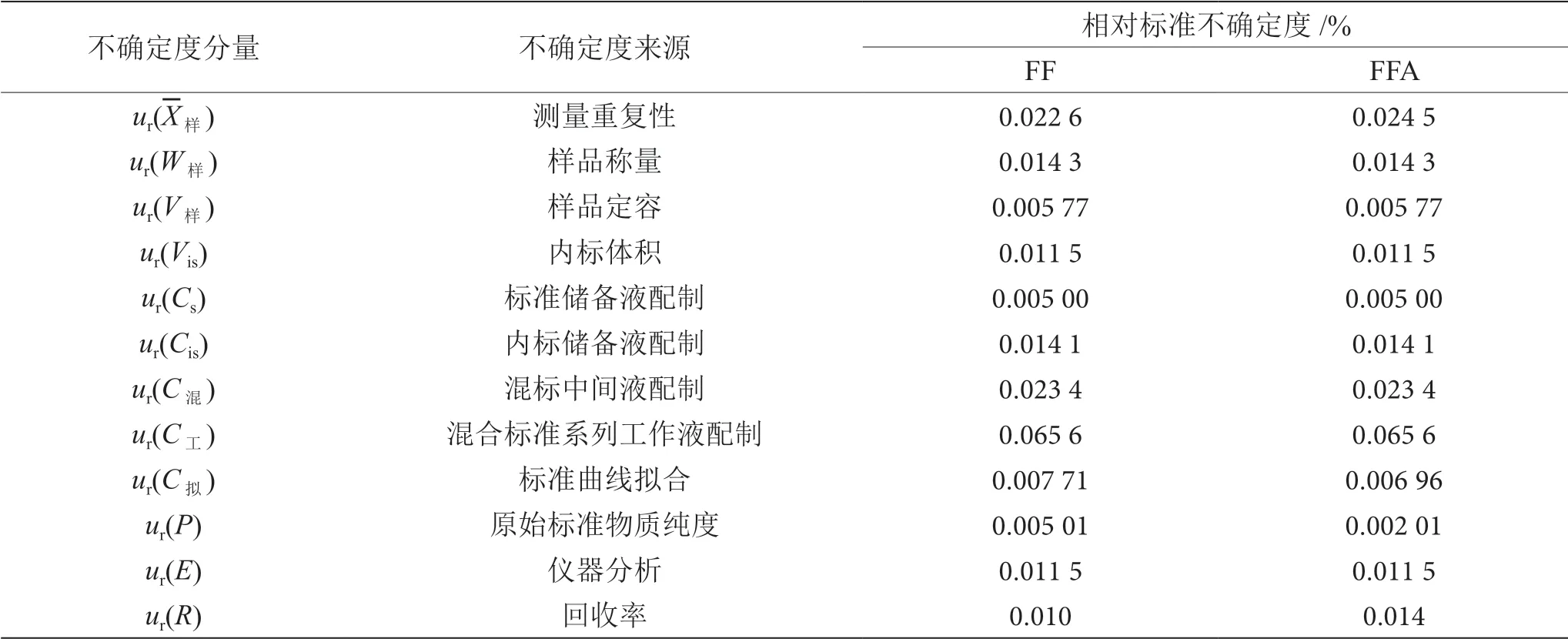
表7 氟苯尼考和氟苯尼考胺相對不確定度分量表
根據表中各不確定度分量,若不考慮不確定的相關性,則FF合成不確定度為:
同理,FFA合成不確定度ur(WFFA)=0.080 2。
5 擴展不確定度及結果表示
根據《化學分析中不確定度的評估指南》(CNAS—GL006:2018),取包含因子k=2時(95%置信度),依據《化學分析測量不確定度評定》(JJF 1135—2005),擴展不確定度UFF=ur(WFF)×2×;UFFA=ur(WFFA)×2×;由此得到動物源性食品中FF、FFA的測定結果,見表8。

表8 豬肉中氟苯尼考和氟苯尼考胺殘留量不確定度評定結果表
6 結論
本研究應用《食品安全國家標準 動物性食品中氟苯尼考及氟苯尼考胺殘留量的測定 液相色譜-串聯質譜法》(GB 31658.5—2021)對豬肉中氟苯尼考與氟苯尼考胺殘留量進行測定,并根據數學模型對測定過程中不確定度各分量進行評定[6]。采用該方法,測定結果的不確定度主要來源于混合標準系列工作液的制備、混標中間液的制備、測量重復性3個部分,其中移液槍容量允許差引入的不確定度最顯著。因此,在混標梯度工作液的配制過程中應當選擇經過檢定校準的移液槍,并增加標準溶液的測定次數,盡可能減少因移液槍容量允許差引入的不確定度[18];做好儀器的檢定校準工作,使儀器保持足夠的精密度與靈敏度;試驗應采取雙人雙樣檢測,最大程度減少人為因素導致的偶然誤差對結果的影響。

