多囊卵巢綜合征患者血清PPARr、SFRP5的表達及對胰島素抵抗的診斷價值
王麗先,吳暖暖,林芳,金潔瓊,王燕
(青島市膠州中心醫院婦科,山東 青島 266300)
多囊卵巢綜合征(polycystic ovarian syndrome,PCOS)是常見婦科內分泌疾病,主要表現為雄激素分泌過多、卵巢多囊性改變、排卵功能障礙、代謝功能異常等,在育齡期女性中發病率約為6%,是女性不孕不育的常見原因之一[1]。部分PCOS患者伴有胰島素抵抗(insulin resistance,IR)和高胰島素血癥,增加子宮內膜癌、血脂異常、心血管疾病和2型糖尿病的風險,誘發多種慢性消耗性疾病,嚴重影響女性健康[2]。過氧化物酶體增殖激活物受體γ(peroxisome proliferators-activated receptor γ,PPARγ)能調節脂肪細胞的增殖分化及炎性因子的釋放,對糖脂代謝的調控具有重要作用[3]。分泌型卷曲相關蛋白5(Secreted Frizzled Related Protein 5,SFRP5)作為抗炎脂肪因子,可抑制脂肪組織中炎癥細胞的激活,減少炎性因子分泌[4]。有研究[5]表明,POCS的發病過程與IR密切相關,而PPARγ及SFRP5能夠調節糖、脂代謝過程,可能直接或間接參與了IR的發生過程。因此,本研究擬通過分析PCOS患者PPARγ、血清SFRP5、IR及糖、脂代謝情況,明確PPARγ、SFRP5與胰島素抵抗及其它指標的相關性,為PCOS的評估及臨床干預提供進一步的理論基礎。
1 資料與方法
1.1 一般資料
選取2020年6月至2021年12月青島市膠州中心醫院收治的102例PCOS患者為研究對象,根據胰島素抵抗指數(HOMA-IR)將患者分為IR組(HOMA-IR≥2.69,n=58)和非IR組(HOMA-IR<2.69,n=44)。本研究經院倫理委員審核批準,患者及其家屬知情同意。兩組患者年齡、BMI、家族史、月經情況、平均卵巢體積、血壓及腰臀比等一般資料比較,差異無統計學意義(P>0.05)。見表1。納入標準:(1)符合《多囊卵巢綜合征中國診療指南》中關于PCOS的診斷標準[6]:患者表現為無排卵或稀發排卵;月經紊亂或出現高雄激素血癥;經超聲檢查至少一側卵巢體積>10 cm或直徑2~9 cm小卵泡>12個,以上3種情況滿足其中兩種并排除柯興氏綜合征、先天性腎上腺皮質增生等其他造成雄激素過高的病因;(2)均為育齡期女性。排除標準:(1)存在排卵性月經失調;(2)子宮內膜異位癥;(3)合并嚴重肝腎功能不全、循環系統疾病或惡性腫瘤;(4)伴其他內分泌系統疾病;(5)納入研究前3個月內有激素類藥物史或手術史。

表1 兩組患者一般資料比較
1.2 方法
抽取所有受試者晨起空腹外周靜脈血標本5 mL,3 000 rpm離心10 min取血清于-80 ℃保存備用。(1)采用酶聯免疫吸附法(晶抗生物工程有限公司)檢測血清PPARγ、SFRP5、白細胞介素-6(IL-6)、促黃體生成素(LH)、睪酮(T)表達水平,選取聚苯乙烯板條,將待測樣本10 μL置于板條的反應孔內,加入樣本稀釋液40 μL,將不同濃度的標準品50 μL加入標準品孔內。反應孔及標準品孔均加入新鮮稀釋的酶標抗體0.1 mL,于37 ℃下孵育45 min,經洗滌后加入TMB底物0.1 mL,于37 ℃下孵育30 min。各孔均加入硫酸終止液50 μL,于15 min內在450 nm處檢測各孔OD值并求出患者上述指標表達水平。(2)采用全自動蛋白分析儀(Beckman,IMMAGE 800)行免疫比濁法檢測血清超敏C反應蛋白(hs-CRP)表達水平。(3)收集受試者空腹血糖(FPG),檢測患者空腹血漿胰島素(Fins)、總膽固醇(TC)、甘油三酯(TG)水平,利用穩態模型評估穩胰島素抵抗指數(HOMA-IR),即HOMA-IR=FPG× FIns/22.5。
1.3 統計學分析
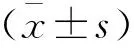
2 結果
2.1 兩組患者血清PPARγ、SFRP5、炎癥因子及性激素水平比較
IR組患者PPARγ、血清SFRP5水平低于非IR組;hs-CRP、IL-6、LH及T水平高于非IR組,差異均有統計學意義(P<0.05)。見表2。
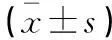
表2 兩組患者血清PPARγ、SFRP5、炎癥因子及性激素水平比較
2.2 兩組患者糖脂代謝指標比較
IR組患者FPG、FIns、TC、TG水平高于非IR組,差異有統計學意義(P<0.05)。見表3。
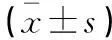
表3 兩組患者糖脂代謝指標比較
2.3 血清PPARγ、SFRP5診斷PCOS患者合并IR的價值
ROC曲線分析顯示,血清PPARγ、SFRP5及二者聯合診斷PCOS患者合并IR的效能均較高(P<0.05)。見表4。

表4 PPARγ、SFRP5診斷PCOS患者合并IR的價值
2.4 PPARγ、SFRP5與IR及其他指標的相關性
PCOS患者PPARγ表達與HOMA-IR、hs-CRP、IL-6、LH、T、FPG、FIns、TG水平呈負相關(P<0.05),SFRP5與HOMA-IR、hs-CRP、IL-6、FPG、FIns、TC、TG水平呈負相關(P<0.05)。見表5。

表5 PPARγ、SFRP5與IR及其他指標的相關性
3 討論
PCOS患者可出現不同程度的IR,國外研究[7]顯示,PCOS患者IR發生率為50%~70%,糖、脂代謝與其發病密切相關。由于PCOS患者存在線粒體突變或功能異常,影響細胞能量代謝,引起胰島細胞的凋亡,導致胰島素代謝紊亂,故IR也是目前研究和治療針對的重要臨床靶點之一[8]。PPARγ參與卵巢的正常生理功能調節,是調節卵巢功能的關鍵因子;SFRP5由脂肪組織分泌,是調節機體炎癥反應及糖、脂代謝的重要脂肪因子。有研究[9]發現,血清PPARγ、SFRP5的表達水平與PCOS患者的發生發展有關。若能明確血清PPARγ及SFRP5與IR的關系,對PCOS患者臨床治療效果的提升有重要意義。
本研究結果顯示,IR組患者血清PPARγ、SFRP5水平低于非IR組(P<0.05),FPG、FIns、TC、TG、血清hs-CRP、IL-6、LH及T水平均高于非IR組(P<0.05),說明PCOS合并IR患者的PPARγ及SFRP5表達更低,雄激素分泌更多,糖、脂代謝紊亂情況更加嚴重,提示PPARγ、SFRP5可能與IR有關,且IR在促進性激素及糖、脂分泌,調節炎癥反應,加重卵巢功能障礙方面具有重要作用。基于IR的病理基礎,PCOS患者出現不同代謝指標水平差異的原因包括:(1)IR患者出現高胰島素血癥,過多的胰島素作用于卵巢顆粒細胞,激活細胞內17α羥化酶,促進雄烯二酮的合成,造成高雄激素血癥,再通過下調肝臟性激素結合球蛋白水平,致使血清T水平升高,加重患者性激素的紊亂,卵巢功能障礙進一步加重[10];(2)IR患者血液中的葡萄糖進入細胞的通路受阻,影響脂肪的合成代謝,使糖、脂肪代謝紊亂[11];(3)PCOS患者長期處于慢性炎癥狀態,有研究[12]表明,IR與炎癥反應關系密切,患者發生性激素紊亂、胰島素抵抗,可促進脂多糖介導卵巢組織炎癥因子大量釋放,同時通過反饋調節系統加重高胰島素血癥,最終引起IR的升高。
本研究進一步分析了PPARγ、SFRP5與IR及其他指標的關系,結果顯示,血清PPARγ及SFRP5診斷PCOS患者合并IR的效能均較高,而二者聯合診斷PCOS患者合并IR的效能最高,AUC達0.809,且PPARγ表達與SFRP5成正相關(P<0.05),與HOMA-IR、hs-CRP、IL-6、LH、T、FPG、FIns、TG水平呈負相關(P<0.05),SFRP5與HOMA-IR、hs-CRP、IL-6、FPG、FIns、TC、TG水平呈負相關(P<0.05),提示PPARγ與SFRP5可作為診斷PCOS患者是否伴發IR的輔助檢查手段,也說明PPARγ與SFRP5通過調控機體細胞因子及代謝物水平,參與IR的發生發展過程,原因可能為PPARγ作為激素、內源性代謝物及外源性化合物的傳感器,能夠調節與細胞分化,發育和代謝相關基因的表達,參與調控淋巴細胞分泌IL-6等炎癥因子,是脂肪細胞增殖、分化及胰島素信號轉導的重要調節因子,而SFRP5是PPARγ在脂肪細胞中轉錄調控的靶基因[13]。另外,PPARγ的正常表達可維持卵巢生理功能的穩定,其與顆粒細胞中雌激素應答元件相結合,可抑制芳香化酶表達,限制雄激素到雌激素的轉換,并調節LH的分泌,刺激T釋放[14]。王超等[15]對IR小鼠模型采用氧化苦參堿后發現,氧化苦參堿通過上調PPARγ水平來改善肝臟脂質代謝及胰島素紊亂。SFRP5內富含半胱氨酸,該氨基酸也大量存在于配體蛋白質Wnt受體中SFRP5可充當Wnt受體與配體結合,負向調控分泌蛋白的Wnt信號通路,阻斷炎癥因子釋放信號的傳導,從而降低炎癥因子水平,減輕炎癥反應[16]。國外研究[17]表明,血清SFRP5參與肝臟的糖異生過程,其高表達狀態可抑制糖異生,通過激活胰島素AKT、相關信號通路,提高細胞組織對胰島素的敏感性,從而改善患者IR情況。
綜上所述,PCOS患者合并IR患者血清PPARγ及SFRP5呈低表達,PPARγ與SFRP5通過調節炎癥反應、卵巢功能及糖脂代謝,改善患者IR,二者均可作為診斷PCOS患者是否伴發IR的輔助檢查手段。

