乳腺癌超聲征象及其術后復發的危險因素分析
何小芳,周 敏,熊朝月,周海蘭,朱 峰
0 引 言
乳腺癌在女性惡性腫瘤中發病率最高,且多數患者死亡并非由原發腫瘤引起,而是因腫瘤復發或遠處轉移所致[1]。盡管手術干預在一定程度上避免癌細胞擴散,提高病癥的局部控制率,但仍有20%~30%患者術后會出現復發[2]。這主要與乳腺癌的病理組織惡性化程度發展有關。組織病理學改變是影像學征像表現的基礎[3-4],超聲檢查作為乳腺病理診斷最常用的方法,在乳腺癌診斷中有較高價值。然而,目前針對乳腺癌超聲征象分析都是基于與臨床病理、分子表達等相關研究[5-6];而關于乳腺癌術后復發的危險因素分析更多是基于血液指標、術后輔助治療的相關報道[7-8],缺乏對乳腺癌超聲特征指標的分析。因而本研究通過分析乳腺癌患者超聲征象特點,并找出其與患者術后復發相關的危險因素,為乳腺癌術后復發評估提供參考。
1 資料與方法
1.1 一般資料回顧性分析2018年1月至2019年6月在我院接受根治性手術治療的乳腺癌患者174例(共188個乳腺原發病灶)的臨床資料,均為女性,年齡29~64歲,平均(50.78±6.95)歲。納入標準:①符合《乳腺癌診療指南與規范》[9]中診斷標準,且經病理確診為原發性乳腺癌,臨床分期為Ⅰ~Ⅱ期;②具有完整的術前超聲檢查結果;③術后復查和輔助治療均在我院進行;④患者均簽署知情同意書。排除標準:①除初次確診乳腺癌外,既往有癌癥病史;②肝腎功能異常;③伴有腦、心、肺等系統疾病;④合并高血壓、糖尿病、高血脂癥;⑤超聲檢查前有活檢、新輔助化療、胸部外傷史、內分泌治療;⑥無乳腺腫塊型的乳腺癌患者;⑦術后未按醫囑進行輔助治療者。本研究經醫院倫理委員會批準(批準號:SZJY-20210957)。
1.2 方法
1.2.1 超聲檢查所有患者均在術前接受超聲檢查,取仰臥位,充分暴露乳房及腋窩檢測區域。采用東芝阿波羅500型超聲診斷儀診斷,L12-5高頻線陣探頭,頻率6~13 MHz。按照自外上象限至內上象限的順序進行全面掃查,記錄腫塊數目、腫瘤大小、邊緣、形態、縱橫比、內部回聲、后方回聲、鈣化、血流分級等狀況。
1.2.2 隨訪與分組根據對患者術后為期2年隨訪,統計其術后復發情況。隨訪以門診復查形式進行,患者出院半年內每3個月來院復查1次,半年后每6個月來院復查1次,隨訪截止時間2021年8月,隨訪終止以隨訪期發現復發或到隨訪截止時間。復發定義:患者術后隨訪期內出現的任何局部或區域的復發,包括同側乳腺、胸壁、皮膚、手術瘢痕處、內乳淋巴結、腋窩淋巴結、鎖骨上下淋巴結。將隨訪出現復發者納入復發組,未出現復發者納入非復發組。
1.3 統計學分析使用SPSS 19.0軟件分析,計數資料以n(%)表示,組間比較用χ2檢驗;運用多因素logistic回歸分析探索乳腺癌超聲征象在其術后復發的危險因素。以P≤0.05為差異有統計學意義。
2 結 果
2.1 乳腺癌超聲征象及其術后復發的單因素分析174例(共188個乳腺原發病灶)患者術后隨訪中,6例失訪共7個乳腺原發性癌灶,50例復發共54個乳腺原發性癌灶(復發組),占比29.83%(54/181),118例未復發共127個乳腺原發病灶(非復發組)。以腫塊為單位,復發組與非復發組在腫瘤最大直徑、邊緣、縱橫比、鈣化、Alder血流分級方面的比較,差異有統計學意義(P<0.05),其余指標差異無統計學意義(P>0.05),見表1。

表1 乳腺癌超聲征象及其術后復發的單因素分析[n(%)]
2.2 乳腺癌術后復發超聲征像的多因素logistic回歸分析以患者術后是否出現復發(是=1,否=0)作為因變量,將表1單因素分析中差異具有統計學意義的特征作為自變量,相關賦值:腫瘤最大直徑(0=<3 cm;1=≥3 cm)、邊緣(0=清晰;1=模糊)、縱橫比(0=≤1;1=>1)、鈣化(0=無;1=有)、Alder血流Ⅱ~Ⅲ級(0=0~Ⅰ級;1=Ⅱ~Ⅲ級)。經多因素logistic回歸分析顯示:腫瘤直徑≥3 cm、邊緣模糊、縱橫比>1、鈣化、Alder血流Ⅱ~Ⅲ級均是乳腺癌術后復發的危險因素(P<0.05),見表2。
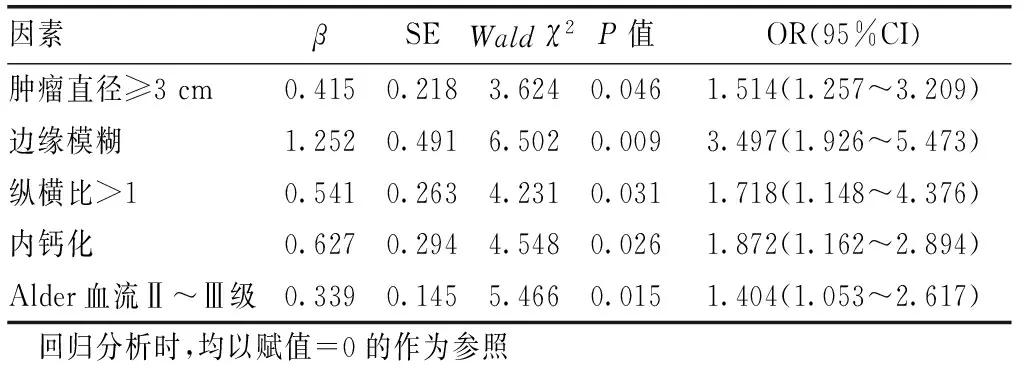
表2 乳腺癌術后復發超聲征像的多因素logistic回歸分析結果
3 討 論
盡管中國乳腺癌的發病率低于歐美地區,但中國年輕乳腺癌患者占比遠高于歐美地區。而相較于非年輕乳腺癌患者,年輕乳腺癌患者的術后復發率更高[10]。乳腺癌術后復發與其預后是密切相關的,一旦復發,將極大影響患者后期治療、生活質量。面對國內年輕乳腺癌占比高和其術后復發帶來的危害,有必要探究其術后復發的相關因素。大量研究表明,乳腺癌術后復發與其病理惡性化程度發展密切相關[11-12]。基于乳腺組織學改變是對超聲圖像表現的影響。分析乳腺癌超聲征像與其術后復發關系,有助于早期采取有效的針對性措施來防止或降低乳腺癌術后復發的風險性。
本研究分析乳腺癌患者術前的超聲檢查資料,結果發現腫瘤直徑≥3 cm、邊緣模糊、縱橫比>1、鈣化、Alder血流Ⅱ~Ⅲ級均是乳腺癌術后復發的危險因素。究其原因:①腫瘤直徑越大越容易出現微血管侵犯[13],會增加術后復發風險。另外腫瘤直徑大小與患者就診時間早晚密切相關,當超聲檢查發現的乳腺腫物直徑較大時,往往表明癌灶生長可能已有較長時間,其侵襲能力強,增殖速度快,生長較活躍,因此累積范圍較廣,易導致手術無法徹底切除癌灶,從而增加術后復發風險。②腫物邊緣模糊不清或出現毛刺樣癥狀,主要是系癌細胞浸潤周圍正常組織所致,其表現越明顯,則說明癌細胞浸潤性越強。腫物邊緣模糊,會增加手術切除癌灶的難度系數,易發生切除不徹底,而遺留癌組織細胞可快速沿乳腺正常組織的淋巴管網,經毛細血管順行或逆行不斷擴散、增值,進而增加患者術后復發的可能性。③腫瘤生長方式在一定程度上可反映其惡性程度[14]。有研究發現,乳腺癌組織生長方向的縱橫比<1與孕激素受體(PR)、雌激素受體(ER)陽性表達率有關[15]。而PR、ER在高分化乳腺癌細胞中多表達為陽性[16-17],其侵襲性和惡性程度相對較低。由此可推測乳腺癌組織生長方向縱橫比>1,其惡性化程度會更大,術后復發風險更高。既往研究表明,縱橫比>1屬特異性較高的原發癌典型惡性征象[18]。這與本研究結果發現縱橫比>1為乳腺癌術后復發的危險因素相符。④癌細胞的快速增長導致局部性血液供不應求,使癌細胞局部微環境酸堿失衡而引起乳腺導管中鈣鹽沉積[19-20],形成鈣化。國外學者對選擇保乳術治療的乳腺癌患者隨訪發現,伴有鈣化的乳腺癌局部或區域復發率顯著高于無鈣化[21],與本研究結果相符。乳腺腫物鈣化形成與局部癌細胞的快速增長能力密切相關,尤其細小分支狀鈣化呈現長狀沿著乳腺導管沉積,容易廣泛導管內夾層癌成分,導致手術無法徹底清除,續而增加術后復發風險。⑤關于乳腺癌超聲檢查,常見以血流豐富且血管多迂曲不規則且呈網絡狀結構[22]。當癌細胞侵入血管后便可促進癌栓形成,促使靜脈回流不暢,阻力增高。乳腺腫塊的惡性程度與血流分級呈正相關早已被證實[23]。以Alder血流Ⅱ、Ⅲ級為主,多數為高速、高阻血流,可能是因癌組織能釋放血管生長因子,使腫瘤組織生成新生的毛細血管,導致滋養血管增多,血流速度加快,這也使得癌細胞能夠快速經毛細血管擴散,增加術后復發風險。
綜述所述,腫瘤直徑≥3 cm、邊緣模糊、縱橫比>1、鈣化、Alder血流Ⅱ~Ⅲ級的超聲征像均是乳腺癌患者術后復發的危險因素。臨床針對乳腺癌超聲檢查中存在以上特征的患者,應考慮可能存在術后局部復發風險性,采取針對性預防措施降低患者術后復發風險。由于本研究樣本有限,且僅觀察乳腺癌的常規超聲特征,未涉及彈性成像等指標,結果難免存在偏倚,將在今后進行擴大樣本和進一步完善乳腺癌超聲征像與患者預后的關系研究。

