穩定表達CDC50A的卵巢癌細胞株的建立及鑒定
韓甜甜,尹 婕,曾 靖,金 瀅,李 艷,潘凌亞
(中國醫學科學院 北京協和醫學院 北京協和醫院 婦產科 國家婦產疾病臨床研究中心, 北京 100730)
卵巢癌是女性生殖系統惡性腫瘤中病死率最高的疾病[1]。盡管近幾年生物信息學、分子基因學等各領域研究飛速進展,由此衍生了新型分子生物制劑,但是患者的復發率、生存率無明顯改善[2]。這主要由于卵巢癌的異質性使得其在基因組學上表型復雜,難以統一其病因及發病機制之故[3]。
膜蛋白間的交聯黏附、細胞膜轉運體在胞外微環境、胞內調控等生物過程與腫瘤的發生發展、轉移耐藥具有一定的關聯性[4],一些有關膜蛋白轉運的研究已經在多種腫瘤包括前列腺癌、腎癌、乳腺癌等方面取得了進展[5]。本課題組驗證了側群細胞具有卵巢癌干細胞樣生物學特性,并通過蛋白組學初步篩選出側群細胞中顯著上調的膜蛋白CDC50A[6]。CDC50A是由1 361個氨基酸組成的二級跨膜蛋白,較短的N端和C端位于細胞質內,胞外為較大的環形結構[7]。它是維持細胞膜磷脂分子的正確折疊以及轉運至最終的亞細胞位置的重要蛋白[8-9]。有研究資料表明在卵巢癌中,P4型磷脂轉移酶(type Ⅳ-P-type phospholipid transferases,P4-ATPases)與CDC50A形成膜蛋白轉運體,導致順鉑耐藥[9-10],故CDC50A與卵巢癌存在著必然的相關性,可能是卵巢癌干細胞表面標記蛋白。本研究建立了穩定表達CDC50A的細胞株,為今后實驗奠定基礎。
1 材料與方法
1.1 材料
MEMα培養基、DMEM細胞培養基(Gibco公司);胎牛血清(Hyclone公司);人卵巢癌細胞系SKOV3(中國醫學科學院基礎醫學細胞中心);病毒包裝質粒pCMV-VSVG和pCMV-Δ8.9、健康人胚胎腎細胞HEK-293T、大腸桿菌菌株DH5α/TOP10、質粒pLVX-IRES-GFP(原清華大學癌癥與干細胞實驗室郭偉教授贈予);克隆載體(EZ-TTMCloning Vector)、T載體快速鏈接試劑盒(北京康潤誠業生物科技公司);EcoRⅠ、NotⅠ酶(MBI公司); PrimeSTAR HS DNA Polymerase、dNTPs(TaKaRa公司);T4DNA連接酶(Promega公司);DNA轉染介質(PolyJetTMSignaGen公司);病毒濃縮液(上海依科賽生物制品有限公司);Polybrene聚凝胺、CHAPS(翌圣生物公司);Immobilon-P膜(Merck公司);兔抗Flag-tag多克隆抗體(華興博創公司);ECL化學發光底物(Thermo公司);Alexa Fluor? 647 熒光素標記的兔抗人二抗、鼠抗β-actin單克隆抗體(Abcam公司);DAPI的熒光防淬滅封片劑(上海浩然生物公司)。
1.2 方法
1.2.1 細胞培養:HEK-293T細胞系以含10%胎牛血清的DMEM培養,SKOV3細胞系培養于含10%胎牛血清的MEMα培養基,置于37 ℃、5% CO2細胞孵箱中培養。
1.2.2CDC50A克隆及表達質粒的構建:根據HUGO基因命名委員會(HUGO Gene Nomenclature Committee,HGNC)發表的CDC50A(GENE ID:55754)轉錄變體1的序列設計引物(F:5′-GCGG AATTCGCCACCATGGCGATGAACTATAAC-3′;R:5′-GCCGCGGCCGCTTACTTATCGTCGTCATCCTTGTAA TCTCCTCCTCCAATGGTAATGTCAGCTG-3′),提取HEK-293T細胞總RNA,經反轉錄反應獲得cDNA,通過PCR擴增CDC50A全長,反應條件為95 ℃預變性5 min;92 ℃變性30 s,50 ℃退火45 s,75 ℃延伸45 s,35個循環后72℃延伸3 min。然后將產物經1.2%瓊脂糖凝膠電泳檢測,采用DNA回收試劑盒從凝膠中回收目的片段。
將回收的基因片段與克隆載體相連接形成重組質粒,通過酶切鑒定,利用通用引物(CMV-F、IRES-R)進行測序,經測序驗證的重組質粒與表達載體pLVX-IRES-GFP分別進行雙酶切,加入T4DNA連接酶進行連接,將連接產物轉化感受態大腸桿菌TOP10中,擴增后提取單克隆質粒,再次進行酶切鑒定,完成表達質粒pLVX-CDC50A-GFP的構建。
1.2.3 細胞轉染:將1 μg表達質粒pLVX-CDC50A-GFP、3 μL DNA轉染試劑與100 μL的DMEM培養液預混配置瞬時轉染復合體,然后輕柔加入含HEK-293T細胞的培養基中。同法配置并轉染空載質粒pLVX-IRES-GFP作為陰性對照組,未轉染質粒的細胞作為空白對照組。48 h后觀察轉染效率。
1.2.4 慢病毒包裝:以1∶1∶2的比例將病毒包裝質粒pCMV-VSVG、pCMV-Δ8.9分別與擬整合的質粒pLVX-CDC50A-GFP或其空白對照質粒pLVX-IRES-GFP混合在DMEM中,通過DNA轉染試劑形成復合物溶液,輕柔放入含HEK-293T細胞的培養基中,60 h后經低溫離心收集病毒液。最后通過病毒濃縮液處理、PBS重懸后得到病毒原液。
測算病毒滴度:預先在6孔板中培養HEK-293T細胞,稀釋病毒原液至10倍,利用Polybrene聚凝胺將慢病毒感染至細胞中。72 h后收集細胞,用流式細胞儀分析陽性細胞比例,計算病毒滴度(TU/mL)=細胞數目×感染細胞陽性率×稀釋比例。
1.2.5 穩定表達細胞株的建立:將重組表達載體pLVX-CDC50A-GFP、空載體pLVX-IRES-GFP的病毒原液分別與MEMα培養液、Polybrene聚凝胺混勻配制感染復合體,分別均勻放入SKOV3細胞系培養基中。待病毒感染72 h后,在熒光顯微鏡下,觀察綠色熒光激發比例。用胰蛋白酶消化細胞,經流式細胞儀分選帶有綠色免疫熒光的陽性細胞后,對穩定轉染病毒的SKOV3細胞株進行培養擴增。
1.2.6 免疫印跡:用CHAPS裂解膜蛋白,經低溫離心收集上清液,BCA法定量,用金屬浴將蛋白質變性。將蛋白質樣品在標準條件下通過SDS-PAGE分離,電轉移到Immobilon-P膜。以鼠抗人單克隆actin抗體(1∶5 000)加入抗體緩沖液(PBS含0.01% Tween20和0.1% BSA)作為內參,檢測樣品中兔抗Flag-tag多克隆抗體(1∶5 000),使用ECL化學發光底物檢測信號。
1.2.7 免疫熒光:預先將SKOV3細胞株鋪在盛有蓋玻片的6孔板上。用4%多聚甲醛固定,0.3% Triton X-100溶液滲透細胞,5%羊血清PBS封閉以阻斷抗體的非特異性結合。用兔抗Flag-tag多克隆抗體(1∶200)在4 ℃條件下孵育,最后用Alexa Fluor?647 熒光素標記的兔抗人二抗(1∶500)標記一抗。標記完成后,去除二抗,用熒光防淬滅封片劑封片。使用Zeiss LSM880超高分辨倒置共聚焦顯微鏡獲取圖像。
1.2.8 流式細胞學檢測:用含有1%胎牛血清的PBS制備單細胞懸液,細胞計數,調整細胞濃度為1×106/100 μL。以未轉染質粒的細胞作為陰性對照組。以最大吸光波長488 nm、最大反射波長525 nm檢測綠色熒光細胞。
2 結果
2.1 鑒定表達質粒pLVX-CDC50A-GFP
克隆表達質粒經EcoRⅠ、NotⅠ雙酶切后,可見與預期條帶大小相符的單一條帶(圖1)。
2.2 pLVX-CDC50A-GFP質粒的蛋白表達
空載體對照組轉染率為78.9%,重組CDC50A表達質粒的轉染效率為50.8%(圖2)。免疫印跡結果顯示重組質粒可測得標簽蛋白的表達,而空白對照組、陰性對照組則無表達(圖3)。
2.3 穩定表達CDC50A的SKOV3細胞株檢測及表達鑒定
利用流式細胞技術檢測綠色熒光細胞比例,空載體組為94.9%,CDC50A穩定表達組為86.5%(圖4)。通過免疫印跡技術定量檢測到在50 ku處單一條帶,而空白對照組中無條帶顯示。進一步通過免疫熒光技術分析可見CDC50A主要分布定位于細胞膜(圖5)。
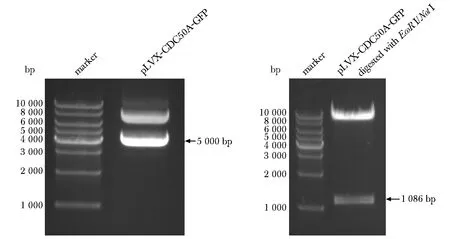
圖1 pLVX-CDC50A-GFP表達質粒及酶切鑒定Fig 1 Expression and identification of pLVX-CDC50A-GFP plasmid
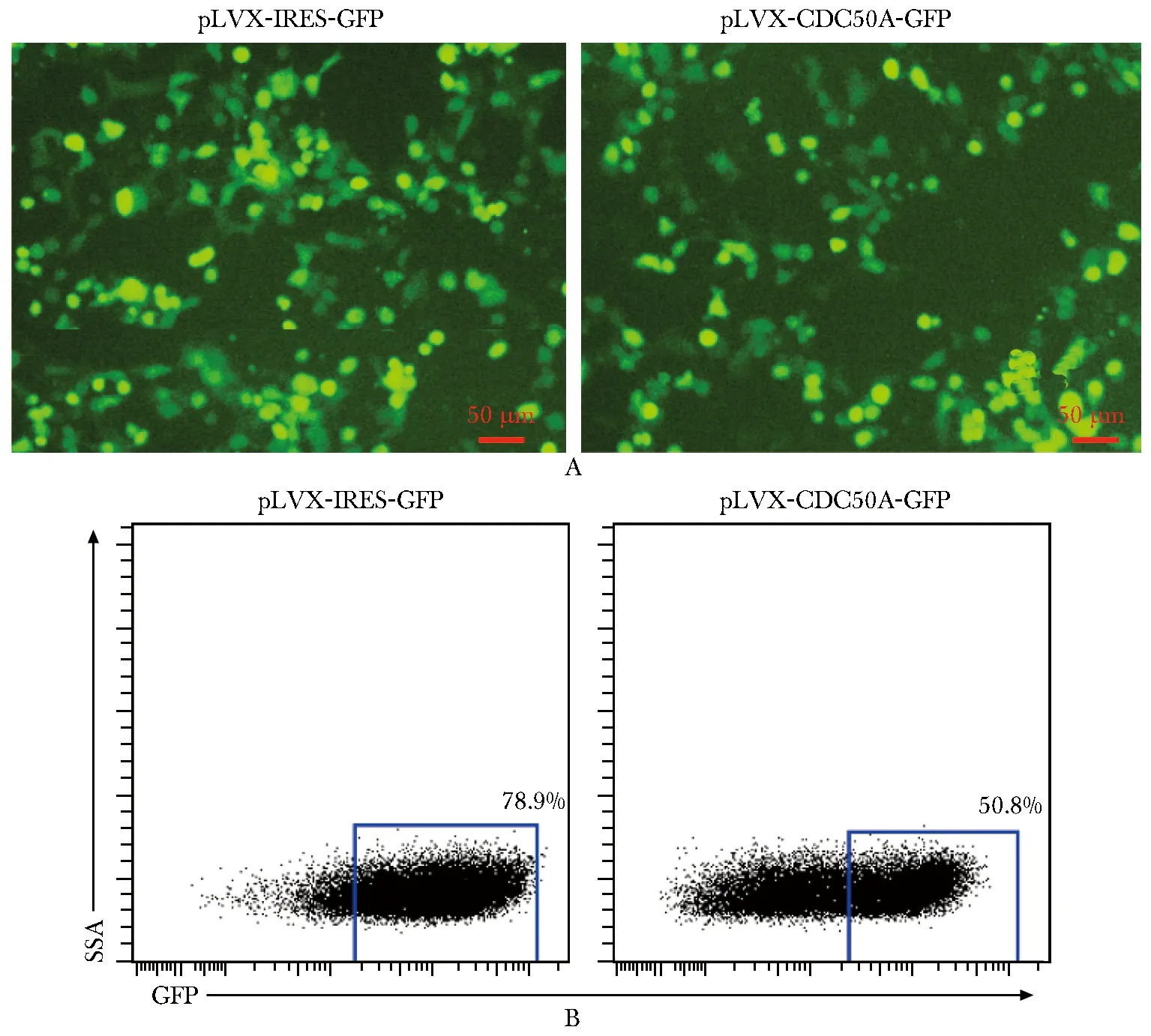
A.fluorescence microscopy(scale bar=50 μm); B.flow cytometry scatter plot圖2 顯微鏡及流式細胞測量術檢測表達質粒對HEK-293T細胞瞬時轉染率Fig 2 Transient transfection rate of HEK-293T cells detected by microscopy and flow cytometry
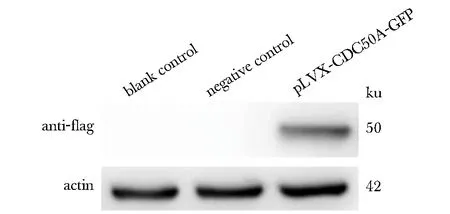
圖3 pLVX-CDC50A-GFP質粒中Flag標簽蛋白特異性表達Fig 3 Specific expression of Flag-tag proteins of pLVX- CDC50A-GFP
3 討論
CDC50A蛋白的跨膜結構具有疏水性,可溶性差,這對克隆后定性移位至細胞靶結構產生了負面影響[11]。故完成克隆并通過表達載體實現CDC50A在細胞膜上高表達是后續功能實驗的基礎。本文通過分子克隆技術獲取了CDC50A表達載體,并成功構建了穩定表達的SKOV3細胞株,經過定性、定量、定位檢測,證實獲得的CDC50A蛋白表達穩定、特異。因此,此細胞株可作為研究CDC50A在SKOV3中作用的重要工具,為深入研究其與卵巢癌的相關性提供重要手段。
近年來,日本Tanaka實驗室進行了一系列關于CDC50家族參與磷脂內翻酶的功能研究,發現在正常細胞中,CDC50家族蛋白定位在反面高爾基體上,發揮胞吞轉運作用,當高爾基體膜泡生成障礙,囊泡堆積在反面高爾基上,功能蛋白轉運障礙,導致質膜部分磷脂酰絲氨酸外翻,影響脂質雙分子層的流動性,最終導致細胞出芽生殖受阻[12]。除了維持生理上的轉運功能,研究還發現在多種腫瘤細胞系中,CDC50A的表達下調,使得胞質-胞膜轉運體形成受阻,從而抑制了細胞對哌立福新的攝取[13]。目前尚無CDC50A在卵巢癌中作用的研究報道。有研究表明CDC50家族蛋白在維持細胞膜穩定性、參與胞吞胞吐等物質轉運、完成信號交換等方面起到重要的生物學作用[9-10]。本研究發現SKOV3過表達CDC50A后,CDC50A蛋白集中分布在細胞膜上,進一步說明該膜蛋白亞細胞結構的分布靶向性,可能會影響細胞交聯、胞內轉運等重要的信號傳導途徑。因此,后續將在過表達CDC50A的SKOV3細胞株中,深入研究其發生發展及耐藥作用。
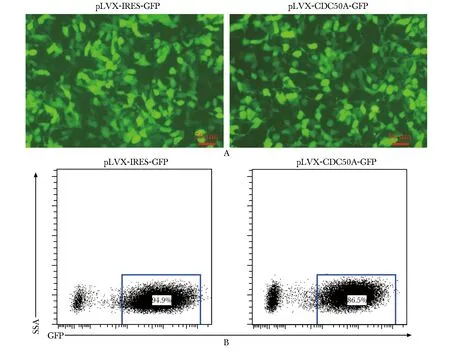
A.fluorescence microscopy(scale bar=50 μm); B.flow cytometry scatter plot圖4 SKOV3細胞株慢病毒載體感染率Fig 4 Infection efficiency of SKOV3 cell strain with lentiviral vector
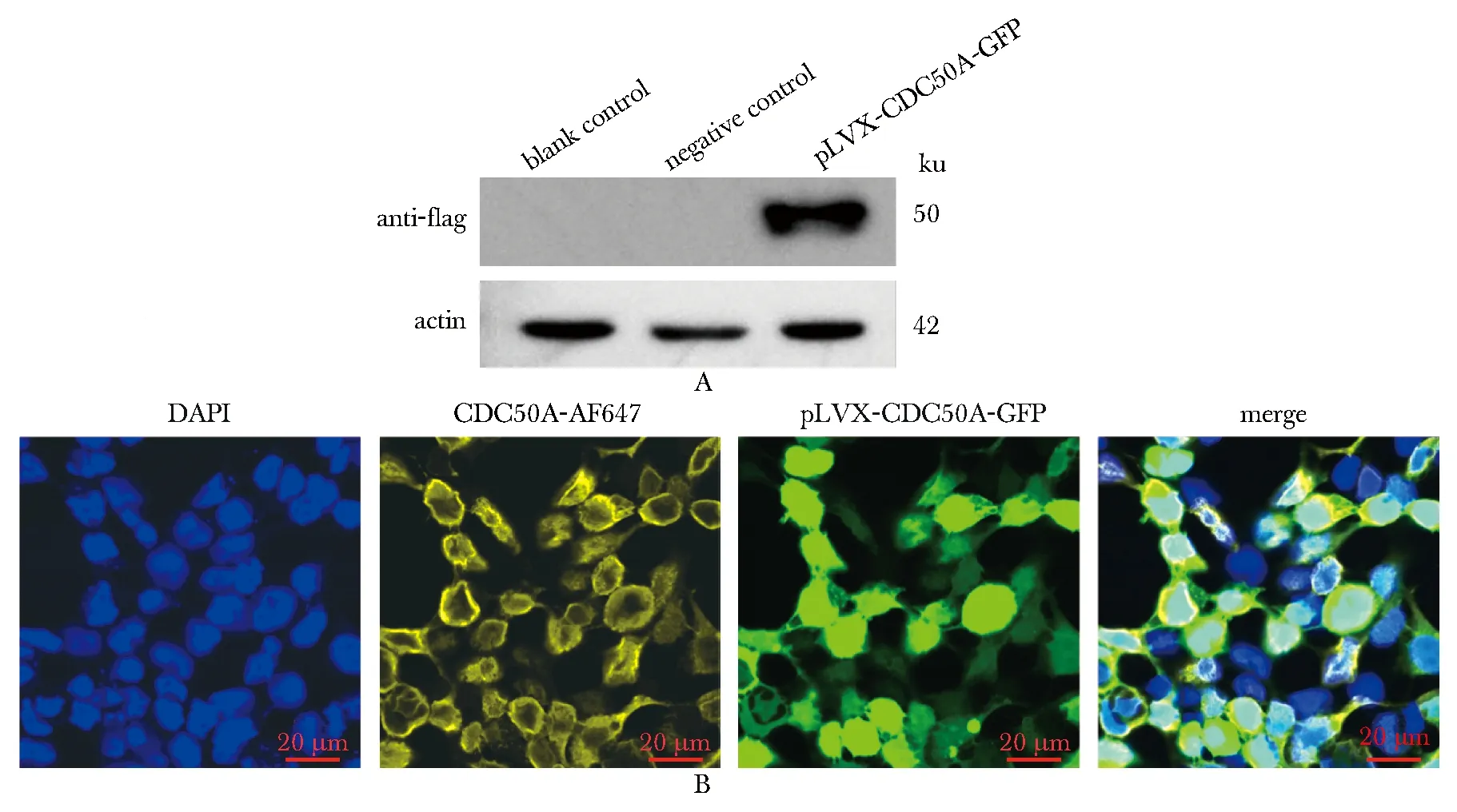
A.the single band in pLVX-CDC50A-GFP group compared with no finding in blank and negative groups by Western blot; B.blue nucleus, yellow cytomembrane located by immunofluorescence(scale bar=20 μm)
本實驗主要局限性在于僅建立了一個細胞株,但作為前期實驗,本實驗完成了分子克隆及慢病毒包裝,并證明其可在多種卵巢癌細胞系完成病毒載體感染,在原代細胞中完成懸浮感染。

