絞股藍皂苷減輕脂多糖誘導大鼠腎上腺嗜鉻細胞瘤細胞系PC12損傷
姜秀芳,耿亞楠,陽盛洪,魏 平,趙 名*,朱玲玲*
(1.軍事科學院軍事醫學研究院 軍事認知與腦科學研究所, 北京 100850; 2.中國人民解放軍陸軍第957醫院,西藏自治區 阿里地區 859000)
炎性反應是多種生理和病理過程的基礎,是生物體對各種有害刺激(如有害刺激物、受損細胞和病原體等)的防御機制。通常,由于炎性反應具有從原始刺激和炎性反應中消除受損組織或壞死細胞的功能,因此認為炎性反應對于自我愈合和修復具有積極的意義。然而,過度或不受控制的炎性反應對生物體是有害的,并可能引發炎性疾病[1]。對于腦這一特殊器官來說,炎性反應被廣泛認為是神經功能退化的主要原因[2]。動物模型和遺傳學研究結果表明,神經退行性疾病發生發展過程中通常伴有神經組織的免疫信號失調、炎性分泌因子水平改變以及神經膠質細胞的異常活化[3]。因此,減輕或抑制炎性反應是防治多種腦疾病的重要策略。
絞股藍皂苷(gypenoside, GP)是中藥絞股藍的主要藥理活性成分。細胞和動物實驗結果表明,絞股藍皂苷具有多種生理活性,包括免疫調節、抗缺血、降血脂、抗氧化等[4-5]。以往研究報道發現絞股藍皂苷可通過抗感染活性而表現出抗焦慮或抗抑郁樣的效應[6-7]。但絞股藍皂苷對神經元炎性損傷的影響及分子機制尚不清楚。本文以LPS誘導PC12細胞建立神經元炎性損傷模型,研究絞股藍皂苷對神經元炎性損傷的影響及分子機制,研究結果將為其用于防治神經炎性反應疾病提供實驗依據。
1 材料與方法
1.1 材料與試劑
絞股藍皂苷(中國科學院蘭州化學物理研究所楊軍麗實驗室制備,純度≥98%)。將絞股藍皂苷溶解于無菌水中,配成30 mg/mL的溶液備用。RPMI1640(Gibco);胎牛血清(Ausbian);LPS(Sigma-Aldrich公司);CCK-8試劑盒(日本同仁化學研究所);Trizol(Thermo-Fisher公司)。反轉錄試劑盒HiScript?Ⅲ RT SuperMix for q-PCR和實時定量PCR反應預混液ChamQTM SYBR?q-PCR Master Mix(南京諾唯贊生物科技股份有限公司)。蛋白裂解液Laemmli Sample Buffer(Bio-Rad公司),BCA蛋白定量試劑盒(北京普利萊基因技術有限公司)。p-p65、t-p65一抗以及抗鼠或兔二抗(Cell Signaling Technology公司);β-actin一抗(Sigma-Aldrich公司);PC12細胞(中國醫學科學院基礎醫學研究所細胞資源中心)。
1.2 方法
1.2.1細胞的培養及分組處理:將PC12細胞培養于含10%胎牛血清的RPMI1640完全培養液中,在5% CO2培養箱中飽和濕度條件下37 ℃常規培養,每2~3天傳代或換液1次。將PC12細胞分為對照組、LPS處理組、不同劑量(30、100 μg/mL)絞股藍皂苷干預組和絞股藍皂苷干預聯合LPS處理組。
1.2.2 CCK8法測定細胞活力:將處于對數增殖期的PC12細胞用胰蛋白酶消化計數,以5 000個/孔接種于96孔板中,經各實驗組處理完畢后,每孔各加入10 μL的CCK-8溶液,輕輕晃動搖勻,將培養板放入培養箱中繼續孵育1 h,然后用酶標儀測定450 nm的吸光值(A)。以對照組細胞的細胞活力為100%,計算各實驗組的細胞活力。
1.2.3 實時定量PCR檢測炎性因子mRNA的表達水平:收集各組細胞樣品,采用Trizol法提取總RNA,應用UV5nano紫外可見分光光度計進行定量,取1 μg總RNA采用HiScript?Ⅲ RT SuperMix for q-PCR試劑盒進行反轉錄反應,然后采用ChamQTM SYBR? q-PCR Master Mix預混液在C1000 Touch Thermal CyclerPCR儀上進行實時定量PCR反應。PCR程序參照試劑盒提供的兩步法進行:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,共40個循環。各組實驗獨立重復3次。以β-actin作為內參基因,用2-ΔΔCt法計算各處理組目的基因的相對表達量,將對照組的相對表達量設定為1,各處理組是相對于1的變化倍數。采用Primer3(Version4.1.0)在線設計各目的基因的上下游引物,如表1所示。

表1 引物序列Table 1 Primer sequence
1.2.4 Western blot檢測p-p65蛋白:收集各處理組細胞樣品,加入Laemmli Sample緩沖液充分裂解后煮沸變性10 min;然后4 ℃、12 000 r/min離心10 min,上清即全細胞裂解液。采用BCA法進行蛋白定量。各處理組取20 μg蛋白進行SDS-PAGE電泳。PVDF膜轉印后,將膜放在5%脫脂奶粉中室溫封閉1 h;TBST洗滌3次后,加入適當稀釋于5%脫脂奶粉中的一抗,并4 ℃孵育過夜。TBST洗滌3次,然后加入辣根過氧化物酶偶聯的二抗(1∶2 000稀釋)室溫孵育2 h,洗滌后在暗室中進行顯影定影。
1.3 統計學分析
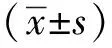
2 結果
2.1 不同劑量的LPS對PC12細胞炎性反應的影響
經不同劑量的LPS刺激后,TNF-α和IL-1β mRNA水平均顯著上調,IL-6的mRNA水平在300 ng/mL的LPS刺激下才發生明顯上調。因此,在后續的實驗中,300 ng/mL的 LPS被用于構建PC12細胞的神經炎性反應模型(圖1)。
2.2 絞股藍皂苷預處理減輕LPS刺激導致的PC12細胞活力下降
與對照組相比,LPS組的細胞活力下降到85.7%(P<0.01),絞股藍皂苷單獨處理對PC12細胞活力沒有影響,卻可以減輕LPS所導致的細胞活力下降(P<0.01)(圖2)。
2.3 絞股藍皂苷預處理減輕LPS誘導的PC12細胞炎性反應
LPS組的炎性細胞因子TNF-α、IL-1β和IL-6表達水平顯著高于空白對照組(P<0.01),絞股藍皂苷預處理后,TNF-α、IL-1β和IL-6表達水平均顯著低于LPS模型組(P<0.01)(圖3)。
2.4 絞股藍皂苷預處理對LPS誘導的PC12細胞內NF-κB信號通路的影響
LPS可導致p-p65的蛋白水平上調,但t-p65蛋白水平保持不變,提示NF-κB信號通路受到了活化,不同劑量的絞股藍皂苷預處理后,可以劑量依賴性的下調p-p65的蛋白水平(圖4)。

*P<0.01 compared with control圖1 不同劑量LPS刺激對PC12細胞中TNF-α、IL-1β、IL-6 mRNA水平的影響

*P<0.01 compared with control; #P<0.01 compared with LPS treatment alone圖2 CCK-8法檢測PC12細胞活力的變化Fig 2 Change of PC12 cell viability detected by CCK-8 assay n=4)
3 討論
LPS誘導的大鼠腎上腺髓質嗜鉻細胞瘤PC12細胞炎性反應模型被國內外多家實驗室用來研究神經元炎性損傷的研究。例如,基于該細胞模型評價了新型環氧合酶2抑制劑對神經炎性反應的抑制作用[8]。利用該模型評價了天然產物樟芝多糖對神經細胞炎性反應的調節作用[9]。在本實驗體系中,LPS也同樣可以對PC12細胞造成細胞活力下降、炎性因子上調等損傷性反應,進一步證明該細胞模型的穩定性和可重復性,為進一步研究絞股藍皂苷預處理對神經元炎性損傷的影響奠定了良好基礎。

*P<0.01 compared with control; #P<0.01 compared with LPS treatment alone圖3 GP預處理對PC12細胞中炎性因子TNF-α、IL-1β和IL-6 mRNA水平的影響

*P<0.05 compared with control; #P<0.05 compared with LPS treatment alone圖4 絞股藍皂苷預處理對LPS誘導的PC12細胞內NF-κB信號通路的影響Fig 4 Effect of GP on the activity of NF-κB signaling pathway in PC12 cells stimulated by LPS n=3)
LPS作為一種細菌內毒素可以激活許多與炎性反應發生相關的細胞,引起炎性因子的合成以及釋放,最終導致生物體全身炎性反應的發生。LPS首先與細胞膜表面的Toll樣受體-4(Toll-like receptor 4, TLR4)結合,然后激活胞質內IKK/NF-κB信號通路,進而調節多種細胞因子的表達[10]。在LPS誘導的大鼠炎性反應和記憶障礙模型中,絞股藍皂苷預處理能夠降低海馬中促炎因子的水平,該作用與其降低誘導型一氧化氮合酶(inducible nitric oxide synthase, iNOS)和 TLR4水平有關[11]。在本研究中,發現絞股藍皂苷能夠抑制PC12細胞內LPS所誘導的NF-κB信號通路,同時降低TNF-α、IL-1β和IL-6等炎性因子的mRNA水平,從而產生抗炎活性。
神經炎性反應是多種神經系統疾病的主要原因,例如腦外傷、缺血性中風和阿爾茨海默病。炎性小體誘導先天性免疫應答、建立腦內慢性炎性反應環境、引起神經元功能障礙并最終導致神經變性[12]。因此,新型抗炎藥物的研究成為當前有關神經退行性疾病的研究熱點。本研究證實了絞股藍皂苷預處理能夠拮抗LPS導致的PC12細胞炎性損傷,表現在一是LPS所導致的細胞活力下降得到了恢復,二是LPS誘導的TNF-α、IL-1β和IL-6等炎性細胞因子表達上升得到了抑制。此外,絞股藍皂苷對低氧性腦損傷具有保護作用[13]。以上研究結果表明絞股藍皂苷在神經系統疾病的防治中具有良好的應用前景。
志謝:感謝中國科學院蘭州化學物理研究所楊軍麗教授提供的絞股藍皂苷。

