CO2 加氫制乙醇反應機理及催化劑研究進展
張力婕,韓愛國
(1. 中國石化大連石油化工研究院,遼寧 大連 116045;2. 天津大學分子 + 研究院,天津 300072)
CO2利用對碳循環經濟的發展正產生著巨大影響,并在全世界引起廣泛關注[1-2]。實施CO2捕集、耦合“綠氫”催化加氫轉化制取高價值化學產品,對減少CO2排放和改善生態環境具有重要意義[3-4]。在CO2轉化反應中,以生成甲醇為主要產品的途徑近年來得到了深入研究[5-8];此外,也有研究者對CO2加氫直接轉化為烯烴、芳烴及N,N-二甲基甲酰胺(DMF)等高附加值產品進行了探索[9-13],但有關CO2加氫合成乙醇或高級醇的報道較少。乙醇用途廣泛,可以用作清潔燃料添加劑、溶劑和消毒劑等;同時,燃料乙醇作為一種重要的可再生清潔能源,運輸安全且與汽油的相容性更好[14],可作為液體化石燃料的替代品。使用含醇汽油不僅能夠減少石油的消耗量,而且污染物(包括SOx、NOx、CO、CHx及可吸入顆粒物)的排放量也遠低于普通汽油[15]。
與甲醇生產相比,C2+產品的合成面臨更大的挑戰[16-17],這是因為CO2是一種熱力學穩定的化學惰性分子,其轉化率較低,需要較高的反應溫度(> 200 °C)。其中CO2加氫制乙醇在熱力學上較困難,易生成CH4或CO,降低了乙醇的選擇性。為實現高選擇性CO2加氫制乙醇,研究者們從活性組分、前驅體、助劑及載體等方面開展研究,如通過助劑Na、K等影響CO和H2的活化來調控催化劑表面*CHx、*CO和*H的相對覆蓋度,進而調控*CHx—*CO偶聯和加氫反應[18]。本文重點分析CO2加氫制乙醇的反應機理;歸納總結活性組分、載體、金屬摻雜/負載和工藝參數等因素對催化劑性能的影響;并對未來的研究方向進行展望。
1 CO2 加氫制乙醇反應機理
1.1 反應熱力學與動力學分析
CO2是高度對稱的直線型分子,化學性質穩定,將CO2活化并轉化為乙醇十分困難,C=O鍵的有效斷裂和所需中間物種的選擇性生成具有挑戰性。如何提高現有催化劑體系的催化活性、穩定性和目標產物乙醇的選擇性,是實現大規模CO2加氫制乙醇工業化的關鍵。CO2催化加氫生成乙醇的反應式如式(1),在溫度為298 K時,其焓變熵變以及平衡常數Kp= 2.946 × 1011[19]。
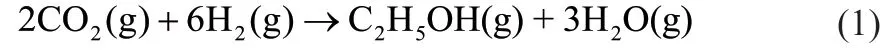
從熱力學角度看,CO2催化加氫生成乙醇反應的焓變為負值,即為放熱反應,且反應平衡常數Kp較大,產物較易生成,增大壓力和降低溫度有利于反應向生成乙醇的方向進行;從動力學角度看,反應溫度過低,難以有效活化CO2分子,導致反應速率較低,因此為兼顧反應速率和CO2的活化,選擇適宜的溫度有助于得到較好的乙醇收率[20]。除了研發合適的催化劑外,工藝參數對CO2加氫產物分布和轉化率也有很大影響。研究表明[21],產物分布和轉化率可以通過改變原料氣組成和壓力等工藝參數來調節。不同類型的反應器以及工藝參數(反應溫度、反應壓力、原料氣H2與CO2的比例以及空速等)對產物分布的影響如圖1 所示。
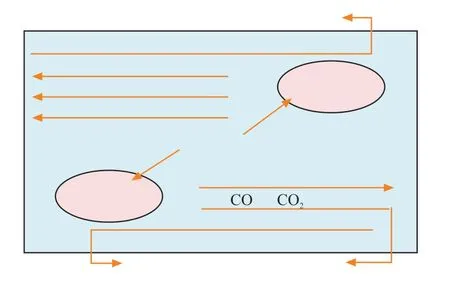
圖1 不同類型反應器中工藝參數對產物分布的影響[21]Fig. 1 Influence of process parameters in different types ofreactor on the product distribution[21]
1.2 反應機理
反應機理是確定反應過程中可能形成的中間體的關鍵。由于原位測試技術手段有限,且CO2加氫生成的產物具有多樣性,反應機理十分復雜[22-24],不同類型的催化劑催化CO2加氫合成乙醇的反應機理和反應路徑迄今仍沒有統一和明確的解釋。有研究者通過在不同條件下的實驗研究或采用原位漫反射傅里葉變換紅外光譜(DRIFTS)、傅里葉變換紅外光譜(FTIR)和離散傅里葉變換(DFT)等表征技術,提出了合理的反應機理。目前被廣泛接受的反應機理主要有兩種:一是CO2經逆水氣變換反應(RWGS)生成CO,部分CO氫化生成*CH3,CO嵌入*CH3中完成碳鏈增長,進一步加氫生成乙醇[25]。該過程中催化劑的作用是至關重要的,CO和催化劑上的活性物種之間的結合力需要足夠強,以避免CO進一步解離成*C和*O。二是通過CO2分子的吸附和活化形成羧酸中間體,進一步還原產生甲酸中間物種*HCOO,*CHx與*HCOO鍵合形成的表面中間體(*CH3COO)進一步氫化形成乙醇[26]。
AN等[27]基于表征和實驗結果,提出了CO2加氫制乙醇的可能機理,如圖2 所示。首先,CO2在La4Ga2O9表面被吸附和活化,然后經過RWGS反應轉化為CO中間體,CO隨后遷移到Co0—Co2+活性位點上,部分CO解離生成*CHx基團,*CO嵌入*CHx完成碳鏈增長,最后加氫生成乙醇。
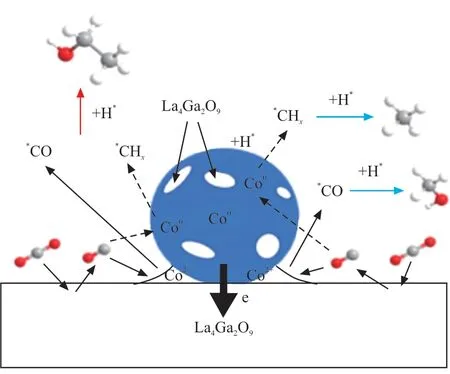
圖2 Co/La4Ga2O9 催化劑上CO2 加氫反應機理[27]Fig. 2 Reaction mechanism of CO2 hydrogenation over Co/La4Ga2O9 catalyst[27]
BAI等[28]的機理研究表明,CO2加氫反應生成乙醇過程經歷了CO2吸附/活化、甲酸鹽中間體的形成、中間體(甲酸鹽、*CO、*CH3和*CO插入形成*CH3CO)的轉化或加氫,最后加氫生成乙醇;并推測*CO加氫生成*HCO是CO2加氫生成乙醇的速率控制步驟。DING等[29]通過同位素標記法、密度泛函計算和平板模型計算探究了高性能催化劑Cu@Na-Beta催化CO2加氫合成乙醇的反應機理。其認為CO2首先在銅納米粒子表面氫化成*CH3,隨后吸附的*CO2與*CH3反應形成重要的表面中間體*CH3COO,然后*CH3COO氫化形成乙醇。此外,WANG等[30]發現在鈷催化劑中加入鎳物種可以促進CO2加氫形成相對穩定的*CHx中間體,從而避免了甲烷化的發生,*CHx隨后插入到*HCOO中形成乙醇,如圖3 所示。LOU等[31]的機理研究也表明,該轉化經歷了CO2吸附和活化、甲酸鹽中間體的形成、乙酸鹽的插入以及加氫生成乙醇的過程。
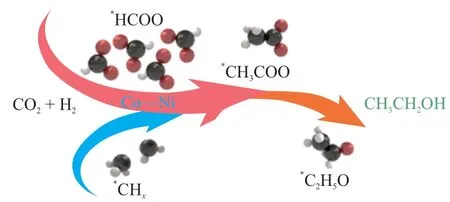
圖3 *CHx插入*HCOO形成乙醇的機理[30]Fig. 3 Mechanism of ethanol formation by *CHx insertion to*HCOO[30]
2 CO2 加氫制乙醇催化劑研究進展
與均相催化劑相比,多相催化劑在反應后易于分離和回收且具有較好的可再生性,因此被廣泛應用于CO2加氫制乙醇中。近年來,文獻中報道的關于CO2加氫制乙醇的研究大多在實驗室規模的反應器上進行。反應器主要包括間歇反應器和連續反應器;而催化劑種類較多,其性能與活性組分、載體等密切相關。
2.1 活性組分對催化劑性能的影響
2.1.1 Rh基催化劑
負載型貴金屬催化劑因其在C—C偶聯方面的卓越能力于CO2加氫反應中備受關注。在連續反應器中,YANG等[32]探究了負載在TiO2納米棒上的Rh基催化劑中羥基的關鍵作用。結果表明,RhFeLi/TiO2納米棒催化劑在催化CO2加氫反應中乙醇選擇性為32%,促進作用歸因于TiO2納米棒上高分散性的Rh和高密度的羥基之間的協同作用。羥基可以穩定甲酸根并質子化甲醇,使甲醇很容易分解為*CHx,然后CO(RWGS反應生成)插入*CHx中形成*CH3CO,*CH3CO再加氫生成乙醇,如圖4 所示。
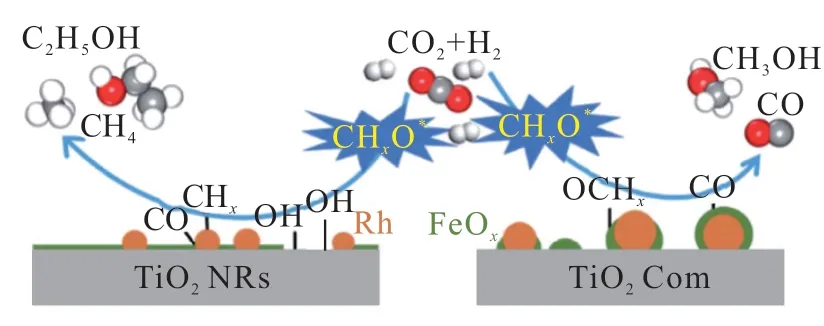
圖4 負載于TiO2 納米棒上的Rh基催化劑CO2 加氫機理[32]Fig. 4 CO2 hydrogenation mechanism of Rh-based catalyst supported on TiO2 nanorods[32]
此外,QIAN等[33]發現Ru3(CO)12/Rh2(CO)4Cl2-LiI催化劑可以在溫和條件下有效地催化1,3-二甲基-2-咪唑烷酮(DMI)中的CO2加氫反應生成甲醇、乙醇和丙醇等。LiI作為助劑,由于鋰離子更強的路易斯酸性,在催化反應過程中提供了合適的配位位點,因而促進了C2+醇的合成,在最優條件下,C2+醇的選擇性可高達96.4%,并且該催化劑較易回收。
2.1.2 Au基催化劑
負載型Au納米粒子(Au NPs)或金納米團簇(Au NCs)作為一種多功能催化劑具有較高的活性和選擇性,可用于CO2加氫反應。在間歇反應器中,WANG等[34]合成了一種高效TiO2負載的Au NCs催化劑,溫和條件下,在DMF溶劑中將CO2和H2直接合成乙醇。Au NCs與TiO2載體之間獨特的協同效應,特別是具有豐富氧空位的銳鈦礦晶相TiO2,促進了所設計催化劑的成功應用。結果表明,Au/a-TiO2(a表示銳鈦礦)催化劑表現出較高的活性和對乙醇的高選擇性,乙醇產率為942.8 mmol/(g·h)(單位時間單位質量催化劑(以Au計)上生成乙醇的物質的量),乙醇的選擇性> 99%;并表現出優異的穩定性。
2.1.3 Pt基催化劑
Pt合金能夠活化CO2,因此Pt基催化劑可用于CO2加氫合成乙醇。在連續反應器中,OUYANG等[35]將Pt納米顆粒負載在兩種不同形態的Co3O4(納米棒和納米片)上制備Pt/Co3O4催化劑。該催化劑在50 h反應時間內具有穩定且相對較高的CO2轉化率和醇選擇性,在t= 200 °C和p= 2 MPa條件下C2+醇產率為0.56 mmol/(g·h)。HE等[36]研究了水對CO2加氫生成高級(C2~C4)醇的影響,水和催化劑Pt/Co3O4具有極好的促進反應的協同作用。C2~C4醇的高選擇性可以在t= 140 °C下實現(尤其是使用DMI作共溶劑時),液相產物中C2~C4醇的選擇性可達35.2%。
2.1.4 Pd基催化劑
由于Pt及其合金催化劑具有很強的CO2活化能力,因此有關CO2加氫制乙醇催化劑的研究主要集中在Pt及其合金催化劑上,但是Pt高昂的價格及其稀缺性嚴重阻礙了此類催化劑的進一步發展。因此人們開始專注于開發無Pt催化劑用于CO2加氫轉化制乙醇,其中Pd基催化劑由于有利于C—C偶聯反應(控制乙醇產率的關鍵步驟)而引起了廣泛關注。
在間歇反應器中,BAI等[28]合成了高度有序的Pd-Cu NPs催化劑,實現了高活性、高選擇性、高穩定性地將CO2加氫轉化為乙醇。通過調整Pd-Cu NPs和催化劑載體的組成發現,Pd2Cu NPs/P25 對乙醇的選擇性高達92.0%,轉換頻率(TOF)可達359.0 h-1。DRIFTS表征結果表明,Pd與Cu間的電子相互作用可促進*CO氫化為*HCO(CO2加氫生成乙醇的速率控制步驟)。在連續反應器中,LOU等[31]制備了一種特殊的CeO2負載的Pd二聚體(Pd2/CeO2)催化劑,該催化劑可有效地將CO2轉化為乙醇,乙醇選擇性高達99.2%,乙醇產率達45.6 g/(g·h)(單位時間單位質量催化劑(以Pd計)上生成乙醇的質量)。這是由于Pd二聚體具有獨特的Pd2O4構型,能夠直接將CO2解離為CO,觸發C—C偶聯,Pd2/CeO2表面與CO結合能力強,從而防止CO解吸,并促進CO和*CH3中間體之間的偶聯形成乙醇前驅體,從而實現高活性、高選擇性生成乙醇。
2.1.5 In基催化劑
In2O3是CO2加氫制甲醇的有效催化劑,而Ir基單核配合物能夠催化甲醇羰基化進而生成C2+醇。在間歇反應器中,YE等[37]設計了一種雙功能Ir1-In2O3單原子催化劑,通過將單原子Ir錨定在In2O3載體上整合兩種催化活性中心。結果表明,該催化劑可有效催化CO2加氫并高選擇性地生成乙醇(選擇性> 99%),初始TOF可達481 h-1。該催化劑的機理研究表明,Ir原子與相鄰的氧空位結合形成路易斯酸堿對,激活CO2并形成吸附在Ir原子上的羰基(*CO)中間體。然后*CO與吸附在In2O3上的甲醇結合形成C—C鍵,進而生成乙醇。
2.1.6 Cu基催化劑
在間歇反應器中,AN等[38]于t= 100 °C、p= 2 MPa、n(H2):n(CO2) = 3:1 的條件下使用MOF(金屬有機骨架)負載的Cu基催化劑Zr12-bqdc-CuCs催化CO2加氫反應,產物乙醇的選擇性> 99%。該催化劑不僅具有較好的穩定性和較高的選擇性,其特殊的催化劑結構還避免了活性位點的團聚。作者通過同位素追蹤實驗和理論計算的結果,提出了CO2加氫生成甲醇和乙醇的反應機理,如圖5 所示。該研究結果展現出MOF材料作為催化劑載體的獨特優勢,為CO2加氫制乙醇開拓了新的思路。
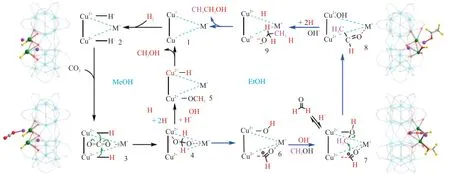
圖5 Zr12-bpdc-Cu催化劑上CO2 加氫生成甲醇和乙醇的反應機理[38]Fig. 5 Reaction mechanism of methanol and ethanol synthesis from CO2 hydrogenation over Zr12-bpdc-Cu catalyst[38]
在連續反應器中,DING等[29]在Na-Beta沸石的晶粒中嵌入2~5 nm的Cu納米顆粒,成功合成了一種高性能催化劑Cu@Na-Beta,在其作用下,CO2加氫獲得乙醇為唯一有機產物。t= 300 °C、GHSV=12000 mL/(g·h)及p= 2.1 MPa條件下,乙醇單程產率可達14%,時空產率(單位時間單位質量催化劑上生成乙醇的質量)為398 mg/(g·h)。結合實驗和理論計算結果,認為不規則Cu納米粒子與周圍沸石骨架之間的協同作用是催化劑Cu@Na-Beta高性能的原因。
2.1.7 Co基催化劑
Co基催化劑催化CO2加氫反應生成烴類和含氧化合物的關鍵在于降低金屬Co的加氫性能,使得CO2可以轉化形成CO中間體,隨后繼續加氫形成烴類或含氧物質(如醇類)[39]。Co2C催化劑由于具有優秀的CO插入能力,可以在CO加氫反應中實現超過60%的醇選擇性。但是Co2C是一種結構敏感的催化劑,在H2氣氛下很容易被分解為金屬Co。金屬Co有利于CO解離活化形成大量*CHx,不利于CO插入反應的進行,在CO2加氫反應中會增加CH4的選擇性,降低乙醇的選擇性。
為了實現Co2C的穩定性及CO吸附與活化的調節,在連續反應器中,ZHANG等[40]通過引入不同的堿金屬并改變其含量來調節Co2C與堿金屬之間的相互作用。其以SiO2為載體,通過浸漬法制備了不同堿金屬修飾的X-Co/SiO2(X= Li、Na、K)催化劑。CO2加氫反應結果表明,2%Na-Co/SiO2(Na質量分數2%)催化劑獲得了最高的醇選擇性(12.5%)和乙醇產率(0.47 mmol/(g·h)),該催化劑在100 h穩定性測試中基本保持穩定。此外,ZHANG等[41]制備了負載在不同載體(Al2O3、ZnO、AC、TiO2、SiO2和Si3N4)上的Na-Co基催化劑,用于將CO2直接加氫生成乙醇,并探究載體的影響。結果表明,SiO2和Si3N4負載的催化劑在反應溫度為250 °C時表現出較高的乙醇選擇性,CO2轉化率為18.82%,乙醇選擇性為62.81%,而CH4主要在其他負載型催化劑上產生。負載型Co2C催化劑的CO2加氫制乙醇反應機理如圖6 所示。
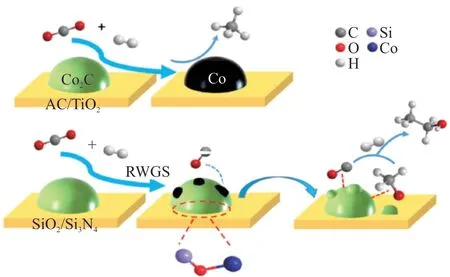
圖6 負載型Co2C催化劑的CO2 加氫制乙醇機理[41]Fig. 6 Mechanism of supported Co2C catalyst in CO2 hydrogenation to ethanol[41]
在間歇反應器中,ZHANG等[42]以離子液體為前驅體制備了一系列CoMoCx催化劑,并通過改變滲碳溫度來調節CoMoCx催化劑的比例和電子性質,優化CO2催化加氫生成乙醇的效率。在最佳反應條件(t= 180 °C和p= 2 MPa )下,乙醇的選擇性達97.4%、產率達0.528 mmol/(g·h)。此外,WANG等[43]以Co-Al層狀雙金屬氫氧化物(LDH)為前驅體,通過煅燒和還原制備了氧化鋁負載的Co催化劑(CoAlOx);通過在不同的預還原溫度下調節催化劑的Co-CoOx組成,提高了CO2加氫制乙醇的選擇性。結果表明, 600 °C下還原后的催化劑在140 °C下反應時乙醇選擇性為92.1%,產率為0.444 mmol/(g·h)。
2.1.8 Fe基催化劑
由于貴金屬價格昂貴及資源稀有,將其作為催化劑的主要成分大量用于轉化大規模CO2是不現實的。在連續反應器中,INUI等[44]選擇FT型成分(Fe、Cu、Zn、Al和K)作為催化劑主要組分,以較小質量分數的貴金屬(例如Pd和Rh)和少量的Ga作為提高催化性能的關鍵組分(根據需要組合的元素的催化劑性質,選擇適宜的比例),合成了催化CO2加氫生成乙醇的Fe基FT型復合催化劑,并探究了其催化CO2加氫合成乙醇的催化性能。結果表明,在CO2轉化率分別為31.1%和54.5%時,在不同的催化劑組合和反應條件下,乙醇的最高產率分別為874 g/(L·h)和476 g/(L·h)。
表 1 總結了不同催化劑在不同反應條件下的CO2加氫制乙醇性能研究結果。
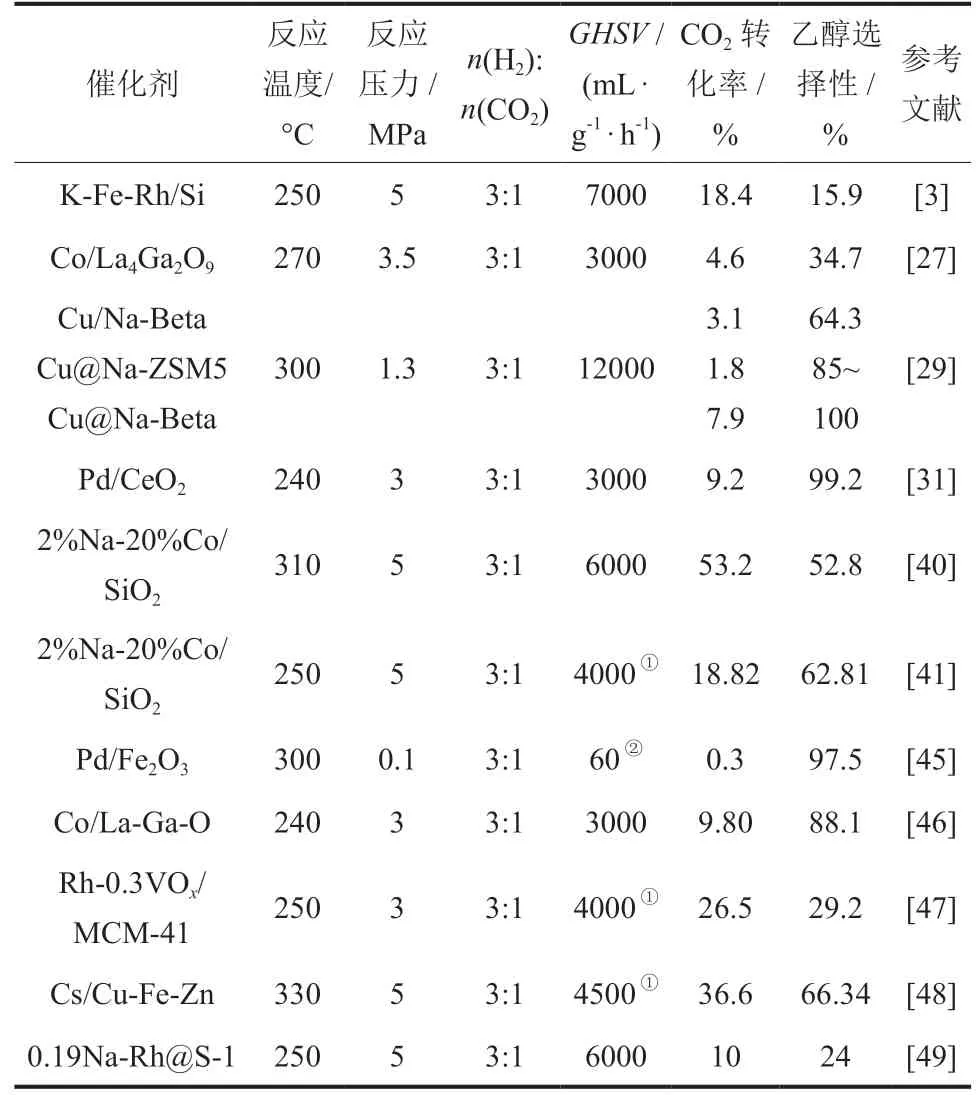
表1 不同催化劑CO2 加氫制乙醇性能比較Table 1 Performance comparison of different catalysts for CO2 hydrogenation to ethanol
2.2 載體對催化劑性能的影響
在CO2加氫制乙醇中使用的載體類型也影響著催化劑性能。載體為催化劑納米顆粒提供熱穩定性和機械穩定性的同時,還有助于改善顆粒的流動性,從而有利于化學穩定性的提高。
在 間 歇 反 應 器 中,BAI等[28]在t= 200 °C、n(H2):n(CO2) = 3:1 和反應時間為5 h的條件下,研究了載體SiO2、CeO2、Al2O3和P25 上負載Pd2Cu NPs后催化劑的CO2加氫制乙醇催化性能。結果表明,這4 種載體負載Pd2Cu NPs后,其乙醇產率分別為14.8 mmol/(g·h)、16.2 mmol/(g·h)、19.7 mmol/(g·h)
和41.5 mmol/(g·h)。由于P25 上存在氧物種且Pd和Cu之間發生電荷轉移使得Pd2Cu NPs/P25 催化劑表現出最佳的催化性能和最大的乙醇產率。
在連續反應器中,YANG等[32]以質量分數1%的RhFeLi作為摻雜劑,在t= 250 °C、n(H2):n(CO2) = 3:1、p= 3 MPa和GHSV= 6000 h-1的條件下考察了不同載體對乙醇收率的影響,其使用的載體是ZSM-5、SiO2、TS-1、銳鈦礦TiO2、TiO2NRs、TiO2Com(商用TiO2)、ZrZnOx、ZnO和ZrO2。結果表明,TiO2NRs作為載體時獲得了最高的乙醇產率(1.3%),這是由于TiO2NRs中羥基含量較高,有利于生成乙醇。ZHANG等[41]在t= 250 °C、p= 5 MPa、GHSV= 4000 h-1、n(H2):n(CO2) = 3:1 及反應時間40 h的條件下,通過改變載體研究了Co2C催化劑的CO2加氫制乙醇性能。結果表明,與載體SiO2(18.82%,轉化率,下同)和Si3N4(17.75%)相比,以Al2O3(48.47%)、ZnO(33.69%)、AC(67.19%)和TiO2(63.66%)為載體的催化劑CO2轉化率更高;在Na-Co/AC催化劑上實現了最大的CO2轉化率(67.19%)和乙醇選擇性(71.36%),但低CO選擇性有利于甲烷的形成。因此,綜合考慮,SiO2被認為是該反應條件下的最佳載體,此時CO2轉化率為18.82%,乙醇選擇性為62.81%。
2.3 金屬摻雜/負載對催化劑性能的影響
對于CO2加氫制乙醇反應,通過在催化劑載體上摻雜/負載不同含量的金屬,可以調節CO2的轉化率和目標產物乙醇的選擇性。因此,研究者們常通過金屬摻雜/負載來優化催化劑性能以確保生成更多的目標產物乙醇。
在間歇反應器中,CUI等[50]基于n(Ru):n(Co)分別為20:40、30:30、40:20、45:15、20:10 和60:30 進行負載制備了Ru3(CO)12-Co4(CO)12催化劑,并在t= 200 °C、n(H2):n(CO2) = 2:1 和反應時間為12 h下進行CO2加氫制乙醇反應。結果表明,n(Ru):n(Co)為40:20 時,乙醇選擇性最高,為87.5%(29.5 mmol/(L·h)),這是因為高負載量影響了乙醇的生成速率并增加了甲醇的合成。YE等[37]在反應t= 200 °C、n(H2):n(CO2) =5:1 及反應時間為 5 h條件下,考察了Ir-In2O3催化劑中Ir的負載量(質量分數,下同)從0.2%增加到1.0%時催化劑的性能。結果表明,隨著Ir負載量的增加,乙醇選擇性從85.3%(0.92 mmol/(g·h))持續下降到5.7%(0.13 mmol/(g·h))。因此增加Ir的負載量會抑制乙醇合成并生成更多的甲醇。SEM-EDX和TEM分析結果表明,隨著Ir負載量從0.5%增加到1.0%,單原子Ir從小尺寸生長為1~2 nm大小的聚集納米顆粒,比表面積減小且關鍵活性位點減少,導致產物中乙醇產量降低。
在連續反應器中,WANG等[47]在t= 250 °C、WHSV= 6000 h-1和n(H2):n(CO2) = 3:1 的條件下,對催化劑Rh-VOx/MCM-41 進行了質量分數為0.1%至1.0%的VOx金屬負載。結果表明,當負載量為0.3%時,乙醇選擇性(在醇中)最高,為24.1%;較高的負載量降低了CO2的轉化率和乙醇的選擇性,這是由于大量的VOx覆蓋在Rh表面,阻礙了Rh活性位點發揮作用。ZHANG等[49]在t= 250 °C、p= 5 MPa和GHSV= 6000 mL/(g·h)條件下,研究了Na-Rh/S-1 催化劑中金屬Na負載量(質量分數)在0.13%~0.26%之間變化時催化劑的性能。結果表明,在沒有Na負載的情況下,產物中不會形成乙醇,表明在選擇性生成乙醇的過程中需要Na和Rh的相互作用。隨著Na的負載量的增加,乙醇的選擇性呈現出先增大后降低的趨勢,當金屬Na負載量為0.19%時,此時乙醇的選擇性最大,為24%(72 mmol/(g·h)),這是由于當Na的負載量繼續增大時,較多的Na覆蓋了大部分Rh+活性位點,導致乙醇的選擇性降低。
2.4 工藝參數對催化劑性能的影響
2.4.1 反應溫度的影響
適宜的反應溫度不僅能促進CO2的活化,還能促進中間體*CO進一步生成乙醇的前驅體*CHxO。由于CO2化學性質穩定且受動力學控制,因此通常要求反應溫度在200~300 °C范圍內,以使產物中乙醇的選擇性更高。
在間歇反應器中,QIAN等[33]制備了Ru3(CO)12/Rh2(CO)4Cl2-LiI催化劑,在n(H2):n(CO2) = 4:4和反應時間為12 h條件下將溫度從180 °C升高到200 °C時,乙醇產率從3.6 mmol/(L·h)增加到6.0 mmol/(L·h);進一步升高到220 °C,乙醇產率略有增加,達到6.2 mmol/(L·h),而C3~C4醇產率在高溫下不斷增加。Ye等[37]制備了Ir1-In2O3催化劑,在n(H2):n(CO2) =5:1、反應時間為 5 h的條件下考察了反應溫度從180 °C升高到240 °C時催化劑的性能。結果表明,當溫度從180 °C升高到200 °C時,乙醇選擇性保持在99.7%, 至240 °C時,乙醇選擇性則降至92.2%(1.44 mmol/(g·h)),表明反應在較高溫度下受動力學控制,溫度進一步升高提高了甲醇收率降低了乙醇選擇性。
在連續反應器中,WANG等[47]在WHSV= 6000 h-1、n(H2):n(CO2) = 3:1 和 反 應 時 間 為12 h 的 條 件下,研究了反應溫度在200~300 °C范圍內催化劑Rh-0.3VOx/MCM-41 的CO2轉化率和乙醇選擇性變化。結果表明,CO2轉化率從200 °C時的3.10%增加到250 °C時的12.10%,至300 °C時增加到18.48%;而乙醇選擇性從200 °C時的7.74%增加到250 °C 時的24.10%,至300 °C時則下降到10.00%。表明溫度較高時,大部分CO2轉化為CO,且高溫限制了CO進一步加氫生成乙醇的反應。ZHENG等[46]在GHSV=3000 mL/(g·h)、n(H2):n(CO2) = 3:1 和反應時間為18 h的條件下,研究了反應溫度從230 °C升高到 290 °C時催化劑LaCo0.7Ga0.3O3的CO2轉化率和產物選擇性變化。結果表明,反應溫度從230 °C升高到290 °C時,CO2轉化率從5.60%增加到28.29%,乙醇選擇性從83.38%降低到40.50%,表明在較高的反應溫度下易生成甲醇和CO等副產物,而最佳反應溫度為240 °C,此時CO2的轉化率為10.10%,乙醇的選擇性為80.00%。
2.4.2n(H2):n(CO2)的影響
n(H2):n(CO2)對CO2加氫生成乙醇有一定的影響。較低的n(H2):n(CO2)有利于CO2加氫生成甲醇,而較高的n(H2):n(CO2)則可能會使生成的乙醇進一步氫化成C3~C4醇,由于這兩種情況都不利于合成乙醇,因此需要優化n(H2):n(CO2)。
在間歇反應器中,QIAN等[33]在t= 200 °C、反應時間為12 h的條件下研究了n(H2):n(CO2)對催化劑Ru3(CO)12/Rh2(CO)4Cl2產物選擇性的影響。結果表明,在n(H2):n(CO2) = 4:4 時乙醇選擇性最高,為47.3%(6.09 mmol/(L·h))。CUI等[50]在t= 200 °C、反應時間為12 h的條件下,使用雙金屬催化劑Ru3(CO)12-Co4(CO)12研究了n(H2):n(CO2)分別為1:2、2:4、3:6 和6:3 等時產物的選擇性變化。結果表明,當n(H2):n(CO2) = 6:3 時乙醇選擇性最高,為87.5%;而當n(H2):n(CO2) 保持在3:6 時,乙醇選擇性降低到73.4%(6.1 mmol/(L·h)),表明適當的氫壓力可以提高乙醇選擇性。
在連續反應器中,AN等[27]在t= 270 °C、GHSV=3000 mL/(g·h)和反應時間為12 h的條件下,研究了n(H2):n(CO2)分別為3:1、4:1 和5:1 時催化劑Co/La4Ga2O9的產物選擇性變化。結果表明,隨著n(H2):n(CO2)從3:1 增加到5:1,CO2轉化率從7%降低到2%,乙醇選擇性從64%降低到28%,這是由于CO和H2在Co NPs表面存在競爭吸附,較低的H2與CO2比例有利于CO吸附在Co NPs表面,因此提高了乙醇的選擇性;而較高的H2與CO2比例傾向于促進H2吸附在Co NPs表面,從而減少了CO的吸附并降低乙醇選擇性,同時提高CO選擇性。
2.4.3 反應時間的影響
反應時間也是CO2加氫制乙醇的重要影響因素。通常較短的反應時間對反應有利,但過短的反應時間生成的乙醇量較少;而反應時間較長最終會導致乙醇氫化成C3~C4醇,或由于可逆反應氫化成甲醇。因此,需要優化反應時間以使產物中的乙醇含量更高。
在間歇反應器中,ZHANG等[42]在t= 180 °C、p= 2 MPa條件下,考察了反應時間從2 h增加到10 h時催化劑CoMoCx-800(碳化溫度為800 °C)催化CO2加氫生成乙醇的選擇性變化。結果表明,隨著反應時間從2 h增加到10 h,乙醇選擇性從94.0%逐漸增加到98.5%;然而,由于甲醇和高級醇的形成,乙醇產率在反應6 h后開始下降。WANG等[30]在t= 200 °C和n(H2):n(CO2) = 3:1 的條件下,考察了反應時間從4 h增加至20 h時催化劑Co0.52Ni0.48AlOx催化CO2加氫制乙醇的選擇性變化。結果表明,在4~12 h的反應時間內,乙醇選擇性先從76.6%(2.1 mmol/g)增加到85.8%(15.5 mmol/g),隨后又下降到85.0%(26.0 mmol/g),這是由于反應時間較長形成了甲醇所致。
在 連 續 反 應 器 中,YE 等[37]在t= 200 °C、n(H2):n(CO2) = 5:1的條件下,考察了反應時間從0.5 h增加至18 h時催化劑Ir1-In2O3催化CO2加氫生成乙醇選擇性的變化。結果表明,反應時間從0.5 h增加到5 h時,乙醇選擇性首先從51.6%(0.016 mmol/(g·h))增加到99.7%(0.990 mmol/(g·h)),此后保持恒定,乙醇產率在反應18 h時達到最大值2.100 mmol/(g·h)。ZHANG等[42]在t= 250 °C、GHSV= 4000 h-1和n(H2):n(CO2) = 3:1 的條件下,考察了反應時間從21 h增加到296 h時催化劑Na-Co/SiO2催化CO2加氫轉化率和乙醇選擇性的變化。結果表明,隨著反應時間從21 h增加到42 h,CO2轉化率和乙醇選擇性分別達到最大值18.8%和62.8%;反應進行到296 h時CO2轉化率和乙醇選擇性分別降低到14.7%和59.1%,這是由于較長的反應時間使乙醇進一步加氫生成了副產物丙醇和C5OH,從而顯著降低乙醇的選擇性。ZHANG等[40]在t= 310 °C、WHSV=6000 mL/(g·h)和n(H2):n(CO2) = 3:1 的 條 件 下,考察了反應時間從25 h增加到100 h時催化劑Na-Co/SiO2催化CO2加氫生成乙醇產率的變化。結果表明,隨著反應時間從25 h增加到50 h,乙醇產率從0.21 mmol/(g·h)增加到0.54 mmol/(g·h),至100 h時乙醇產率下降到0.41 mmol/(g·h)。與H2相比,CO在Co位點上的吸附較少,導致C—C耦合減少,乙醇的生成量減少,因此,乙醇產率的下降是由于CO選擇性增加。
2.4.4 空速的影響
空速是基于反應物分子在催化劑上停留時間的另一個重要參數,空速高停留時間短,空速低則停留時間長。停留時間過短會減少反應物分子與催化劑的接觸時間導致轉化率較低,而停留時間過長則會使更多的產物乙醇轉化為C3~C5醇,因此需進行優化以尋找到最佳的空速條件。
在連續反應器中,WANG等[47]使用Rh-0.3VOx/MCM-41 催化劑在t= 250 °C、n(H2):n(CO2) = 3:1 和反應時間為12.0 h時考察了WHSV從4000 h-1增加到12000 h-1時CO2加氫制乙醇產物的變化。結果表明,隨著WHSV從4000 h-1增加到6000 h-1,CO2轉化率首先從26.5%增加到28.2%,至12000 h-1時下降到16.5%,表明較高的空速會減少反應物分子與催化劑的接觸時間,從而降低CO2轉化率;對選擇性而言,在WHSV從4000 h-1增加到12000 h-1時,乙醇選擇性從29.2%下降到20.0%,這是由于VOx物種的存在占據了Rh位點,較高的空速有利于CO的形成,同時由于CO的解離,還會生成CH4,因此WHSV=4000 h-1時最佳,此時乙醇的選擇性更高。AN等[27]使 用Co/La4Ga2O9催 化 劑 研 究 了 在t= 270 °C、n(H2):n(CO2) = 3:1 時GHSV從1500 mL/(g·h)增 加到7500 mL/(g·h)時產物的變化。結果表明,隨著GHSV從1500 mL/(g·h)增加到7500 mL/(g·h),CO2轉化率從30%降低到11%,乙醇選擇性(在醇中)從62%降低到28%,這是由于空速增大減少了反應物種和催化劑活性位點的接觸時間,使CO2轉化率降低;當GHSV> 3000 mL/(g·h)時,*CO傾向于從催化劑表面脫離形成CO,從而使乙醇的生成量減少。該反應體系中,GHSV= 3000 mL/(g·h)時最佳。
3 結語與展望
在“碳達峰、碳中和”背景下,CO2催化加氫制乙醇是一條具有現實意義的轉化途徑,但由于CO2的化學惰性、反應機理的復雜性以及反應路徑的難以控制性而限制了其工業化的進程。本文綜述了CO2加氫制乙醇的研究進展,分析了CO2加氫制乙醇反應機理,歸納總結了活性組分、載體、金屬摻雜/負載以及工藝參數對催化劑性能的影響。總結認為:對于CO2催化加氫制乙醇反應機理和路徑主要觀點有兩種:一是CO2經RWGS反應生成CO,部分CO氫化生成*CH3,CO嵌入*CH3中完成碳鏈增長,再進一步加氫生成乙醇;二是CO2分子經吸附和活化形成羧酸中間體,進一步還原產生甲酸中間物種*HCOO,*CHx與*HCOO鍵合形成表面中間體(*CH3COO),進一步氫化形成乙醇。
盡管目標產物乙醇的產率和選擇性在實驗室規模能達到預期,但是在推進其工業化的進程中,仍存在副產物CO選擇性過高及催化劑時空產率較低等問題。未來的研究方向應在保證獲得更高的CO2轉化率和乙醇產率的同時,實現反應器的大規模CO2處理;從工業化的角度來看,所需的催化劑應具有更高的活性、選擇性和穩定性,同時應關注工業放大以后催化劑的可回收性以及催化劑循環利用后的損失問題。

