DADS抑制XIAP介導(dǎo)的人胃癌HGC27細(xì)胞增殖、遷移和侵襲
劉芳, 李志敏, 曹振華, 何慧, 蘇琦, 蘇波
(南華大學(xué)衡陽(yáng)醫(yī)學(xué)院 1.腫瘤研究所,2.基礎(chǔ)醫(yī)學(xué)院應(yīng)用解剖與生殖醫(yī)學(xué)研究所,3.藥學(xué)院藥物藥理研究所,湖南省衡陽(yáng)市 421001)
胃癌是中國(guó)第二大常見(jiàn)癌癥,是所有癌癥類型中的第三大死因[1]。大蒜素的抗癌作用高于其他化療藥物,毒性和不良反應(yīng)相對(duì)較小,二烯丙基二硫(diallyl disulfide,DADS)是由大蒜素分解的活性產(chǎn)物之一[2]。DADS具有抗胃癌細(xì)胞增殖、遷移和侵襲的作用[3]。
X連鎖凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)通過(guò)作用凋亡蛋白Caspases抑制凋亡、促進(jìn)腫瘤細(xì)胞增殖,并且參與信號(hào)通路調(diào)節(jié)、促進(jìn)腫瘤轉(zhuǎn)移[4]。DADS抑制胃癌細(xì)胞XIAP表達(dá)[5],本文在此基礎(chǔ)上研究DADS是否通過(guò)下調(diào)XIAP抑制XIAP過(guò)表達(dá)胃癌細(xì)胞增殖、遷移和侵襲。
1 材料和方法
1.1 主要試劑
新生小牛血清(杭州四季青生物工程公司);嘌呤霉素(Invitrogen公司);DADS(Sigma公司);CCK-8細(xì)胞增殖檢測(cè)試劑盒(Dojindo公司);BCA蛋白定量試劑盒(Promega公司);抗XIAP、β-actin抗體(Abcam公司);ECL發(fā)光試劑盒(Santa Cruz公司);Matrigel基質(zhì)膠(BD公司)。
1.2 細(xì)胞培養(yǎng)和XIAP過(guò)表達(dá)細(xì)胞株構(gòu)建
人胃癌HGC27細(xì)胞(中山大學(xué)腫瘤防治中心饋贈(zèng))置于5%CO2、飽和濕度的37 ℃培養(yǎng)箱,用含10%小牛血清的RPMI 1640培養(yǎng)基培養(yǎng)。GV358慢病毒空載體(Vector)和XIAP過(guò)表達(dá)載體(XIAP)購(gòu)自上海吉?jiǎng)P基因公司。胃癌細(xì)胞接種于24孔板,將XIAP-GV358慢病毒轉(zhuǎn)染HGC27細(xì)胞,48 h后倒置熒光顯微鏡下觀察綠色熒光蛋白(green fluorescent protein,GFP)表達(dá)情況;用嘌呤霉素(0.3 mg/L)篩選穩(wěn)定轉(zhuǎn)染的細(xì)胞株;以未轉(zhuǎn)染(Control組)和Vector組為對(duì)照,Western blotting鑒定XIAP表達(dá)。過(guò)表達(dá)實(shí)驗(yàn)分為Vector組、Vector+DADS組、XIAP組、XIAP+DADS組。Vector組、XIAP組未用DADS處理,Vector+DADS組、XIAP+DADS組DADS(30 mg/L)處理24 h。
1.3 Western blotting
用RIPA溶液4 ℃裂解細(xì)胞,提取蛋白,BCA法檢測(cè)蛋白水平,各組取等量樣本凝膠電泳,轉(zhuǎn)移至PVDF膜,置于脫脂牛奶封閉1 h,4 ℃孵育一抗過(guò)夜,TBST洗膜3次,二抗孵育1 h,TBST洗膜3次,加ECL發(fā)光液,X片曝光、顯影、定影。掃描灰度值,以β-actin作為內(nèi)對(duì)照計(jì)算相對(duì)蛋白表達(dá)水平。
1.4 MTT檢測(cè)
96孔板中接種各組細(xì)胞,每組設(shè)置6個(gè)重復(fù)孔,用DADS(30 mg/L)處理細(xì)胞24、48、72 h后,每孔加入10 μL CCK-8溶液后置于培養(yǎng)箱2 h,酶聯(lián)免疫檢測(cè)儀中測(cè)定OD450值。細(xì)胞增殖率(%)=[(實(shí)驗(yàn)組OD值-空白組OD值)/(對(duì)照組OD值-空白組OD值)]×100%。
1.5 平板克隆形成實(shí)驗(yàn)
6孔板中接種各組細(xì)胞,每孔200個(gè)細(xì)胞,每組設(shè)置3個(gè)重復(fù)孔,處理細(xì)胞后放置培養(yǎng)箱培養(yǎng)14天,PBS洗3次,4%多聚甲醛固定30 min,PBS洗3次,自然風(fēng)干后用結(jié)晶紫染色。克隆形成率(%)=(克隆數(shù)/接種細(xì)胞數(shù))×100%。
1.6 遷移和侵襲實(shí)驗(yàn)
在Transwell上層小室接種各組細(xì)胞,將1640培養(yǎng)基(含10%胎牛血清)加入下室,DADS(30 mg/L)處理細(xì)胞24 h后,拭去小室上層膜表面的細(xì)胞,用4%多聚甲醛溶液固定小室下表面的細(xì)胞,結(jié)晶紫溶液(0.1%)染色。倒置顯微鏡下隨機(jī)選擇4個(gè)高倍視野,計(jì)數(shù)遷移的細(xì)胞數(shù)量,計(jì)算平均值。進(jìn)行侵襲實(shí)驗(yàn)前,將Matrigel基質(zhì)膠鋪在小室上層膜表面,之后的實(shí)驗(yàn)步驟與上述遷移實(shí)驗(yàn)相同。
1.7 統(tǒng)計(jì)學(xué)分析
采用SPSS 17.0統(tǒng)計(jì)軟件。數(shù)據(jù)用均數(shù)±標(biāo)準(zhǔn)差表示,兩組間比較采用t檢驗(yàn),多組間比較采用單因素方差分析,P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié) 果
2.1 XIAP過(guò)表達(dá)胃癌HGC27細(xì)胞株的建立及鑒定
HGC27細(xì)胞轉(zhuǎn)染慢病毒48 h后,光學(xué)顯微鏡下觀察到細(xì)胞狀態(tài)良好,熒光顯微鏡下觀察到GFP熒光信號(hào)強(qiáng),提示XIAP-GV358慢病毒載體轉(zhuǎn)染細(xì)胞效率較高(圖1A);繼續(xù)用嘌呤霉素篩選細(xì)胞株2周,Western blotting鑒定Control組、Vector組、XIAP組的XIAP蛋白表達(dá)情況,結(jié)果顯示XIAP組蛋白水平明顯高于Control和Vector組(P<0.05;圖1B),成功建立XIAP穩(wěn)定過(guò)表達(dá)HGC27細(xì)胞株。

圖1 慢病毒轉(zhuǎn)染HGC27細(xì)胞及Western blotting檢測(cè)XIAP表達(dá)A為光學(xué)顯微鏡下(左)和熒光顯微鏡下(右)觀察慢病毒轉(zhuǎn)染的HGC27細(xì)胞;B為Western blotting檢測(cè)XIAP表達(dá)。a為P<0.05,與Control組和Vector組比較。
2.2 DADS對(duì)胃癌HGC27細(xì)胞XIAP表達(dá)的影響
Vector+DADS組XIAP蛋白水平低于Vector組(P<0.05;圖2);XIAP+DADS組XIAP蛋白水平高于Vector+DADS組,但低于XIAP組(P<0.05)。

圖2 DADS對(duì)胃癌HGC27細(xì)胞XIAP表達(dá)的影響1為Vector組;2為Vector+DADS組;3為XIAP組;4為XIAP+DADS組。a為P<0.05,與Vector組比較;b為P<0.05,與Vector+DADS組和XIAP組比較。
2.3 DADS對(duì)XIAP過(guò)表達(dá)胃癌HGC27細(xì)胞增殖及克隆的影響
Vector+DADS組細(xì)胞增殖率呈時(shí)間依賴性下降(P<0.05;表1);與Vector組比較,Vector+DADS組增殖率、克隆形成率降低,而XIAP組增殖率、克隆形成率升高;XIAP+DADS組細(xì)胞增殖率、克隆形成率高于Vector+DADS組,低于XIAP組(P<0.05;表1和圖3)。
2.4 DADS對(duì)XIAP過(guò)表達(dá)胃癌HGC27細(xì)胞遷移及侵襲的影響
與Vector組比較,細(xì)胞遷移、侵襲數(shù)量Vector+DADS組明顯減少,XIAP組增加(P<0.05);XIAP+DADS組細(xì)胞遷移、侵襲數(shù)量高于Vector+DADS組,低于XIAP組(P<0.05;表2和圖4)。
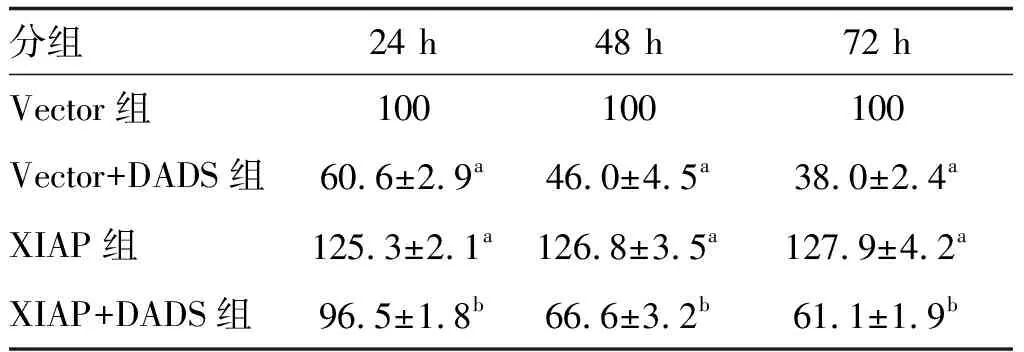
表1 DADS對(duì)XIAP過(guò)表達(dá)HGC27細(xì)胞增殖的影響 單位:%
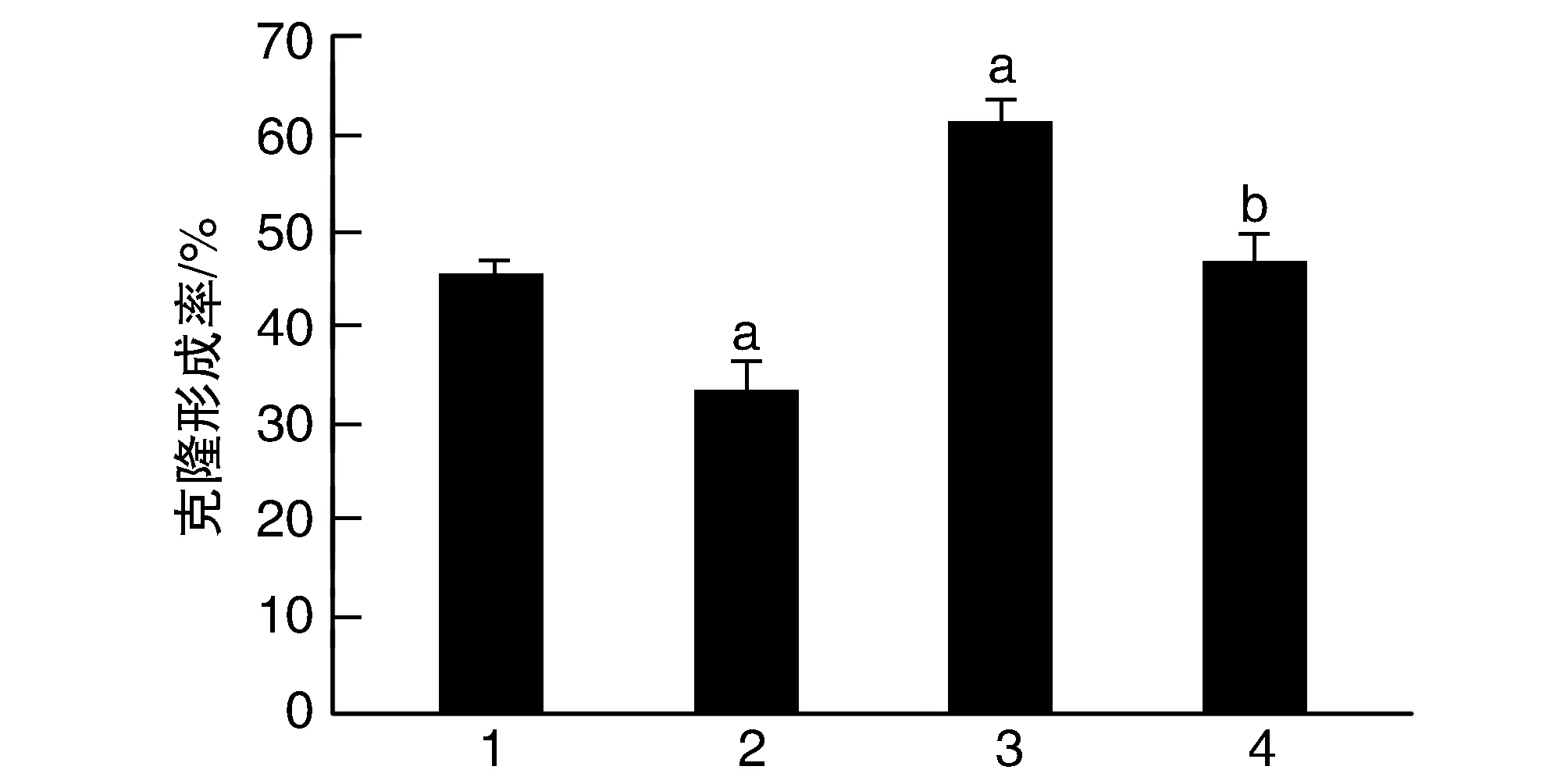
圖3 DADS對(duì)XIAP過(guò)表達(dá)HGC27細(xì)胞克隆形成的影響1為Vector組;2為Vector+DADS組;3為XIAP組;4為XIAP+DADS組。a為P<0.05,與Vector組比較;b為P<0.05,與Vector+DADS組和XIAP組比較。
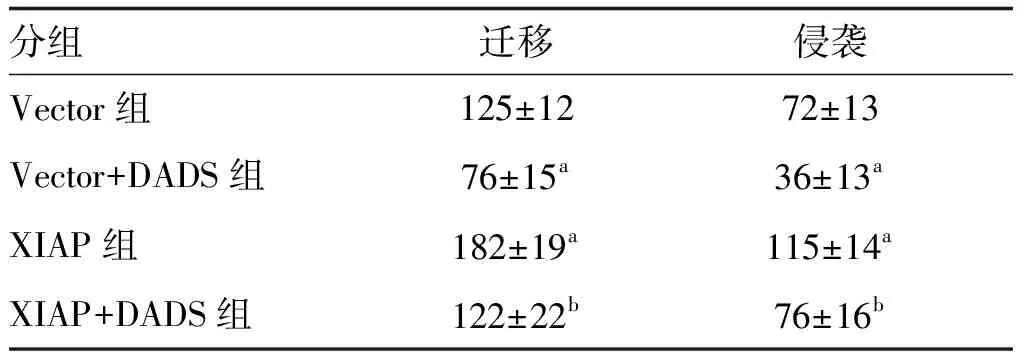
表2 DADS對(duì)XIAP過(guò)表達(dá)HGC27細(xì)胞遷移和侵襲的影響 單位:個(gè)
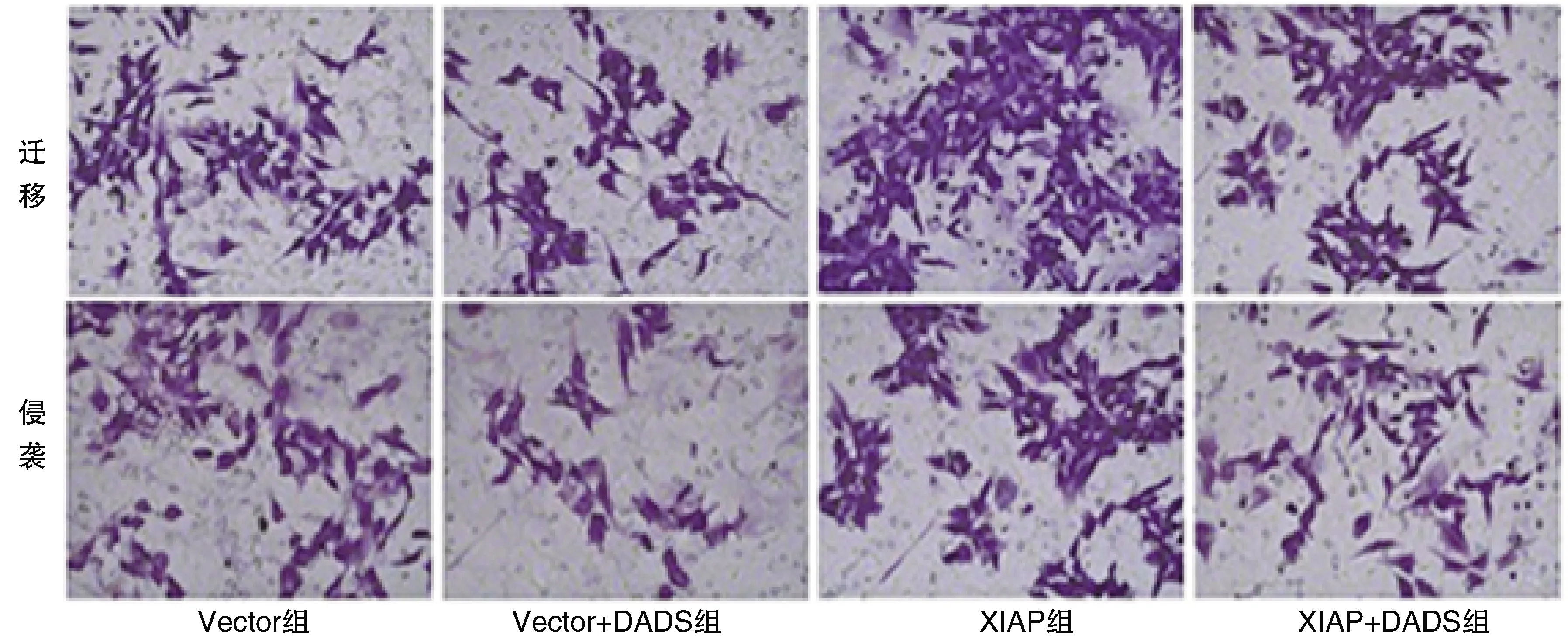
圖4 DADS對(duì)XIAP過(guò)表達(dá)HGC27細(xì)胞遷移及侵襲的影響(結(jié)晶紫染色,40×)
3 討 論
胃癌的早期診斷和治療可提高患者生存率[6],但因復(fù)發(fā)和轉(zhuǎn)移,患者預(yù)后差[7]。研究干預(yù)胃癌發(fā)生的藥物對(duì)于胃癌防治具有重要意義。
XIAP表達(dá)與胃癌生長(zhǎng)、侵襲和轉(zhuǎn)移具有相關(guān)性,癌組織XIAP表達(dá)較高的患者預(yù)后較差,說(shuō)明XIAP與胃癌臨床進(jìn)展密切相關(guān)[8]。本實(shí)驗(yàn)結(jié)果顯示,XIAP過(guò)表達(dá)增強(qiáng)胃癌HGC27細(xì)胞增殖和遷移侵襲能力,證實(shí)XIAP表達(dá)增高可促進(jìn)胃癌細(xì)胞惡性表型。Li等[8]報(bào)道,siRNA下調(diào)XIAP表達(dá)可抑制HGC27細(xì)胞增殖、誘導(dǎo)凋亡。Sun等[9]發(fā)現(xiàn)XIAP是MicroRNA-509-3p作用靶點(diǎn),后者抑制胃癌HGC27和MKN45細(xì)胞遷移和侵襲能力。上述研究表明,下調(diào)XIAP是抗胃癌增殖和轉(zhuǎn)移潛能的有效策略。
DADS可干預(yù)多條信號(hào)通路、發(fā)揮腫瘤防治作用,它通過(guò)下調(diào)癌基因、上調(diào)抑癌基因誘導(dǎo)細(xì)胞周期阻滯,抑制增殖[10]。DADS誘導(dǎo)G2/M期阻滯可抑制胃癌干細(xì)胞增殖[11]。本實(shí)驗(yàn)室通過(guò)差異蛋白質(zhì)譜分析發(fā)現(xiàn),DADS影響LIMK1、RORα、XIAP等多個(gè)基因表達(dá)[5],證實(shí)DADS下調(diào)LIMK1、上調(diào)RORα可誘導(dǎo)G2/M期阻滯、抑制胃癌細(xì)胞增殖[3]。本實(shí)驗(yàn)在證實(shí)過(guò)表達(dá)XIAP促細(xì)胞增殖的基礎(chǔ)上,進(jìn)一步明確DADS通過(guò)下調(diào)過(guò)表達(dá)細(xì)胞XIAP表達(dá)、抑制胃癌HGC27細(xì)胞增殖。文獻(xiàn)報(bào)道,XIAP抑制劑可干預(yù)JAK/STAT、PI3K/Akt、p53、p38等信號(hào)通路,發(fā)揮抗胃癌生長(zhǎng)的作用[12];大麻酚下調(diào)XIAP表達(dá)可抑制胃癌細(xì)胞增殖、誘導(dǎo)凋亡[13]。XIAP參與多條信號(hào)通路的調(diào)節(jié),DADS可能通過(guò)抑制XIAP表達(dá)影響其介導(dǎo)的促胃癌細(xì)胞增殖的信號(hào)通路。
轉(zhuǎn)化生長(zhǎng)因子-β(transforming growth factor,TGF-β)可通過(guò)非Smad依賴性信號(hào)通路誘導(dǎo)腫瘤細(xì)胞由上皮細(xì)胞向間質(zhì)細(xì)胞轉(zhuǎn)化(EMT),使腫瘤細(xì)胞獲得轉(zhuǎn)移能力[14]。XIAP介導(dǎo)TGF-β誘導(dǎo)食管癌細(xì)胞EMT,增強(qiáng)其遷移侵襲能力[15]。本實(shí)驗(yàn)結(jié)果證實(shí),XIAP過(guò)表達(dá)可增強(qiáng)HGC27細(xì)胞遷移侵襲能力,而DADS下調(diào)過(guò)表達(dá)細(xì)胞XIAP的表達(dá)、降低細(xì)胞遷移和侵襲能力。前期研究證實(shí),DADS通過(guò)抑制EMT降低胃癌細(xì)胞遷移侵襲能力[3];DADS下調(diào)TGF-β可抑制EMT相關(guān)信號(hào)通路分子Rac1和β-catenin表達(dá)[16]。DADS可能通過(guò)下調(diào)XIAP抑制TGF-β誘導(dǎo)胃癌細(xì)胞EMT,從而使XIAP介導(dǎo)的細(xì)胞遷移侵襲能力降低。

