電針誘導沉默信息調節因子1依賴性自噬對小鼠腦卒中后中樞性痛的影響
陸大浩, 高 巨, 黃天豐, 張 揚, 王驍穎
(揚州大學附屬蘇北人民醫院 麻醉科, 江蘇 揚州, 225001)
腦卒中后中樞性痛(CPSP)是腦出血性或缺血性損傷后出現的神經性疼痛綜合征[1], 主要表現為腦損傷區域相應軀體部位的持續性或間歇性疼痛。CPSP為腦卒中后常見并發癥, 12%~18%的腦卒中患者會發生CPSP[2]。電針是將電學與針灸相結合的一種治療方法,臨床研究[3]發現電針可用于CPSP的治療,但其機制尚未闡明。自噬是細胞通過溶酶體降解并回收細胞內細胞器或蛋白質的過程,相關研究[4-5]表明,提高自噬水平可改善多種腦卒中后并發癥。沉默信息調節因子1(SIRT1)是煙酰胺腺嘌呤二核苷酸(NAD+)依賴的蛋白去乙酰化酶,其活性上調及表達增加可促進腦神經細胞自噬,在多種神經系統疾病中發揮保護作用[6]。本研究通過建立小鼠CPSP模型,探討電針在CPSP中的作用及其與SIRT1、自噬的關系,以期為CPSP的臨床治療提供參考依據。
1 材料與方法
1.1 實驗動物與分組
選取40只無特定病原體(SPF)級健康雄性ICR小鼠作為研究對象, 8周齡,體質量25~30 g, 購自揚州大學比較醫學中心,許可證號為SYXK(蘇)2017-0044。將小鼠分籠飼養于實驗室環境中適應3 d, 隨機分為假手術組(Sham組)、CPSP組、CPSP+電針組(EA組)和CPSP+電針+SIRT1抑制劑EX527組(EA+EX527組),每組10只。
1.2 儀器與試劑
華佗牌SDZ-Ⅱ型電針儀(蘇州醫療用品廠有限公司),Ⅳ型膠原酶(北京索萊寶生物技術有限公司), von-Frey纖毛(美國Stoelting公司),熱輻射測痛儀(美國IITC公司), SIRT1兔單克隆抗體(英國Abcam公司), Beclin-1兔單克隆抗體(英國Abcam公司), p62兔單克隆抗體(英國Abcam公司), GAPDH兔單克隆抗體(美國Santa Cruz公司),山羊抗兔免疫球蛋白G(IgG)二抗(美國Santa Cruz公司)。
1.3 CPSP模型建立
將小鼠分籠飼養于實驗室環境中適應3 d, 參照文獻[7]方法建立CPSP模型。腹腔注射10%水合氯醛麻醉小鼠并固定于腦立體定位儀上,剪去顱頂毛發,切開頭皮暴露矢狀縫及前囟。參考小鼠腦立體定位圖譜,于小鼠右側丘腦腹后外側核(前囟后0.82~2.30 mm, 矢狀縫右側1.30~1.95 mm, 顱骨下3.01~4.25 mm)注射Ⅳ型膠原酶(Ⅳ型膠原酶0.01 U溶于10 nL生理鹽水),隨后縫合切口并消毒皮膚。Sham組則注入等量無菌生理鹽水。
1.4 電針治療
模型建立完成24 h后,采用固定器將EA組小鼠固定,參照《實驗動物穴位圖譜》取人中及雙側三陰交、內關穴,針刺深度2 mm, 將針柄與電針儀連接進行電針治療(疏密波,頻率2 Hz/15 Hz, 強度1 mA), 30 min/次, 1次/d, 持續14 d。EA+EX527組小鼠于每日電針治療前30 min腹腔注射5 mg/kg EX527, 其他操作與EA組相同。CPSP組和Sham組小鼠每日僅固定30 min, 無其他處理。
1.5 疼痛行為學測定
于CPSP模型建立前1 d(T0)和模型建立后3 (T1)、7 (T2)、14 d(T3)分別測定各組小鼠的機械縮足頻率(PWF)、熱縮足潛伏期(TWL)和冷縮足潛伏期(CWL)。① PWF測定: 選擇0.07 g規格的von-Frey纖毛進行實驗,測定前將小鼠置入底部為金屬網架的透明玻璃罩內適應30 min, 然后使用von-Frey纖毛垂直、緩慢地刺向小鼠左后爪的足底中央部位,每次刺激1~2 s, 相鄰刺激時間間隔為10~15 s。若小鼠出現舔足或縮足反應則視為陽性,重復刺激小鼠左后爪10次,陽性反應次數占全部刺激次數的百分比即為PWF。② TWL測定: 采用熱輻射測痛儀進行測定。將小鼠置入底部為透明玻璃板的透明玻璃罩內適應30 min, 使用熱輻射測痛儀照射小鼠左后爪的足底中央部位,當小鼠出現舔足或縮足反應時立刻停止照射并記錄相應時間,重復測定5次,每次間隔5 min, 計算5次時間的平均值即為TWL。③ CWL測定: 采用冷鋁板進行測定。將鋁板至于冰盒的冰面上,連續測定其溫度。當鋁板溫度測定為0 ℃時,將小鼠置于板上。當小鼠左后足出現舔足或縮足時立刻記錄時間,重復測定3次,每次間隔10 min, 計算3次時間的平均值即為CWL。
1.6 腦組織含水量測定
模型建立后第14天完成疼痛行為測試后,每組取5只小鼠,予3%戊巴比妥腹腔注射麻醉,迅速斷頭并將腦組織取出,去除腦干、小腦、嗅球及腦組織表面的腦膜和血塊后,使用濾紙將表面水分吸干。取右側大腦半球稱得濕質量,然后置于80℃烘干箱內烘干72 h后稱得干質量。腦組織含水量=(濕質量-干質量)/濕質量×100%。
1.7 蛋白質印跡法(Western blot)檢測腦組織中
SIRT1、Beclin-1、p62蛋白表達水平疼痛行為學測試完成后,將每組另外5只小鼠麻醉并斷頭取出腦組織,取損傷腦組織前后各2 mm范圍內的組織塊,稱重后加入組織裂解液及蛋白酶抑制劑并勻漿,靜置于冰面30 min后移入離心管內,于4 ℃下以12 000轉/min離心15 min, 離心半徑8 cm, 棄沉淀取上清液,采用二喹啉甲酸(BCA)法檢測蛋白濃度。采用十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳將蛋白分離并電泳轉移至聚偏二氟乙烯(PVDF)膜上。于室溫下用5%脫脂牛奶封閉1.5 h后,用TBST緩沖液洗膜3次, 10 min/次。分別加入SIRT1兔單克隆抗體(1∶1 000)、Beclin-1兔單克隆抗體(1∶1 000)、p62兔單克隆抗體(1∶1 000)、GAPDH兔單克隆抗體(1∶5 000), 4 ℃過夜。用TBST緩沖液洗膜3次, 10 min/次,然后將PVDF膜分別放入相應的山羊抗兔IgG二抗(1∶3 000)室溫下孵育2 h, 用TBST緩沖液洗膜3次, 8 min/次。電化學發光法(ECL)顯影曝光后,通過Image J圖像分析軟件計算目標蛋白條帶灰度值,并用其與GAPDH蛋白條帶灰度值的比值表示目標蛋白的相對表達量。
1.8 統計學分析
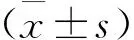
2 結 果
2.1 各組小鼠PWF比較
T0時,各組小鼠PWF比較,差異無統計學意義(P>0.05); T1、T2、T3時, CPSP組、EA組和EA+EX527組小鼠PWF均高于Sham組,差異有統計學意義(P<0.05); EA組小鼠T1時PWF與CPSP組比較,差異無統計學意義(P>0.05),T2、T3時PWF低于CPSP組,差異有統計學意義(P<0.05); EA+EX527組小鼠T1時PWF與EA組比較,差異無統計學意義(P>0.05), T2、T3時PWF高于EA組,差異有統計學意義(P<0.05)。見表1。
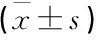
表1 各組小鼠不同時點機械縮足頻率比較 %
2.2 各組小鼠TWL比較
T0時,各組小鼠TWL比較,差異無統計學意義(P>0.05); T1、T2、T3時,CPSP組、EA組和EA+EX527組小鼠TWL均短于Sham組,差異有統計學意義(P<0.05); EA組小鼠T1時TWL與CPSP組比較,差異無統計學意義(P>0.05), T2、T3時TWL長于CPSP組,差異有統計學意義(P<0.05); EA+EX527組小鼠T1時TWL與EA組比較,差異無統計學意義(P>0.05), T2、T3時TWL短于EA組,差異有統計學意義(P<0.05)。見表2。
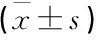
表2 各組小鼠不同時點熱縮足潛伏期比較 s
2.3 各組小鼠CWL比較
T0時,各組小鼠CWL比較,差異無統計學意義(P>0.05); T1、T2、T3時, CPSP組、EA組和EA+EX527組小鼠CWL均短于Sham組,差異有統計學意義(P<0.05); EA組小鼠T1時CWL與CPSP組比較,差異無統計學意義(P>0.05), T2、T3時CWL長于CPSP組,差異有統計學意義(P<0.05); EA+EX527組小鼠T1時CWL與EA組比較,差異無統計學意義(P>0.05), T2、T3時CWL短于EA組,差異有統計學意義(P<0.05)。見表3。
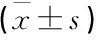
表3 各組小鼠不同時點冷縮足潛伏期比較 s
2.4 各組小鼠腦組織含水量比較
CPSP組、EA組和EA+EX527組小鼠腦組織含水量均高于Sham組, EA組小鼠腦組織含水量低于CPSP組, EA+EX527組小鼠腦組織含水量高于EA組,差異有統計學意義(P<0.05), 見表4。
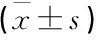
表4 各組小鼠腦組織含水量比較 %
2.5 各組小鼠腦組織SIRT1、Beclin-1、p62蛋白表達水平
與Sham組比較, CPSP組、EA組和EA+EX527組小鼠腦組織SIRT1、Beclin-1表達下調, p62表達上調,差異有統計學意義(P<0.05); 與CPSP組比較, EA組小鼠腦組織SIRT1、Beclin-1表達上調, p62表達下調,差異有統計學意義(P<0.05); 與EA組比較, EA+EX527組小鼠腦組織SIRT1、Beclin-1表達下調, p62表達上調,差異有統計學意義(P<0.05)。見表5、圖1。
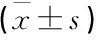
表5 各組小鼠腦組織SIRT1、Beclin-1和p62表達量比較

圖1 各組小鼠腦組織SIRT1、Beclin-1和p62蛋白的Western blot檢測結果
3 討 論
CPSP為腦卒中后最常見的并發癥之一,發生率可達30%左右[8]。由于發病機制尚未完全闡明, CPSP的靶向治療發展緩慢。目前臨床治療CPSP仍以藥物治療方法為主[9], 但長期藥物治療易導致耐藥及多種不良反應。電針具有操作方便、費用低、毒副作用小等優勢,在腦卒中的治療中越來越受到重視。研究[10]顯示,電針治療后,缺血性腦卒中大鼠腦組織中自噬水平升高,腦梗死體積縮小,神經功能缺損程度減輕。有研究[11]提出,在出血性腦卒中大鼠模型中,電針治療同樣可提升腦組織中自噬水平而發揮保護效應,且電針的保護作用可被自噬抑制劑逆轉。然而,電針對CPSP的治療作用是否與自噬相關及其調控機制目前尚無定論。鑒于此,本研究參照文獻[7]建立小鼠CPSP模型,探討電針是否通過調控SIRT1介導的自噬參與CPSP的發生發展,模型建立后, CPSP組小鼠痛閾值降低、腦組織含水量增加,表明造模成功。
自噬為真核細胞胞質內容物降解及再循環的主要方式,對于維持細胞的正常功能、生長發育具有重要意義[12]。Beclin-1是一種重要的自噬調控因子,可作為支架蛋白與Ⅲ型磷脂酰肌醇-3-激酶(PI3K)形成復合物,并促進自噬體形成,在自噬起始階段發揮主導作用[13]。p62是一種多功能的胞質蛋白,為鏈接自噬機制與泛素化蛋白的關鍵調控因子[14]。細胞自噬被激活時, p62蛋白可被降解,水平降低。而自噬功能障礙時, p62蛋白則累積在細胞內,水平升高[15]。因此, p62可作為標記蛋白反映自噬活性。本研究中, CPSP組小鼠腦組織中Beclin-1表達下調、p62表達上調,表明CPSP時自噬水平降低; CPSP小鼠接受電針治療后, Beclin-1表達上調、p62表達下調,自噬水平升高。由此提示,電針可能通過促進自噬活性減輕CPSP。
SIRT1是NAD+依賴的蛋白去乙酰化酶,在機體能量代謝、自噬及抗氧化應激等過程中均具有調節作用[16]。研究[17]顯示, SIRT1可通過活化ULK1和AKT-mTOR等通路激活Beclin-1, 進而誘導自噬。還有研究[18]指出,增加SIRT1的表達可顯著降低p62含量,并促進自噬的發生。本研究結果顯示, CPSP組小鼠腦組織中SIRT1表達下調,自噬水平降低; EA組小鼠接受電針治療后SIRT1表達上調,自噬水平升高; EA+EX527組小鼠經EX527處理后, SIRT1表達下調,自噬水平降低。由此推測,電針可能通過上調SIRT1表達增強自噬活性,進而減輕CPSP。
綜上所述,電針可能通過激活SIRT1的表達促進自噬,從而減輕小鼠CPSP。

