不同質量卵裂期胚胎解凍后培養時間與妊娠結局的關系分析
陳穎,柯雪,滕文頂,張攀
(電子科技大學醫學院附屬婦女兒童醫院 成都市婦女兒童中心醫院生殖醫學中心,成都 610091)
凍融胚胎移植(frozen-thawed embryo transfer,FET)作為體外受精-胚胎移植(IVF-ET)的衍生技術,降低了卵巢過度刺激綜合征、多胎妊娠的發生風險,同時避免了胚胎的浪費。近些年FET技術發展迅速,目前我國FET周期數已遠超鮮胚移植周期數[1-2],因此如何優化FET流程尤為重要。目前對于卵裂期胚胎解凍后的培養時間尚無定論,有的生殖中心常規操作為培養2 h后移植[3],有的中心則培養18~20 h后進行移植[4-7]。尤其針對不同質量卵裂期胚胎的相關研究,更是缺乏大樣本數據分析。因此,本研究回顧性分析了我中心行卵裂期胚胎凍融移植的492個周期,探討不同質量卵裂期胚胎解凍后培養時間與妊娠結局的關系。
資料與方法
一、研究對象及分組
回顧性分析我中心2019年1月至2020年12月行第3天(D3)胚胎凍融移植的病例資料。
納入標準:女方年齡<35歲;采用標準長方案進行控制性卵巢刺激,行IVF或ICSI授精。
排除標準:反復種植失敗;復發性流產;子宮異常,如子宮腺肌病、薄型子宮內膜、子宮內膜息肉、宮腔粘連、宮腔積液等。
共納入492個周期,根據解凍前胚胎評級分為A組(有優胚組,n=221)和B組(無優胚組,n=271);兩組再根據胚胎解凍后距離移植的時間,各分為兩個亞組,即培養2 h的A1組(n=96)和B1組(n=123);培養18 h的A2組(n=125)和B2組(n=148)。
二、研究方法
1.內膜準備及解凍時機:(1)自然周期方案:有正常排卵的患者,經陰道B超監測卵泡發育,結合血清雌二醇(E2)、黃體生成素(LH)、孕酮(P)檢測,于確認排卵當日起肌肉注射黃體酮注射液(20 mg/支,浙江仙琚)40 mg/d;(2)降調節激素替代方案:無規律排卵、子宮內膜異位癥或者慢性子宮內膜炎治療后的患者,于月經周期第2~7天內注射醋酸亮丙瑞林微球(貝依,3.75 mg/支,上海麗珠)3.75 mg,注射后第15~21天經陰道B超復查及性激素達到降調節標準(E2<183.5 pmol/L、FSH<5 U/L、LH<5 U/L,子宮內膜雙層厚度<5 mm)即開始口服戊酸雌二醇(補佳樂,1 mg/粒,拜耳,法國)4~6 mg/d,每5~7 d做一次B超監測,根據子宮內膜厚度決定是否增加戊酸雌二醇用量,至子宮內膜雙層厚度≥7 mm,且口服時間超過14 d后,加用黃體酮注射液60~80 mg/d肌肉注射。兩種內膜準備方案均于黃體酮注射的第4天安排實驗室解凍胚胎。培養2 h組上午解凍上午移植,培養18 h組下午解凍次日上午移植。
2.卵裂期胚胎評級:根據卵裂球細胞數、均一度、碎片比例等進行胚胎質量評級。D3優質胚胎定義為:來源于2PN受精卵,D2細胞數為4~6個,D3細胞數為7~9個,碎片比例<20%,細胞大小基本均勻,透明帶完整,胞質均勻清晰,無顆粒及多核現象。D3可利用胚胎定義為:來源于2PN、0PN和1PN受精卵,D2細胞數≥2個,D3細胞數>4個,碎片比例<50%,細胞大小均勻或不均勻。
3.胚胎玻璃化冷凍與解凍:胚胎培養采用序貫式培養基(COOK,澳大利亞)。主要培養基包括受精培養液、卵裂培養液和囊胚培養液,使用前均在37℃、6%CO2培養箱內平衡過夜。
胚胎玻璃化冷凍:使用試劑為加藤胚胎冷凍試劑(KITAZATO,日本),室溫下將胚胎從卵裂培養液移入平衡(ES)液,在ES液中平衡7~10 min,當卵裂球復原90%左右,將胚胎移入玻璃化(VS)液,60 s內將胚胎裝載至冷凍載桿(KITAZATO,日本),并置入液氮中保存。
胚胎解凍:選用加藤胚胎解凍試劑(KITAZATO,日本),將裝有胚胎的載桿置入37℃預溫的解凍液WS1中,輕晃載桿確認胚胎落入解凍液中,在載桿進入解凍液1 min后,將胚胎依次轉入解凍液WS2、WS3、WS4中,先后停留3 min、5 min、3 min,其中WS2液和WS3液于常溫下進行,WS1液和WS4液置于37℃熱臺進行。隨后將胚胎移入過夜平衡好的含5%人血清白蛋白(HSA)的囊胚培養微滴中,在6% CO2、5% O2、89% N2的三氣培養箱中培養等待移植。
激光輔助孵化(LAH):胚胎移植前1~2 h進行LAH操作。使用非接觸式激光破膜系統(MTG,德國),選擇卵周間隙較大或碎片較多處,將激光靶心對準削薄區透明帶外緣,調整激光的能量與靶心大小,深度為透明帶厚度的2/3,長度為透明帶周長的1/4,而后發射激光進行薄化處理。
4.妊娠判斷及觀察指標:移植后14 d測血β-HCG值;移植后4~6周,彩超檢查見宮內或宮外孕囊定義為臨床妊娠,孕囊數即著床個數。
觀察指標:臨床妊娠率=臨床妊娠周期數/移植周期數×100%;著床率=孕囊數/移植胚胎數×100%;活產率=活產的分娩數/移植周期數×100%;早期流產率=孕12周內自然流產周期數/臨床妊娠周期數×100%;異位妊娠率=異位妊娠周期數/臨床妊娠周期數×100%。
三、統計學分析
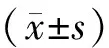
結 果
一、患者基本情況比較
本研究共納入492個D3胚胎FET周期,患者年齡為22~34歲。
根據解凍前胚胎評級分為A組(有優胚組,n=221)和B組(無優胚組,n=271);兩組再根據胚胎解凍后培養時間各分為2 h和18 h兩個亞組,即培養2 h的A1組(n=96)和B1組(n=123);培養18 h的A2組(n=125)和B2組(n=148)。
有優胚組(A組)解凍后不同培養時間亞組(A1組和A2組)間,以及無優胚組(B組)解凍后不同培養時間亞組(B1組和B2組)間,患者年齡、不孕年限、體質量指數(BMI)、抗苗勒管激素(AMH)水平、原發不孕占比、ICSI周期占比、內膜準備方案(自然周期占比),以及移植日子宮內膜厚度、移植胚胎數、解凍前優胚數比較均無統計學差異(P>0.05)(表1,表2)。
二、患者臨床結局比較
A1組臨床妊娠率、著床率顯著高于A2組(P<0.05),A1組活產率高于A2組,但差異無統計學意義(P>0.05),兩組間早期流產率、異位妊娠率無統計學差異(P>0.05);B1組與B2組間各項觀察指標均無統計學差異(P>0.05)(表3,表4)。

表3 有優胚的FET周期妊娠結局的比較(%)

表4 無優胚的FET周期妊娠結局的比較(%)
三、Logistic回歸分析
以臨床妊娠為因變量,胚胎培養2 h、年齡、不孕類型、不孕年限、BMI、AMH、內膜準備方案、內膜厚度、解凍前優胚數、移植胚胎數、授精方式為協變量,進行Logistic回歸分析。結果表明,有優胚組胚胎解凍后培養時間是臨床妊娠率的獨立影響因素[OR=1.972,95%CI(1.090,3.566),P=0.025](表5)。

表5 Logistic回歸分析
討 論
FET技術隨著輔助生殖技術的快速發展應運而生。胚胎冷凍保存可以降低卵巢過度刺激綜合征、多胎妊娠的風險,提高累積妊娠率,為生育力保存及胚胎植入前遺傳學檢測提供技術支持[8]。1985年以來,玻璃化冷凍技術廣泛應用于臨床,冷凍胚胎復蘇率顯著升高,凍融胚胎移植臨床結局也得到很大改善[9]。影響FET活產率的主要因素包括胚胎質量、子宮內膜準備方案、胚胎移植數和BMI等[10]。
關于冷凍胚胎解凍后體外培養時間對妊娠結局的影響爭議不斷。有研究認為當日解凍移植和過夜培養后移植,臨床妊娠率、著床率無統計學差異[11-14]。尹軼莎等[15]發現自然周期排卵后第3天與第4天移植D3凍融胚胎臨床結局無統計學差異;激素替代周期中孕酮轉化內膜4 d后移植D3胚胎可以獲得很好的妊娠結局[16]。然而Guo等[17]則認為,解凍后縮短體外培養時間可以降低培養相關應激,保持胚胎發育的良好潛力。一項1 326例患者的回顧性分析發現,過夜培養可能提高優質卵裂期胚胎的臨床妊娠率,但降低優質囊胚的臨床妊娠率[18]。另一項對1 571例患者優質囊胚FET的回顧性研究則顯示,D5優質囊胚解凍后培養2~4 h移植可提高臨床妊娠率、著床率和持續妊娠率,降低早期流產率[19]。2019年Wang等[3]也提出培養2 h較過夜培養可以提高D3優質胚胎的著床率。研究結論存在相當的不一致性。
本研究僅對卵裂期胚胎展開分析。雖然選擇性單囊胚移植可以提高單次移植的妊娠率,降低多胎妊娠及異位妊娠的風險,但對于D3可利用胚胎較少的患者,囊胚培養可能增加周期取消率,降低累積妊娠率[8],因此仍有大量患者選擇卵裂期胚胎移植。近年來國內外尚缺乏對不同質量卵裂期胚胎FET的大樣本研究。本研究僅納入<35歲的患者,根據胚胎質量進行分組。經過分析發現解凍前有優胚的患者,體外培養2 h后移植,著床率更高。Logistic回歸分析顯示,胚胎解凍后培養2 h是該類患者臨床妊娠率的獨立影響因素。說明延長體外培養時間不能改善D3優質凍融胚胎移植的妊娠結局。而非優質胚胎或許受自身發育潛能的限制,解凍后體外培養時間對妊娠結局影響不明顯。產生上述結果的原因,可能與體外環境影響[20]及母胎界面的相互作用有關。
體外培養環境對胚胎發育與安全性的影響一直備受關注。培養液的成分與pH值、O2、CO2、光照、溫濕度、空氣質量以及設備儀器等都可能影響胚胎發育潛能和安全性[21-22]。同時,應激與對體外環境的適應會影響胚胎發育,引起妊娠丟失[23]。單純體外培養可使小鼠8細胞期胚胎 DNA雙鏈斷裂損傷增多,DNA損傷相關基因Casp3、Fas表達水平上調,并導致促進胚胎發育和種植的LIF因子表達水平下調[24-25]。體外培養還可能影響胚胎對DNA損傷的修復能力,并導致某些參與氧化應激和脂質代謝的基因表達水平發生改變[26-27]。所以,體外培養時間過長可能對胚胎產生不利的影響。
另外,在胚胎-子宮內膜上皮的接觸過程中,胚胎來源的溶血磷脂酰膽堿(LPC)受內膜上皮自分泌運動因子(ATX)的催化作用,產生溶血磷脂酸(lysophosphatidic acid,LPA)。Yu等[28]研究發現LPA可能是支持胚胎體外發育的關鍵物質,LPA通過激活yes相關蛋白(YAP),啟動了合子基因的轉錄,在小鼠胚胎體外培養過程中加入LPA,可顯著提高胚胎發育速度,并獲得更高的著床率及活產率。同時,LPA可以結合子宮內膜間質細胞受體(LPA1),促進內膜和胎盤血管生成[29];還可以通過激活內膜上皮細胞的受體(LPA3),促使胚胎周圍的內膜上皮中肝素結合表皮生長因子(HB-EGF)和環加氧酶-2(COX-2)等母體因子上調,誘導蛻膜化,降低內源性大麻素(eCBs)的局部濃度,促進胚胎著床[30-31]。因此,及時進行胚胎-母體接觸,可能有利于胚胎發育和改善內膜容受性。
綜上所述,對于有優質D3胚的患者行FET,胚胎解凍后經2 h培養即移植入體內,較培養18 h后移植可以獲得更好的妊娠結局。本研究為回顧性研究且樣本量不足,結論尚需擴大樣本量,通過進一步前瞻性隨機對照研究加以證實。

